Способ получения алкоголятов металлов
Иллюстрации
Показать всеРеферат
1. СПОСОБ ПОЛУЧЕНИЯ АЛКОГОЛЯТОВ МЕТАЛЛОВ общей формулы M(OR )г,, где М - металл, выбранный из группы , титана, магния, алюминия, иттрия, циркония, ниобия, тантала и лантана; R - алкил, , нормального или изо-строёния; п - целое число от 2 до 5, jiyTeM переменнотокового электрохимического растворения электродов из соответствующего металла в электролите, содержащем и соль общей формулы КХ , где К - катион, выбранный из группы щелочного металла, аммония или четвертичного аммониевого основания, X - хлор, бром, иод, Bf, PFjCtO4 f взятую в количестве 2-20 вес.. %, при температуре кипения электролита, отличающийся тем, что, с целью упрощения процесса, предварительно осуществляют электролиз постоянным током до прекращения вы- ® деления осадка окислов соответствуюКЛ щего металла. 2. Способ по п.1, отлича ющ и и с я тем, что процесс ведут в электролите, содержащем ацетонит-5 рил, диметилсульфоксид, диметилформамид , бензол, толуол, в количестве от 2 до 20 вес.%. iQO 3. Способ ПОП.1, отлича ющ и и с я тем, что,, в качеств to материала катода используют тот же |00 10 металл, что и для анода.
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕ(НИХ
РЕСПУБЛИН
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ASTOPCHOMY СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО.ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3357867/23-04 (22) 27 ° 11 ° 81 (46) 30.03.83. Бюл. Р 12
; (72) В.А.Шрейдер, Е.П.Туревбкая, Н.И.Козлова,.Н.Я.Турова, И.Н.Рожков и И.Л.Кнунянц (71) Ордена Ленина институт элементоорганических соединений AH СССР ,им. A.Н.Несмеянова (53) 547.26 23.7(088.8) (56) 1. Патент ФРГ Р 2121732, кл. С 25 B 3/00, опублик. 1972.
2. Патент Англии Р 1136016, кл. С 2 С, опублик. 1968.
3. Патент Канады Р 1024466, кл. 204-43.5, опублик. 1978.
4. Патент Франции Р 2091299, кл. Н 03 К 4/00, опублик. 1972.
5. Авторское свидетельство СССР по заявке Р 2987164/23-04, 1980 (прототип) . (54) (57) 1. СПОСОБ ПОЛУЧЕНИЯ АЛКОГОЛЯТОВ МЕТАЛЛОВ общей формулы
M(0R )h, где М вЂ” металл, выбранный из группы.титана, магния, алюминия, иттрия, циркония, ннобия, тантала и лантанар
R — - алкил, С.1-С,1, нормального или изо-строения
„„SU„„1008282 А
Ч 25 В 3/00; С 07 С 31/28; уд) С 07 Р 7/00 и — целое число от 2 до 5, путем переменнотокового электрохимического растворения электродов иэ соответствующего металла в электролите, содержащем спирт и соль общей формулы КХ где К вЂ” катион, выбранный из группы щелочного металла, аммония илн четвертичного аммониевого основания;
Х вЂ” хлор, бром, иод, B @, РР6СВО4,, взятую в количестве 2-20 вес,. В, при температуре кипения электролита, отличающийся тем, что, с целью упрощения процесса, предварительно осуществляют электролиз постоянным током до прекращения вы- Е деления осадка окислов соответствующего металла.
2. Способ по п.1, о т л и ч а юшийся тем, что процесс ведут в электролите, содержащем ацетонитрил, диметилсульфоксид, диметилформамид, бензол, толуол, в количестве от 2 до 20 вес.Ъ.
3. Способ по п.1, о т л и ч а ю-,Q0 шийся тем, что,. в качестве материала катода используют тот же iФ ФЬ металл, что и для анода. !
;Ю
1008282
Изобретение относится к усовершенствованию способа получения алкоголятов металлов, являющихся ценными, продуктами для получения катализаторов и окисной керамики, применяемой в электронной промышленности.
Известен способ получения этилатов
Та, Ge, 51, Ti u lr путем электрохимического айодного растворения соответствующего металла в электролите, содержащем йН, (Рили (С йС2. Элект-10 ролиз проводят постоянным током при кипении электролита, напряжении 4060 В, силе тока 2 А, с использованием графитового катода. Выход составляет
70-78% (1 3. 15
%однако этот способ осуществим для ограниченного числа металлов.
Также известен способ получения этилатов кремния путем электрохимического анодного растворения ферроси- 0 лициевого анода в спиртовом растворе Ее 2(504)3 или Zn С02 с использованием графитового катода. Электролиз ведут при напряжении 70В, силе тока 2 А, получают продукт с выходом
60%52 ).
Недостатком этого способа является низкий выход целевого продукта.
Известен способ получения этилатов железа, кобальта и никеля путем элект рохимического анодного растворения .соответствуюцих металлов в спиртовом растворе электролита, содержащего перхлорат лития и бромистый литий.
Электролиз осуществляют при кипении электролита, напряжении 50-60 В, 35 силе тока 1,5 А с использованием графитового катода. Выходы составляют
75% 3 1.
Однако в этом случае осуществление способа также ограничено неболь- 40 шим количеством металлов.
Известен также способ получения алкоголятов металлов с атомными номерами 14-82 путем электрохимического анодного растворения соответствую-45 цего металла с помощью постоянного тока в электролите, содержащем спирт
С -С и электропроводную добавку формулы R4NX, где R — водород или алкил, Х вЂ” галоген. Электролиз осуцествляют при кипении электролита, напряжении 40-60 В, силе тока 0,5-2,0А с использованием графитового катода.
Выход конечных. продуктов составляет от 68 до 78% (4 ).
Недостатком этого способа является сравнительно низкие выходы конечных.продуктов и невозможность синтеза алкогблята ряда металлов.
Наиболее близким к предлагаемому по технической сущности является спо-60 соб получения алкоголятов обцей формулы
И (ОН) где N — металл, выбранный из группы титана, магния, алюминия, 65 иттрия, циркония, ниобия, тантала, лантана;
R - алкил С -СЗ, нормального или изо-строения;
n — целое число от 2 до 5, путем электрохимического растворения соответствуюцего металла в электролите, содержащем спирт и электропроводную добавку.в виде соли
КХ (где К - катион, выбранный иэ щелочного металла, аммония или четвертичного амаониевого основания;
Х - галоген, ВГ4, PFg, С20 ), с по.— мощью переменного тока промышленной частоты. В этом способе оба электрода изготовлены из одного и того же металла, величина тока составляет
0,15-0,5 А, напряжение составляет
130-220 В. Выходы целевых продуктов составляют 71-97% по веществу и 68148% по току С5 ).
Недостатком данного способа является необходимость применения абсолютных спиртов, обезвоживание которых осуществляют с помощью алкоголятов кальция или алюминия. Применение промышленных влагосодержащих спиртов привоцит к невозможности синтеза целевых продуктов.
Цель изобретения - упрощение процесса.
Поставленная цель достигается способом получения алкоголятов металлов обцей формулы
M(OR ) где И вЂ” металл, выбранный из группы титана, магния, алюминия, иттрия, циркония, ниобия, тантала, лантана, R ..— - алкил С>-С4,нормальнОГО или изо-строения;
n — целое число от 2 до 5, путем переменнотокового электрохимического растворения электродов из соответствуюцего.металла в электролите, содержащем спирт и электропроводную добавку формулы КХ (-где К вЂ” катион. целочного металла, аммония или четвертичного аммониевого основания, Х вЂ” галоген, BFy, PF6 или С204), взятой в количестве 2-20%, при температуре кипения электролита, предварительно осуществляют электролиз постоянным током до прекращения выделения осадка окислов соответствуюцего металла.
Целесообразно в электролит вводить дополнительно ацетонитрил, диметилсульфоксид, диметилформамид, бензол, толуол в количестве 1-20 вес.%.
В качестве материала катода использовать тот же металл, что и для анода.
Отличительной особенностью данного. способа является проведение электрохимического растворения металлических электродов в две стадии, при1008282 чем на первой стадии предварительно ведут электролиз постоянным током до прекращения выделения осадка окислов соответствующего металла.
Целесообразно дополнительно вводить растворители, например, ацетоннтрип, диметилформамид, диметилсульфоксид, что приводит к увеличению электропроводности раствора, так как полярные растворители имеют диэлектрическую постоянную выше, чем у не-. которых спиртов (особенно высших ® спиртов ), введение неполярных растворителей (бензола, толуола ) в электролит приводит к тому, что указанный растворитель хорошо адсорбируется на поверхности электрода и тем 1$ самым улучшает растворение алкоголятов, особенно тех, которые плохо растворимы в спирте.
Кроме того, при таком проведении процесса целесообразно в качестве ма- З1 териала катода испольэовать тот же металл, что и для анода.
Проведение процесса по данному способу позволяет использовать для синтеза промышленно выпускаемые спирты, содержащие до 4Ъ воды. При этом, на первой стадии - постояннотоковой - происходит разложение воды, присутствующей в электролите, а на последующей стадии - переменнотоковой - осуществляется синтез алкоголятов метал- 30 лов.
Пример 1. Для электролиза применяют стеклянную ячейку, снабженную "рубашкой" для термостатирования, .термометром, погруженным в электро- 35 лит, и двумя плоскими электродами из титана. Электролит содержит 100 мл этилового спирта, содержащего 4% во-, ды и 5% тетраэтиламмоний бромида.
Первая стадия продолжительностью в 4О б ч при силе тока 0,2 A и напряжении 60 В сопровождается выделением осадка окиси титана, выпадающего на дно электролизера. После прекращения осадкообразования осуществляют вторую стадию электролиза при 70 С с помощью переменного тока в 50 Гц. (+10%) при силе тока в 0,5 A и-напряжении 220 В ° За 130 мин электролиза получают 1 6 г.тетраэтоксититана с т.пл. 40 С, т.кип. 135 C/
/5 мм рт.ст. Образовавшийся продукт выделяют перегонкой в вакууме. Выход тетраэтоксититана по эффективному току составляет 71%, а по веществу 90% °
Выход по эффективному току опре;деляют следующим образом. выход по току
М- мол.вес х 100а, где м - вес полученного продукта в граммах и - число электронов (соответствует числу OR rpynq);
А - амплитуда переменного гока, в амперах;
" продолжительность электролиза в часах) мол,вес.молекулярный вес полученного алкоголята в граммах.
Выход по веществу определяют по уменьшению веса электродов Ilo фррмуле выход по веществу = — — - — - — -х1003 м.атомн.вес ам.мол.вес. где м - вес полученного продукта в граммах; ьм - потеря веса электрода в граммах на второй стадии) мол.вес.-молекулярный вес полученного алкоголята; атомн.вес. - атомный вес применяемого металяа.
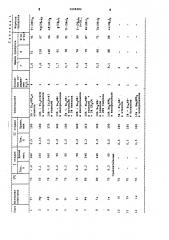
Полученные результаты приведены в табл.1. хоовгвг
„,1 63 1 ,. 1 ЕН
I !»М Ф
1 g» I Ô, 1 аo !о 1 0 а !
»«
Х1ВХ 1I !6
1 I I ! 0»
gNI 1н е I 1» 1 I ! dPPl
1 l6 I ! н!
М Ь.Ф
1» I 1
1 41 - 1 ! О!
I а! 4Р 1!ч
Х I. !1 !
1 Ц 1 I
I ОЬ- — Ч
l ъ
1 . 1 4 1
1 I н4 .
1 I
In и
И о .0 а
In и
И .о е ч
Ф
Р
Ф о й
Р!Ъ
И о м
Ф, I 1
OL а
Ъ !!
I I
CO
CO н л
l ь
° «Ф
РЪ н
CO о о
1 ! !
Фo I
»
C4t ly
Ж 1
1. ! 1
1 01
1 ЦОЕ
I НЕЙЕ
1иоех
1 ХЦХ и е ок м 0
l Х ю е
cnд .0 и а
М ! о
Ф Х
D ч-4 NI е к
-о м е
ФХ з О
III A 3
Cd М
СЧ NI
Э. к о лв О
Фа
Э И ао
4Р М
D м NI
csе к
ИО
I 63 н
CN! 6) о н NI е
+к
L+ Ф со к гфО зОХ
МХЭ
e o
«, н !
»ЬР
ЮШ
Ю, Р! + ь+
a z
+eu л к м а ож
ХО
1 . Н4Р еЧ NI+
L а а ф
we zg ак 1о иО эх
Их Фе е н ! н б) Ю
anNl ОД се3 Х Cá э О
03 а к! о
"dJ Х
ill.еЧ ф о
: 1
+0 I
Э Х
03 Е ФР но
4Р ф nl о н4 !O+ с
I М
Ц1 ЭХ
1 I
1 H (1Н с
1 I Х ое
1 Е
1 I !
I
1 ! о ! CO
1 ч-!
D
° -Ф о
СО 4
Ю
М
Ю о
Ю
%.4
4Ч
Ю
I
1
1 IA !
» !
Ю л
° Ф
» о
ЦЪ
\ о
И
\ о!
»! с
crl
Ю
С Ъ
» ь
cv
Ю!!) . МЪ
» »
Ю D
Еп
Ю
» о
I .1
1 1К ! Д»
I Ö1e Х 1Ю ! кХ
l <б !А о
1О о о
ОЪ чР!!
1 Н 1 о
1 I
11! ! »
1 М>4
О н
С Ъ х
3 а и
<Ч с
C) СЧ
СЧ
» о
РЪ
» о
%»
» о
CO
ЮО о !
D л!
1.
1
1 !
1—
I Е»
1
1 Кkt
Ео
1 Х0
1 0 Н
l Е Ы
1 Н Е
I Р„ й
1 е
Л !
1 Р .е! б »
М
1 Н
1 Я
1 Х
1О
Г4 M
1
1
I Н
1 Х
1 К ! о а
1 Н
1 Х
1 Э ! к
1 бЪ
1!
1
I NI
I Ì.
1 со
1 Е
I и Э
I И
0 1 I ! юн
I EA Р! ю о о о ю л ! °
1! РЪ с Ъ
». » » о о D!
l
I
1
I.
1
l
I
I
1
I
I
I н
Э
49 I
Ф Х 1
Е 1
ФХ
3R ! о ю Х ь
1008282.Таблица 2
Характеристки
Элементный анализ
Опыт
Продукт
Вычислено
Найдено
8,8. 21,0 (8,8) (21,1) Т1 (OE4)y
Кристаллы; т.пл. 40 С т.кип. 135ОС
/5 мм рт.ст.
42,0 (42, 1) 17,0
И (ОР„
50,5
5,1
Бесцветный порошок; разлагается при нагревании (50,6) 5,0) (17,1) 44;4 9,3 (44,4) (9,3) AT(OE+)p
16 6.(1hi 7) .
Бесцветный порошок; т.пл. 140 С у(ОР„ „)З Бесцветные кристал. лы
33 5 (33,5) 7,8 (7,9) 40,5 (40,6) 14,8 (14,5) 58,0 11,1 (58,2) (10,9) Вселяются иглы тава Zr (OP )+, i-PrOH (разлагается при нагревании) Zr (0P„$+ сос8,8
43,8
27,7 (44,0) (8,6) (27,9) 29,5
Желтая жидкостьр т.кип. 160 С/ !
0,1 мм.рт.ст.
8,1
37 5
М Ь. (ОЕ t)g (29,2 (37,7) (7,9) 44, 8
29,5 6,0 (29,6) (6,2) (44,6) .
43,7
6,5
34,1 т.пл. 129 С (44,0 ) .(34, 2) (б, 6) Пример 2-9. Аналогично при- . меру 1 проводят синтез ряда алкоголятов металлов. В табл.1 приведены материалы анода, температура процесса, состав :электролита, целевой продукт, выход по току и веществу, содержание воды в электролите и условия проведения первой стадии. Выделение жидких при комнатной температуре алкоголятов осуществляют перегонкой в вакууме, крисТ i (OBu) Желтая жидкость. Та(ОЕе)5 Желтая жидкость, т.кип. 140 С/
0,1 мм рт.ст. а (ОР„ ) Белые кристаллы, Пример ы 10-12 (сравнительные) . Для сравнения проведены электросинтезы ряда алкоголятов металталлические алкоголяты выделяют фильтрованием раствора после его охлажде-, ния до комнатной температуры.З последнем случае электролит подвергают фильтрованию после окончания первой стадии для отделения от осадка окислов.
В табл.2 приведены данные элементного анализа и характеристики полученных алкоголятов.
1 лов аналогично примеру 1; но без. применения предварительной стадии на постоянном токе. В этих же при9 1ОО8282 16
Составитель Л. Горбачева
Техред Ж.Кастелевич КорректорA Гриценко
Редактор Е.Кинив
2277/37 Тираж 641 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Иосква, Ж-35, Раушская наб., д. 4/5
Заказ
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4 мерах содержание воды также при;ведено в табл.1. Однако, в этих примерах получить целевые продукты не удается иэ-sa того, что адсо;бировавшаяся на электродах вода не позволяет осуществить процесс.