Способ определения урата в плазме и сыворотке крови
Иллюстрации
Показать всеРеферат
СПОСОБ ОПРЕДЕЛЕНИЯ УРАТА В ПЛАЗМЕ И СЫВОРОТКЕ КРОВИ, предусматривающий контактирование исследуемой пробы с урикаэой и каталазой при рВ 8-8,1, отличающийся тем, что, с целью повышения селективности определения и упрощения процесса , пробу первоначально вводят в контакт с каталазой,алэатем с уриказой, иммобилизованными на пористом стекле/ содержащем покрытие из пентоксида ниобия, с последующим определением хемилюминесцентным методом количества выделившегося пероксида водорода, по которому определяют количество урата.
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИН
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
flO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ARTOPCNOMV СЕИДатВЪСтву
;:(21) 3303842/28-12 (22) 17.04.81 (46) 30.03.83. Вюл. Р 12 (72) В.И. Ригин (53) 543.9(088 8) (56) 1. Патент Великобритании
Ю 1456925, кл. G 1 В, опублик;. 1976.
2. Hinsch lf. Antonijevic A.
Випйагаа P.V. "The Use of Immobilized
Uricase/А1йеЬуйе Dehydrogenase NylonTube Reactors in the Automated Oeter"
mination o$ Uric Àñàé in Rerum", P resenius Ze itschri f t f Qr Analytischen Chemic 1980, 301, 161.
3 ° Ригин В.И. Хемилюминесцентный метод определения микроколичеств хо лестерина с помощью йммобилизированных ферментов. - "Журнал аналитической химии", 1978, е. 33 ° вып: 8, с. 1623 1630 " ц ющ
„„gu„„1008657
3(511 G 01 N 33/48; С 12 g 1/26 (54) (57) СПОСОБ ОПРЕДЕЛЕНИЯ УРАТА В
ПЛАЗМЕ И СЫВОРОТКЕ КРОВИ, предусматривающий контактирование исследуемой пробы с уриказой и каталазой при рН 8-8,1, отличающийся. тем, чтб, с целью повышения еелективности определения и упрощения процесса, пробу первоначально вводят в контакт с каталазой,аззатем с уриказой, иммобилизованными на пористом стекле, содержащем покрытие из пентоксида ниобия, с последующим определением хемилюминесцентным методом количества выделившегося пероксида водорода, по которому определяют количество урата.
10086 57 раствор пропускают через кювету для фотометрического анализа, фотометрируют при 420-4б0 нм (1 ), К недостаткам данного способа относятся длительность анализа, так как диализ растворов — процедура крайне длительная, малая точность определения, так как фотометрированию мешают все содержащиеся в крови окрашенные соединения, большой расход ферментов, иэ-за чего стоимость анализов высока,.что не позволяет использовать способ для массовых анализов.
Наиболее близким к предлагаемому по технической сущности является способ определения урата в плазме и сыворотке крови, заключающийся в пропускании исследуемой пробы при рН
8-8,1 через нейлоновый трубчатый реактор, на стенках которого. иммобилизованы уриказа и альдегиддегидрогеназа. Кроме того, в реакционную среду непосредственно вводится фермент каталаэа
УРаг + 0 аллантоин урикаэа каталаэа
Н2О2 + этанол ацетал
Ацетальде гид + НАД
+ альдеги
+ С02 + Н О
2 2 фермента, и тем, что никотинамидадениндинуклеотид принадлежит к числу очень дорогих и скоропортящихся реактивов, его использование резко удорожает анализ.
Кроме того, иммобилизованные на поверхности нейлонового реактора ферменты сравнительно легко вымываются анализируемым раствором, ферменты теряются и активность реактора уменьшается, срок службы такого ферментного реактора не превышает 20 дней. цель изобретения - повышение селективности определения и упрощение процесса.
Указанная цель достигается тем, что согласно способу определения урата в плазме и сыворотке крови, заключающемуся в контактировании исследуемой пробы с урикаэой и ката. лаэой при рН 8-8,1, пробу первоначально вводят в контакт с каталазой, а затем с уриказой, иммобилиэованными на пористом стекле, содержащем покрытие иэ пММтоксида ниобия, с последующим определением хемилюминес центным методом количества выделившегося пероксида водорода,по которому определяют количество урата. указанная последовательность стадий процесса, а также применение описанных иммобилизованных форм ферментов обеспечивают возможность максимального устранения побочных реакИзобретение относится к клинической биохимии, а именно к разделу клинического медицинского анализа.
Урат принадлежит к числу обязательных компонентов крови, в норме содержание урата в плазме крови сос- 5 тавляет 0,02-0,04 г/л. Уровень содержания урата в крови имеет важное диагностическое значение, повышенное содержание его характерно, например, для заболеваний подагрой, резкие коле 0 бания содержания урата в крови наблюдаются при почечнО-каменной болезни.
Известен способ определения урата в плазме и сыворотке крови, состоящий в том, что анализируемую пробу разбавляют раствором типа физиологического, подвергают диализу, смешивают диализат с раствором фермента урика-. зы, растворенного в водной буферной смеси с рН 8,5-10, инкубируют полученный раствор при 37 С в течение
4 мин, смешивают инкубированный раствор с водным раствором замещенного бенэидина или дифенилина, с водным раствором фермента пероксидазы и с водным буферным раствором
25 с рН 5,5-8,5, полученный окрашенный где НАД+ — никотинамидадениндинуклеотид в окисленной форме;
НАНД вЂ” никотинамидадениндинуклеотид в восстановленной форме.
Содержание урата находят, измеряя содержание ионов водорода, образующихся в последней реакции L2 J. 40
Иммобилиэованные уриказа и альдегиддегидрогенаэа позволяют проводить многократные определения урата с. одной и той же порцией фермента, благодаря чему уменьшается расход фер- 45 ментов и снижается стоимость анализа.
Простота регистрации отклика дает воэможность автоматизировать определение.
Недостатки способа заключаются в том, что малая реакционная поверхность нейлонового реактора-трубки замедляет основные реакции, из-за чего возникает много побочных реакций, приводящих к ошибкам в результате анализа.
Большой ассортимент вводимых в анализируемый раствор реагентов связан с возможностью протекания разного рода побочных реакций, искажающих результат анализа и снижающих 60 селективность определения. Реализация способа усложняется также необходимостью введения в анализируемый раствор фермента каталаэы, которая приводит к необратимым потерям этого 65
Способ основан на последовательно протекающих ферментативных реакциях ьдегид + Н О дрогеназа ацетат + НАДН + Н+
1008657 ций, что позволяет повысить селективность определения, а также упростить процесс, поскольку его осуществление основано на двух (а не трех) ферментативных реакциях, Кроме того, используемые иммобилизованные ферменты являются. стабильными и обеспечивают большую продолжительность использования. Данный способ для реализации не требует использования НАД.
Процесс основан на следующей схеме.
Фермент уриказа (уратоксидаза, урат: 0 оксидоредуктаза, К.Ф. 1. 7. 3, 3) катализирует реакцию окисления урата кислородом с образованием аллантоина и пероксида водорода 15 урикаэа урат + О аллантоннтнтСн
Количество образовавшегося пероксида водорода эквивалентно количеству прореагировавшего урата. Насыщение буферного раствора, в котором проводят ферментативную реакцию, кислородом обеспечивает практически мгновенное протекание этой реакции. фермент катализа разлагает все перекисные соединения, которые могут присутствовать в анализируемом веществе, с образованием кислорода, и тем самым устраняет возможность ошибки, вызванной взаимодействием этих перекисных соединений с люминесцентным реагентом.
При использовании хемилюминесцентного метода ЕЗ 3 пероксид водорода подвергают реакции с замешенными арилоксалатами, образуя пероксиоксалаты, которые мгновенно распадаются, причем распад сопровождается яркой хемилюминесценцией, интенсивность которой пропорциональна кон центрации пероксида водорода в раст- 49 воре. В присутствии флуоресцентных реагентов с сопряженными двойными связями типа антрацена или перилена яркость свечения резко возрастает, что облегчает регистрацию хемилюми- 45 несценции.
Способ осуществляют следующим образом.
Пробу анализируемого вещества вводят в поток насыщенного кислородом О фосфатного буферного раствора с рН 8, проходящий последовательно через две колонки с ферментами, иммобилизованными на покрытых пентоксидом ниобия шариках из пеностекла, причем в. первой колонке находится фермент каталаза, во второй - фермент уриказа, и в выходящем из второй колонки растворе определяют содержание пероксида водорода хемилюминесцентным методом (3 по реакции с бис-(3,4,6-трихлор- 60 фенил)-оксалатом в присутствии 9„10-дифенилантрацена, по найденному содержанию пероксида водорода рассчитывают содержание урата в анализируемом веществе.
Экспериментально установлено, что наилучшие результаты дает применение в качестве хемилюминесиентного реагента бис-(3,4,6-трихлорфенил)-оксалата, а в качестве флуоресцентного реагента 9,10-дифенилантрацена.
Эта реакция дает возможность по интенсивности свечения определять очень малые количества пероксида водорода, благодаря чему резко снижается требуемый объем анализируемоговещества (для единичного определения достаточно 50 мкл плазмы или сыворотки крови, против 10 жп по обычно используемому методу, т.е. в 200 раз меньше). Введенная в поток буферного раствора проба анализируемого вещества разбавляется.много раз при этих: разбавлениях окрашенные компоненты крови не оказывают никакого статистически значимого влияния на результат определения. На реакцию пероксида водорода с замещенными арилоксалатами не влияют белковые вещества, поэтому не требуется операция диализа анализируемого раствора., Измерение хемилюминесценции может проводиться в автоматическом режиме.
Иммобилизацию ферментов проводят следующим образом.
100 вес.ч. шариков из пеностекла, имеющих средний диаметр 0,25-0,35 мм и средний диаметр пор 200-500 нм высушивают в вакуумном сушильном шкафу при 150 С и остаточном давлении
0,1 Па. Затем высушенные шарики помещают в кварцевы(. стакан, заливают
150 вес.ч. 1В-ного раствора пентахлорида ниобия в безводном этиловом спирте, стакан устанавливают в вакуумэксикаторе и откачивают воздух до начала .кипения жидкости. в стакане, повторяют процедуру откачивания воздуха 5 раз. Далее стакан вынимают из вакуум-эксикатора и при интенсивном перемешивании содержимого стакана . пропеллерной мешалкой вливают в стакан 150 вес.ч. воды. Перемешивают массу в течение 30 мин, дают отстояться, декантируют жидкость и приливают новую порцию 150 вес.ч. воды.
Вновь перемешивают 30 мин, отсасывают шарики на воронке Бюхнера, промывая буферным раствором с рН 10. Промывку повторяют 3 раза. Промытые шарики готовы к употреблению, их хра нят в фосфатном.буферном растворе с рН 8.
Для иммобилизации растворяют
1 вес.ч. фермента B 200 вес.ч. буферного раствора с рН 10,5, в полученный раствор вносят 8 вес.ч. шариков иэ пеностекла, покрытых пентоксидом ниобия,- и оставляют в растворе на
24 ч при интенсивном перемешивании смеси магнитной машалкой, при 3537 С . Затем шарики отсасывают на воронке Бюхнера, промывая фосфатным
1008657 буферным раствором с рН 8, промытые шарики до употребления хранят в фосфатном буферном растворе с рН 8 при
4 С.
В колонку для проведения ферментативной реакции загружают шарики 5 с иммобилиэованным ферментом с таким расчетом, чтобы высота слоя шариков была в пределах 35-45 мм. Для проведения измерений используют установ» ку (33. 10
Пример 1. Определение урата в образцах крови.
Анализу на содержание урата подвергают образцы плаэьи и сыворотки донорской крови стандартного консер- 15 вирования, а также плазму и сыворотку крови больного почечно-каменной болезнью на разных стадиях болезни.
Для анализа собирают установку (3).
Иммобилиэуют ферменты, как описано р выае, загружают шарики с иммобилизо ванными ферментами в колонки, устанавливают постоянный поток буферного раствора через систему, включают регистрирующую установку и проводят 25 корректировку нуля измерительного прибора.
Отбирают 200 мкл анализируемого образца (плазмт или сыворотки) в шприцевый микродоэатор и далее последовательно проводят три определения, вводя.в установку по 50 мкл анализируемого образца и измеряя интенсивность хемилюминесценции. Содержание урата определяют по градуировочному графику. 35
Параллельно те же образцы анализируют на содержание урата способомпрототипом с использованием иммобилиэованных на поверхности нейлоновой трубки-реактора ферментов уриказы 40 и альдегиддегидрогеназы, также повторяя анализ три раза.
Полученные в эксперименте результаты обрабатывают следующим образом.
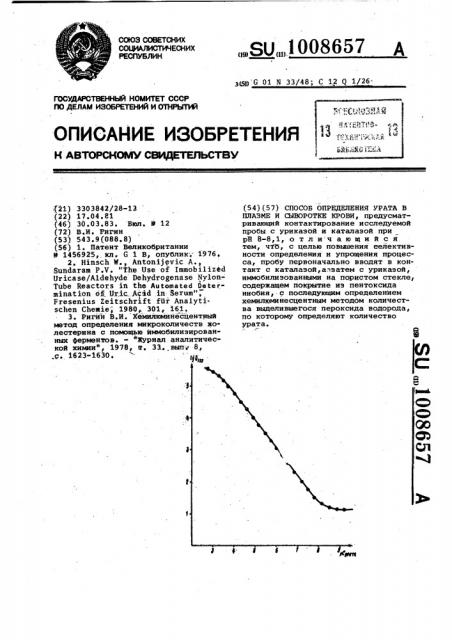
По табл. 1, в которой приведены 45 результаты изучения влияния концентрации урата в анализируемом растворе на величину интегрального значения интенсивности хемилюминесценции, возникающей на конечном Тапе определе 50 ния урата, строитея градуировочный график в билогарифмических координатах (cM. чертеж) . В диапазоне содержаний урата в пробе анализируемого раствора 2 10 8-. 8.10 моль/л зависимость имеет линейный характер» Ne- 55 тодом наименьших квадратов найдено уравнение прямой, описывающей зту зависимость рС = 9,5852 — 1,1733 1 ( где рС - отрицательный логарйфм мо- 60 лярвой концентрации урата;
Q — интегральное значение инхп тенсивности хемилюминесценции, выраженное через ток фотоумножителя, нА с, Таблица1
Эависимость интегральной интенсивности хемилюминесценции (Ц3„ ) от концентрации урата в анализируемом растворе
Величиíà Q3 нА с среди ее из 5 измерений концентрация урата, моль/л
20 10 9
3,О ° 1О
4 0 10
S,O 10
8,0 ° 10
1,00" 10
2,00 10 8
4,00 . 10
5 00 . 10
8 00 10 8
1,00 - 10 11
2,00 " 10-1
4,00 . 10
5,00 10
8,ОО: 1О
1,00 10 г,оо . 1о б
4,00 10
5 00 10
8уоо . 10
1,ÎÎ ° 1О 5
2 00 . 10
4,00- 104
5 00 10
8,00 . 1(Г
1,оо - мг4
2 00 ° 10
10-4
00 .. 10-4
8,00 10
1 ОО. 1Оз
14,4 6,5
14,9 4,4
15 4 36
16,7 g.-3 .
19 9 + 3,0
22,9 + 2,9
39,8 g гр8
72,4 3 9
88,7 + 6,7 (12,9+0,6) ° 10 (15,8 1,0) 10 (29,2 2,1) ° 10 (52,6+2)8) ° 10 (65,3+4,0) ° 10 (92,9 6,7) - 10 (11 5+0 6) 10 (20,9+1,5)- 10 (37,7+1,7) ° 10 (45,1 2,8) ° 10 (67,014 9) 10 (82,1+4,5) ° 10 (14,7+.0,8)- 108 (26(5+1,9). 10 (Згр4 2(2) 103 (47,6 3,0) ° 10 (49,5 4,0) 10 (11,0+0,5). 104 (19,8+1,1) ° 10 (22,721 4). 10 (32,6 2,5) ° 10 (39,1 3 8) 10.
1008657
T аблиц а 2
Определение урата в образцах крови
Найдено урата, мг/л, способом
Образец прототипом предлагаемым
Sr
0,04
Плазма 1
27,6
0,03
27,7
0,04
16,8
0 03
16,5
24,2 0,04
0,04
24,3
38,6
0 06
0 03
38,9
9,3
Сыворотка 1
19,1
0,04
0 05
31 8 0,05
0,04
30 5
Кровь больного:
0,06
0,05
53,2 0,04
68 5 0,05
52,6
68 7 до приступа во время приступа в период ремиссии
37,4- 0,04
0 04
37,2
Затрата времени на
1 определение, мин
П р и м е ч а н и е. С среднее содержание урата, S - относительное стандартное отклонение.
Таблица 3 удерживание фермента. на носителе
Найдено урата в образце плазма крови, мг/л, способом
Время непрерывного промывания реактора буферным раствором, ч прототипом
1 я„ предлагаеьим
С, Mp/Jt S
С, мг/л
24,2
24,1
0,04
0 03
24,3
24с4 .
0,04
0 04
Как видно из табл. 2 предлагаемый способ не . уступает по точности опре-40 деления известным, -является более простым и селективным.
Пример 2. Сравнение удержания ферментов на носителе и сохранения постоянства активности фермент-45 ного реактора при длительном использовании.
Собирают установку (3 ). устанав-, ливают постоянный поток буферного раствора через реакторы, по истечении определенного промежутка времени анализируют один и тот же образец плазмы крови с известным содержанием урата.
Параллельно собирают установку по способу-прототипу с нейлоновым трубчатым реактором, устанавливают постоянный поток буферного раствора через реактор, равный потоку буферного раствора в способе-прототипе.
Через те же саьые промежутки времени анализируют.тот же самый образец плазмы крови.
Результаты представлены в табл.3., 10
1008657
Продолжение табл. 3
Время непрерывного промывания реактора буферным раствором, ч
Найдено урата в образце плазмы кРови, мг/л, способом прототипом
t предлагаемым
С, мг/л 1
С, мг/л
24,2 .24,4
24,5
24,3
24,2
24,3
24,4
22,1
18, 5
3,8
Не обнаружено
Не обнаружено
0,06
0,03
0,04
0i03
0,04
0,03
0,03
0,04
24
48
72
96
144
0,12
0,55
Не обнаружено
Не обнаружено
Найдено урата, мг/л, способом
Срок хранения, мес предлагаемым (г прототипом
) Sr
24,1
0,03
24,3
0 04
24,4
0,05
23,8
0,05
24,1
0,04
15,1
0,48
0,05 Не обнаружено
0,05 Не обнаружено
0,04 Не обнаружено
0,05 Не обнаружено
23,7
23,6
24,0
24,2
Предлагаемый способ после 144 ч туру ферментных реакторов равной промывания ферментных реакторов бу- 4 С и оставляют при этих условиях ферным раствором показывает одинако- на задавное время. Через заданный вые с исходным результаты определе- 2 промежуток времени включают установния содержания урата в образце плаз- ку и проводят определение урата в мы крови. плазме крови, как описано выше.
Способ-прототип после 24 ч промывания реактора буферным раствором Параллельно готовят ферментный дает колеблющиеся результаты после РеактоР по способУ-прототипу иммо30
48 ч промывания реактор полностью билизуя уратоксидаэу и альдегиддегидтеряет активность и определение ста- рогеназу на внутренней стенке нейлоновится невозможным. новой трубки. Готовый ферментный реак
Пример 3. Влияние срока хра- тор заливают буФерным раствором и нения ферментного реактора с иммоби- погружают в термостат с температурой лизованными ферментами на результат З5 4 С, хранят в этом термостате. Через о определения урата в плазме крови. заданный промежуток времени реактор
Собирают установку (3 1, Иммобили- вынимают из термостата., устанавливают зуют ферменты на шариках их пеностек- температуру реактора равной 37 С и ла, покрытых пентоксидом ниобия, проводят определение, как описано загружают шарики в реакторы, подклю- 40 в способе-прототипе. чают реакторы к установке. Полностью .готовую к работе установку подключа- Полученные результаты представлеют к термостату,устанавливают темпера- ны в табл. 4.
Таблица 4
Влияние срока хранения ферментного реактора на результат определения содержания урата в плазме крови
1008 57
Составитель О. Скородумова
Редактор A. Лежнина Техред И.Гайду Корректор Л. Бокшан.
Заказ 2330/55 Тираж 871 Подписнбе
ВНИИПИ Государственного комитета СССР
rio делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4
Хранение ферментного реактора с ферментами, иммобилизованными на .шариках иэ пеностекла, покрытых пентоксидом ниобия, в течение года не сказывается на активности ферментов и не влияет на результат анализа, в то время как ферментный реактор, изготовленный в соответствии со способом»прототипом, через 4 ыес хранения дает непригодные результаты, а через 6 мес полностью теряет активность.
Преимущества предлагаемого способа по сравнейию с прототипом состоят в том, что вместо трех. ферментов для анализа требуется только два, ферментный реактор служит дольше { не менее
5 12 мес. против 4 мес. по способу-прототипу),. затраты времени на анализ в 2 раза меньше, исключается применение дорогих и скоропортящихся реактивов тина никотннамидадениндинуклеотида, отсутству10 ют помехи от окрашенньх веществ, определение легко автоматизируется.