Способ получения этиленненасыщенных гидроксиацеталей
Иллюстрации
Показать всеРеферат
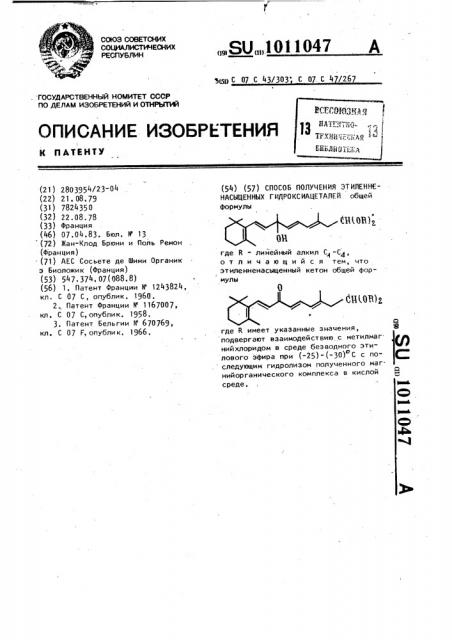
СПОСОБ ПОЛУЧЕНИЯ ЭТИЛЕННЕНАСЫЩЕННЫХ ГИДРОКСИАЦЕТАЛЕЙ общей формулы .-,,,. ои где R - линейный алкил , отличающийся тем, что этиленненасыщенный кетон общей формулы О Сн1ов)г i где R имеет указанные значения, подвергают взаимодействию.с метилмаг (Л нийхлоридом в среде безводного этилового эфира при (-25)-(-30)С с последующим гидролизом полученного магнийорганического комплекса в кислой среде. ,
„„5U „„1011047
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИН
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ бн ОВ) 2
4Р
Ю юМ
° 1. ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 2803954/23-04 (22) 21. 08, 79 (31) 782435 0 (32) 22.08.78 (33) Франция (46) 07.04.83. Бюл, и 13 (72) Жан-Клод Брюни и Поль Ремон (Франция) (71) AEC Сосьете де Шими Органик з Биоложик (Франция) (53) 547 37". 07(088. 8) (56) 1. Патент Франции Р 1243824, кл. С 07 С, опублик, 1960.
2, Патент Франции Н 1167007, кл. С 07 C,опублик. 1958.
3. Патент- Бельгии 4" 670769, кл. С 07 F, опубли к. 1966.
><> Ñ 07 С 43Д03 С 07. С 4 Д67 (54) (57) СПОСОБ ПОЛУЧЕНИЯ ЭТИЛЕННЕНАСЫЦЕННЫХ ГИДРОКСИАЦЕТАЛЕЙ общей
Формулы где В - лийейный алкил С„ -С,1, отличающийся тем, что этиленненасыщенный кетон общей формулы а где К имеет укаэанные значения, подвергают взаимодействию с метилмаг нийхлоридом в среде безводного этилового эфира при (-25)-(-30) С с по следующим гидролизом полученного магнийорганического комплекса в кислой Я среде, Э ай
1011047 ствии водного раствора соляной кислоты.
Согласно этому способу необходимо для получения альдегида витамина
А (ретиналя) иметь в качестве исходного соединения продукт общей формулы (111), в которой и 2. Соединение общей формулы (III) получают согласно известному способу 121 из общей формулы (III), в которой п 1.
Недостатком известного способа получения ретиналя является много" стадийность процесса: используя в качестве исходного продукта Р-ионон, 15 требуется осуществить шестистадийный синтез для получения Р -гидроксиацеталя С20(соединение общей формулы V).
Цель изобретения - получение новых соединений, являющихся промежуточными для получения. ретиналя, использование которого упрощает способ получения конечного продукта.
Поставленная цель достигается согласно способу получения этилен25 ненасыщенных гидроксиацеталей общей формулы (Н (()3) (1) (HO (111) <н(ОВ, где и имеет вышеуказанные зыачения, с получением Р -кетоацеталя оби и фор30 мулы
М(0В) (I Н) бивав, где К и и имеют значения, аналогичные указанным выше. 40
Действием органометаллического соединения продукт общей формулы (IV) переводят в Ъ-метил- -гидроксиацеталь общей формулы (ОЯ) (Н) Изобретение относится к способу получения. новых этиленненасыщенных гидроксиацеталей общей формулы где R - линейный. алкил, содержащий
1-4 атема углерода.
Известен с особ получения веществ, относящихся к семейству каротиноидов общей формулы где n -; равное 1, 2 или 3,. путем взаимодействия алкилформиата общей формулы Н-COOR, в которой Rалкил, содержащий 1-4 атома углерода, и метилкетона общей формулы где R и и имеют значения, аналогичные указанным выше.
Переход соединения общей формулы (V) в соединение. общей формулы (11) осуществляют путем дегидратации тре.тичного спирта и гидролизом группы ацеталя с промежуточным образованием ретроацеталя 1 1 ).
В основном дегидратацию и гидролиз осуществляют в ацетоне в присутгде R - линейный алкил С -С,, 1 путем взаимодействия этиленненасыщенного кетона общей формулы где R - имеет укаэанные значения, с метилмагнийхлоридом в среде безводного этилового эфира при (-25)-(-30) С с последующим гидролиэом полученного магнийорганического комплекса в кислой среде.
Исходный этиленненасыщенный кетон получают при взаимодействии f5 -ионона формулы с ацетальальдегидом общей формулы
oh (gt08)2 где R имеет вышеуказанные значения, 1011
Исходный ацетальальдегид исполь- 50 зуют в количестве 1-1,7 моль на моль использованного -ионона.
Значение температуры реакции не является критическим, поэтому возможно осуществлять процесс от -50 С ss
0 до температуры кипения реакционной смеси, предпочтительно от -30 до ,600С.
Конденсацию осуществляют в присутствии агента анионизации.
Агент ионизации представляет собой основной агент, обладающий активностью, достаточной для анионизации
Р-ионона, В качестве агента анионизации используют гидриды, амидсодержащие соединения, алкоголяты или гидроокиси щелочного металла, в основном натрия. Предпочтительно Нс 1ô пользовать метилат натрия. Целесообразно применять 0,05-1,5 моль агента анионизации на моль использованного р-ионона. Процесс обычно ведут в среде растворителя. 1$
Природа растворителя не влияет на условия процесса, однако выбранный растворитель должен быть инертным по отношению к используемым реагентам, предпочтителен менее полярный 2в растворитель.
Особенный интерес представляют алифатические жидкие растворители, такие как гексан, циклоалифатические такие как циклогексан, ароматичес- р ,кие, такие как бензол, галогенсодержащие производные, такие как 1,2-дихлорэтан простые эфиры, такие как диэтиловый, тетрагидрофуран и диоксан; спирты, такие как метанол; нитрилы, такие как ацетонитрил; амиды, такие как диметилформамид или
М-метилпирролидон„ В том случае, когда используют гидроокись щелочного металла, можно процесс вести в воде, предпочтительно в смеси вода-организ ческий растворитель, или в присутствии гидроокиси четвертичного аммония (гидроокиси тетрабутиламмония).
В любом случае необходимо энергич1О но перемешивать реакционную смесь.
Обычно используют 3-10 объемов растворителя по отношению к Р.-ионону. !
При выбранном растворителе агент ионизации выбирают таким образом, чтобы в присутствии - ионона реак4б ционная смесь приобрела окраску от. коричнево-красной до темно-коричневой, 047 4
Продолжительность реакции может изменяться в достаточно широких пределах и в основном зависит от использованных реагентов. Обычно продолжительность процесса составляет 0,254 ч, что достаточно для достижения хорошего evxopa этиленненасыщенного кетона. Полученный этиленненасыщеиный кетон может быть выделен известными методами. В основном, реакционную смесь, если это необходимо после охлаждения, выливают в воду, содержащую кислоту, : такую как уксусная кислота, целевой продукт экстрагируют с помощью органического растворителя, например гексана.
Полученный загрязненный продукт может быть очищен физическими методами, например молекулярной дистилляцией.
Исходный ацетальальдегид получают при взаимодействии в присутствии кислоты Льюиса алкил орто-формиата общей формулы Н-С(ОН), в которой R имеет значение, аналогичное указанному выше, с 1,3"диеноксисиланом общей формулы
l д где К1 - углеводород или линейный или .разветвленный алкил, содержащий
1-4 атома углерода, циклоалкил, например цикпопентил или циклогексил, фенил или аралкил, например тензол или 1 -фенилэтил, à и целое число, равное 1, 2 или 3 °
Конденсацию алкил орто-формиата с диеноксисиланом осуществляют либо в среде органического растворителя, инертного по отношению к использованным реагентам, либо при отсутствии растворителя. В первом случае используют алифатические углеводороды (гексан, гептан), циклоалифатические (циклогексан), ароматические (бензол), простые эфиры диэтиловый эфир, тетрагидрофуран, галогенсодержащие производные (метиленхлорид, хлороФорм), нитрилы (ацетонитрил, пропионитрил), карбоксамиды (диметилформамид, диметилацетамид), N-метилпирролидон.
Температура,.при которой осуществляют реакцию, может изменяться в широких пределах в зависимости от используемых реагентов, природы и количества катализатора и состав"
5 101 лять от -40 до +150 C, предпочтительно 0-100 С.
Оптимальная температура +10-+70 С. Однако можно вести процесс и при температуре, значение которой выходит из указанного предела. Давление может быть равно, выше или ниже атмосферного давления.
В качестве кислоты Льюиса как катализатора используют галогениды бора и их комплексы с простыми эфирами и галогениды переходных металлов (металлы групп 1в-7в и 8 группы периодической системы элементов), Наиболее подходящими соединениями являются галогениды цинка и олова, которые в основном и используются. Кроме того, используются также хпорид и бромид цинка, хлориды и бромиды двухвалентного и четырехвалентного олова.
Количество катализатора, выраженное в числе молей кислоты Льюиса на диеноксигруппу, содержащейся в диеноксисилане, может изменяться в широких пределах. 8 основном достаточно
1-10 0,5 моль кислоты Льюиса, в частности галогенида цинка или олова, на диенокси группу. Целесообразно, чтобыз это количество составляло
1 10 -0,2 моль на диенокси группу. 30
Время реакции зависит от выбранных условий и природы реагентов и может колебаться от нескольких минут до нескольких часов, Используемые 1,3-диеноксисиланы и в основном известны и могут быть легко получены взаимодействием моно-, ди- или тригалогеносилана общей формулы (R ) и 5 i (Х)4 яр в которой R и и имеют значения, аналогичные ука- . 40 занным выше, à X - галоген (хлор или бром), с альдегидом или со способным к енолизации С, Ь -или, -этиленненасыщенным кетоном в присутствии хлорида и акцептора водородной кис- as лоты, согласно известному способу 1 3).
Переход этиленненасыщенного гидроксиацеталя общей формулы (I) в ретиналь включающий дегидратацию треI
Я тичного спирта и гидролиз ацеталя с получением в качестве промежуточного продукта ретроацеталя, можно ocy" ществлять в один или несколько этапов. Известно осуществление дегидра тации третичного спирта с помощью
15 минеральной кислоты.
Гидролиз ацеталя можно осуществлять с помощью водного раствора галогенво1047 4 дородной кислоты в среде органического растворителя, смешивающегося с водой, в котором обрабатываемое соединение и кислота растворимы (например в ацетоне). Переход гидроксиацеталя общей формулы (Т) в ретиналь осуществляют. предпочтительно в ацетоне с помощью водного раствора соляной или бромводородной кислоты.
Пример 1. К раствору, содержащему 5,88 r очищенного 89 -ного
9-/2,6,6 -триметил-1 -циклогексеI нил/ -1, 1-диэтокси-3-метил-3,5, 8-нонатриен 7-она(или диэтилового ацеталя
С„ ) B 20 мл безводного диэтилового эфира, приливают при -30 С в течение
40 мин раствор метилхлоридмагния (полученный из 1,34 г магния) в 17 мл безводного простого эфира. Смесь оставляют реагировать в течение еще
15 мину затем реакционную смесь выливают в раствор, содержащий 0,59 r ацетата натрия и 3,54 г уксусной кислоты в 47,2 мл воды. После декантирования и сепарации водную фазу экстрагируют 60 мл этилового эфира. Собранные органические фазы промывают в 15 мл воды, а затем двухкратно
15 мл водного 34-ного раствора бикарбоната натрия. Таким образом выделяют
5,81 г (выход 81p) 9-/2,6,6 -триметил- 1 )-циклогексенил/ - 1,1-диэтокси-3,7-диметил-3,5,8-нонатриен-7-ола или диэтилового гидроксиацеталя С о, имеющего следующие характеристики:
Уф-спектр: Хмакс241 нм, Е, =531 (изопропанол).
Диэтиловый ацеталь С1, используе мый в качестве исходного продукта, получают следующим образом.
I о
В суспензию, охлажденную до 0 С, содержащую 2,10 r (38,9 моль) метилата натрия в 150 мл безводного гексана, вводят смесь 30 г (161ммоль)
1,1-диэтокси-3-метил-3-пентен-5-аля и 28,14 r (147 ммоль) Р-ионона. Через 30 мин перемешивания при температуре, близкой к 0 С, реакционную смесь приливают в 300 мл воды, содержащей 2 уксусной кислоты. Водную фазу с рН 4-5 экстрагируют в 300 мл гексана. Органический слой промывают в 150 мл водного раствора бикарбоната натрия, а затем в воде до нейтральной реакции. Органическую. фазу собирают, высушивают на безводном сульфате натрия, после чего концентрируют насухо при пониженном давлении
7 1011 (12 мм рт.ст,) до достижения постоянного веса. Таким образом получают
54,1 г масла оранжевого цвета, которое содержит по результатам количественного анализа, осуц|ествленного путем жидкостной хроматографии при высоком давлении с использованием инерт. ного этанола, 63,34 диэтилового ацеталя С и 84 fb-ионона.
Степень превращения 843, выход по 16 отношению к использованному Р -ионону 80 54 °
После очистки, осуществленной жидкостной хроматографией йри высоком давлении, получают диэтиловый аце- 15 таль С, имеющий следующие характеристики:
УФ-спектр: ). 30 нм; Е. =683
° 0!О (изопропанол):. 1см
Количество этоксигрупп (ОС2 Н ), io определенное методом Зейзеля, 3:
Расчетное 25.
Найденное 23,37.
1,1-Диэтокси-3-метил-3-пентен-5-аль получают следующим образом, t5
В трехгорлую колбу емкостью 250 мл, снабженную мешалкой, холодильником и выводящей трубкой, вводят в атмосфере аргона 22,2 r этилортоформиата (1,5. 10 моль), 0,37 г расплавленно- щ
ro хлорида цинка (2,76 ° 10 моль) и
50 мл безводного ацетонитрила. Смесь перемешивают, затем добавляют в течение 5 мин раствор 23,4 г 1-триметил силилокси-3-метил-1,3-бутадиена (1,5 10 моль) в 15 мл безводного
35 ацетонитрила. Смесь нагревают. Кипение устанавливается при 76 С. Через
45 мин нагревания смесь охлаждают до
5 С и осуществляют дистилляцию, улав00 ливая при давлении 20 мм рт.ст. легкие продукты и растворитель, Количественно определяют и идентифицируют путем хроматографии паровой фазы
10,9 г триметилсилилоксиэтан в дистилляте и уловленных соединениях.
45 !
Остаток растворяют в 50 мл диэтилового эфира и нейтрализуют прибавлением к нему 25 мл водного насыщенного раствора бикарбоната натрия., Органическую 5О фазу декантируют,промывают в 25 мл дистиллированной воды и высушивают на карбонате калия. После фильтрации и концентрирования насухо ведут количественный анализ и идентифицируют путем инфракрасной спектрографии, хроматографии паровой фазы и магнитноядерного резонанса 19 г 1,1-диэтокси047 8
"3-метил-3-пентен-5-аля во фракции дистиллята между 75-80 С при давлении 0,3 мм рт .ст. После ректификации
l,l-диэтокси-3-метил-3-пентен-5-аль предсталяет собой светло-желтую жидкость, кипящую при 73 С и давлении
0,2 мм рт.ст. и имеющую показатель преломления n=1,4602.
Пример 2. K раствору", содержащему 17 г 9-(2,6,6 -триметил-l) -цикло-гексенил/-1, 1-диэтокси-3-метил-3,5,8-нонатриен-7-она (или диэтилового ацеталя С, очищенного путем молекулярной дистилляции, и содержащего 81ф укаэанного соединения в 55 мл безводного диэтилового эфира, приливают при -25 С в течение о
1 ч ра ст вор, содержац ий ма гнийметилхлорид {полученный из 2,58 г магния) в 33 мл безводного диэтилового эфира.
Смесь оставляют реагировать еще в течение 15 мин, а затем выливают в течение 10 мин реакционную смесь в раствор, образованный 83 мл воды, 8,43 мл концентрированной соляной кислоты (d=l,19) и 10 мл диэтилового эфира, поддерживая температуру реакции равную О-50ОС. После декантирования и сепарации органическую фазу промывают в 30 мл воды, двукратно в 30 мл воды, содержащей 0,85 г бикарбоната натрия, .а затем в 30 мл воды, содержащей 0,12 г бикарбоната натрия, Эфирсодержащий раствор сушат. над сульфатом натрия. После фильтра ции и концентрирования насухо при пониженном давлении и температуре равной 35-40 С получает 17,72 г (выход
88 ) 9-/2,6,6 -триметил-1 -циклогексанил/-l,l-диэтокси-3,7-диметил-3,5,8-нонатриен -7-аль) или диэтиловый гидроксиацеталь С имеющий сле20 дующие характери .тики:
УФ-спектр ф„,о 241; Е 530.
1см
Пример 3. Раствор, содержащий
2,0 r диэтилового гидроксиацеталя
С ов смеси 48,0 мл ацетона с 254 воды и 0,68 мл воды, содержащей 0,020 r ионола, нагревают до кипения в атмосфере азота. Затем быстро вводят 0,6 мл раствора бромводородной кислоты (полученной из 1 мл водной 482-ной бромводородной кислоты и 47 мл ацетона) . После охлаждения реакционную смесь выливают в 150 ил воды. После двукратной экстракции 50 мл гексана органическую фазу собирают и промывают в 50 мл водного 54-ного раство9 1011047 10 ра бикарбоната натрия, а затем До тем 1 мм рт.ст) получают 1,69 r (вынейтральной реакции в 25 мл води, .- ход 873) ретиналя, имеющего следующие после чего сушат над сульфатом натрия. характеристики: ,После фильтрации и концентрирования . УФ-спектр:Ai><<<380 нм, Е =.853 при пониженном давлении (12, а за- у (изопропанол).
1см
Составитель 8.Жестков
Редактор А.Лежнина Техред Т.Маточка.. Корректор Ю.Макаренко
Заказ 2513/44 Тираж 416 Подписное
ВНИИПИ Государственного комитета СССР ло делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5, филиал ППП "Патент", r. Ужгород, ул. Проектная, 4