Способ переработки металлических медьсодержащих отходов
Иллюстрации
Показать всеРеферат
СПОСОБ ПЕРЕРАБОТКИ МЕТАЛЛИЧЕСКИХ МЕДЬСОДЕРЖАЩИХ ОТХОДОВ ЭЛЕКТРОЛИЗОМ , отличающийся ,тем, что, с целью повышения производительности процесса и снижения затрат, медьсодержащие отходы подвергают анодному окислению в растворах солей минеральных кислот выбранных из группы: азотная, серная, соляная при плотности тока 200-16|О А/м2-в течение 1-3 ч.
СОЮЗ СОВЕТСКИХ . СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
„„SU„„,3 013502 А
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИИ И ОТКРЬПМИ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTOPCHOMV СВИДЕТЕЛЬСТВУ
Г
L 4
1 (2l) 3354194/22-02 (22) 13.11.81 (4 б) 23.04„83. Бюл. 4Р 15
" (72) У.И. Куркчи, А.A. Юсупходиаев и Г.И. Куртмаметова (71) Среднеазиатскйй научно-исследовательский и проектный институт цветной
Металлургии. .(53) бб9.33(088.8) (56) 1. "Цветная металлургия", 1978, и 1, с. 27, 31.
2. Авторское свидетельство..СССР по заявке It 3285610, кл. C 25 С, Q)2.,:
1Я81. i5 С 22 В 7/00; С 25 С l/ f2 (54) (57) СПОСОБ ПЕРЕРАБОТКИ ИЕТАЛЛИЦЕСКИХ ИЕДЬСОДЕРЯАЦИХ ОТХОДОВ ЭЛЕКТРОЛИЗОИ., о т л и ч а ю ц и и с я . тем, что, с целью повышения. производитель ности процесса и сни1хения затрат, медьсодерх<ащие отходы подвергают анодному окислению в растворах солей минеральных кислот, выбранных из группы: азотная, серная, соляная при плотнос" ти тока 200-1640 А/и 2- в течение 1-3 ч.
1013502
Изобретение относится к цветной металлургии, а именно к переработке металлических отходов, содержащих медь, Известен гидрометаллургический способ переработки биметаллоо в аммиачр ном или сульфатно-аммиачном электролитах Р 1).
Недостатком этого, способа является . высокая летучесть аммиака, что приводит к повышенному расходу этого реагента. Кроме того, скорость анодного растворения плакирооанной меди больше скорости ее катодного осаждения, что вызывает необходимость вывода определенной части электролита на оанны обеднения с последующим цементационным осаждением остаточного металла.
Ближайшим по технической сущности и достигаемому результату является способ переработки иеталлических медь-20 содержащих отходов электролизом, в котором переработка иедьсодержащих отходов осуществляется электролчзом путем анодного сульфидирооания вторичного сырья в сульфидно-щелочном электролите при плотности тока -10300 Л/м - о течение 4"12 ч Р 2).
Недостатками известного способа яоляется значительный расход сернистого натрия, затрачиваемый на образо- з0 вание сульфида меди (1 кг/l кФ C05)> что увеличивает себестоимость продукции. Кроме того, анодное сульфидирование медьсодержащих отходов про-,. текает при сравнительно низких плот" ностях тока. Дальнейшее увеличение . плотности тока приводит к образованию более плотных осадков сульфида меди, которые трудно удаляются с поверхности железной основы. Это снижает производительность процесса.
Цель изобретения — повышение производительности процесса и снижение затрат.
Поставленная цель достигается тем, 45 что согласно способу переработки металлических медьсодержащих отходов электролизои, иедьсодержащие отходы подгергают анодному окислению в растворах солей минеральных кислот, выбранных из группы: азотная, серная, соляная при плотности тока 2001640 Л/и о течение 1-3 ч.
Сущность способа состоит в том, .что при анодном окислении плакирован ная медь превращается в ее гидроокись и окись, которые практически полностью отделяются от поверхности железной основы, остающейся о неизменном виде. Полученная при этом сиесь гидроокиси и окиси меди может быть переработана на металл иэвестныи способом.
Эффективность анодного окисления медных отходоо зависит о основном от плотности анодного тока, продолжительности процесса и концентрации солей о электролитах. Способ лучше всего протекает при энодных плотностях тока 200-1640 Л/и, продолжительности процесса 1-3 ч и концентрации солей о растворах, равной 5-153.
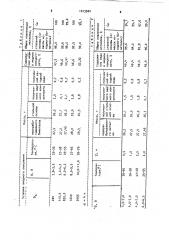
8 табл. 1 показано влияние плотности тока на извлечение стальной основы и меди из биметаллических отходов (Со 5,74; CNaNQ 5Ф; и 3 ч), в табл. 2 - влияние продолжительности процесса на извлечение стальной основы и меди из биметаллических отходов (С 1 1,„О 5Ф, Ъд 820,0 А/м в табл. 3 - влияние концентрации азотнокислой соли на извлечение сталь. ной основы и меди из биметаллических отходов (СО 5,7Ъ; Эд 8?О Л/t« ; <, 1 ч ; в табл. 4 — влияние природы солей на извлечение железа и меди из биметаллических отходов (Со 5,7i,"
ССоли l моль/л < 3 ч 55 2 см
gä 500-820 А/м>
При этом использование растворов солей азотной, серной или соляной кислот практически не изменяет извле-. чение меди из бииеталла, которое составляет 98-1003.
При плотностях тока ниже 200 А/и снижаетсл производительность процесса, а при плотностях тока выше
1640 Л/м< образуются, преимущественно, плотные осадки окиси меди, которые трудно удаляются с поверхности желез,ной основы. При постоянной плотности тока извлечение меди в окисленный концентрат зависит от, продолжительности процесса. Так, при анодной плотности тока, равной 820 А/м, увеЯ. личение времени процесса с 0,5 до
3,0 ч. приводит к повышению извлечения меди из биметалла о оСадок с
54,1 до 100, а затеи остается практически без изменения (табл. 2).
Аналогичным образом, увеличение концентрации соли в растворе с 1,0 до 15,03 сначала приводит к повышению извлечения плакированной меди с
35,5 до 97,5 - 1003. При дальнейшем повышении концейтрации соли в растворе до .254 извлечение меди со стальной основы в осадок понижается до и <к проводят при плотности тока 500 А/м в 14,23-ном растворе сульфата натрия в течение 3 ч. По истечению указанно-. го времени. получают 26,8 r стальной осипам 1,8 г окисленного медного пороика <си и3,8Æl и 0,7 г катодной меди. Извлечение. полезных компонентов составляет, Ж: стальная основа 97,5; медь 100.
Пример 5. Анодное окисление биметаллических гильз <масса 28,3 г) проводят при плотностлх тока 500 А/м в 5,94-ном растворе хлорида натрия в течение 3. ч. По истечении указан,ного времени получают 27,2 r стальной основы, 1,8 г окисленного медного порошка и 0,8 .г катодной меди. Извлечение полезных компонентов из биметалла составляет,Ж: железная основа 97,5;
Анодное окисление плакированной меди при переработке биметаллических отходов осуществляетсл, в конечном счете, за счет электролиза воды и описывается суммарным уравнением
Сц+20Н-- {:цОф+2И О;
Gu+2OK Gv(0K) g.
Следовательно,при переработке биметаллических отходов описанным способом, используемые в качестве электролитов, соли минеральных кислот практически не расходуются, что снижает себестоимость полученной продукции.
Кроме того, при анодном окислении биметаллических медны;: отходов образуют ся рыхлые, хорошо удаляемые с поверхности <:TBJlbHoN основы, порошки гидрооксида меди. Это позволяет повысить производительность процесса.
Предлагаемый способ дает возь ожность осуществить процесс комплексной переработки биметаллических отходов с высоким извлечением полезных компонентов; железа 96-993, меди на 981003. Полученная в процессе электролиза биметаллических отходов с. блестящей поверхностью железная основа может быть использована в черной металлургии в качестве лома или в качест" ве восстановителя в процессе цементации меди из растворов кучного выщелачивания забалансовых руд, как постоянный и неограниченный источник сырья длл цементации, которал постолн55 но испытывает нужду в железном скрапе хорошего качества.
3 .1013502 4
93,8Ф эа счет частичного растворения меди в электролите (табл. 3).
B качестве примера приведены данные по анодному окислению биметаллических гильз, плакированных медью э с внутренней и внешней поверхности железной основы, содержащей 5,7Ô меДИе
Все опыты проводят в электролитической ванне емкостью 0,5 л без циркуляции электролита.. 8 качестве анодов используют биметаллические гильзы (3 шт.), непосредственно присоединенные к проводнику, в качестве катодов используют сталь марки ст.3.
Пример 1, Анодное окисление биметаллических гильз («<асса 27,5 r) проводят при анодной плотности тока
200 А/м в 53-ном растворе азотнокислого натрии в течение 3 ч. По. ис- медь 100. течению указанного времени процесс прекращается. Неизменная ocHoBd « abl павшая на дне ванны смесь .голубого осадка гидроокиси меди, а также частично осажденный на катоде медный по- г рошок отделяют, промывают водой и сушат в шкафу при 80--1 20ОС в течение
6-12 ч. Получают 26,5 г стальной основы, 2 r.îêèñëåèíîé меди (Со 47,5Ъ и 0 7 r катодной меди. Извлечение по- зв лезных компонентов составляет, Ж . стальная основа 96; медь 10.
Пример 2. Анодное окисление биметаллических гильз.(масса 28,2 r) проводят при анодной плотности тока
820 А/м в 153-ном растворе азотнокислого натрия в течение 1 ч. По истечению указанного времени получают
97, l г стальной основы, 2,0 г окисленного медного порошка (Cu 48,5Æ ) и
0„6 r катодной меди. Извлечение полезных компонентов из биметалла со,. ставллет, 4; стальная основа 96,1; медь 97,5.
Пример 3. Анодное окисление биметаллических гильз 4масса 28,5 г) проводят при анодной плотности тока
500 .А/м в 9,23-ном растворе азотнокислого калия в течение 3 ч. По истечению указанного времени получают
27,1 r стальной основы, 1,8 г окисленной меди t Cv 43,53) и 0,9 г мед ного порошка. Извлечение полезных ком. . понентов из биметалла составляет,3: стальная основа 96,4; медь 98,9.
Пример 4. Анодное окисление биметаллических гильз (масса 27,5 г).
l013502
1
1
I.
С> о е
>» 01
1 (I Ф
С.>
1 LOv х о ес нос
vzm
О (X I» еоэ
XXX
I.о
«Есг о
z 3 с о (О X
l- v
О .О с е
Ф
Э
lO
8 о о с с е (О>
X ч> о л A
Сп L0
Ш 01
CD л о
0 О а л л
01 4
01 01
00 О
° 1
Л О
0О Щ
X I о а( х (X Э
Э Э
z to е
Ф Y а
1 X
m aO
m)cX а X с: (Р о х
М Ф а X
Э
N Э о z (> х
СЧ О М
° 1 л О Сч
-4 EA. О л л
Ч:> CD
«О
M Э
Х 1о е
Y O.
I
1
I ! (! (1
l
l (I
1
1
1
1
1 (1 !
I .1
1
I
I
1
I
I
1
1
I
I
I (I
1
1
1
I
1
1 (1 л (g о
О I (О (K 1
1
1
I.
1 !
1 .!
1, л
l lCD
1
I
I
1 (О
СЧ
1
t
I а л ! О
1 сч
I е е>к гмо
» z x
С >Х СХ С(oooe
c z t1
X 1
Э (О >Х ххо
» z О ° Л
° л о с>
СЧ л
Q >X СХ ооо (= х (0 л ° I о о
0О Л л л о о
CX Х
Ф о
X М
»о о
С L.(ооо
czz
>,О л
СЧ б
0О т» л
СЧ л л
;3> 1 с-. о е z
1- V
О О
I
1
1
1
1
t
I
1
>х о х 3 с о е х
t- v
О О
X
Э
0 а л а
СЧ СЧ л- М л
L л е
О о е
Ф м
° I
Ч:> О
СЧ л» л с >z >z о о.о
L Х Х
О О
СЧ СЧ
1
I
l (а
СЧ
I о m
Е(-С (ООС е X (О, аэ 1Э Е Э а(g X
Э З X
C (-(О о
:X ! Э (О
mmfQ. (f(Э
Э Б Е а 3эео
ClO l а
СЧ -Ф
° л л.л
С4 СЧ а а л ° I л л
СЧ СЧ
CD л
00 сч
-3 л
01
СЧ
СЧ Lh л
О Л
СЧ СЧ
I 1
I 1
3 t
1 I ! 1
I . I ! l
I 1
1 I
I c I
1 Х I
Х ! "1 с
v ! х о
М
I 1
I I о, о
I х 1 о
CC
I
I
Ш
I о! с
О !.
»
1
I
> (lg ао
eo
Э Е
3- О.
I
I
1 (О м
1 а
СЧ
СЬ О 1 .
I 1
Л О
СЧ СЧ
0о а м а
1 I а
СЧ СЧ
I, о л
00 л! СЧ
1
1
1 о (Ю сч
С>
Ф.
CD
1
mu а
Ф Ол с е
X а
Э»
3- 1СЧ л л
-4 О
1 I.
CD л л м О о л
01
1 о л
0О о с>
° ь л о о
СЧ
00 г а а О сч Н
I.I Э, I X е Х д (>
I Э
У е с о
I (И
С 1 С>7 С
1 Х.(О
lOl Э 3l е Э (gt X о,3 lO
I (» о
>х О о
1 X Д3
I Л О3 Д с о о
ЕХО
t-vm
v OX (zzm х э о (э X Y m
r а
»ОО(с ((х оооэ (=ХХ=С
> о
1 о
1 °
1 I
X I (О . ! о е
I» С
ОС(., z m 1 о
Ct I- I
O e 1®
X X!
СЧ
I
1 !, е
1 !
=3, I
I
1 (О 1 (ml
I 1
1 !
1
I I
I
I
I
I
1
l
Il, t
1 !
I t
1
I
1 I
I !
1
1
1
I
1
1 (I
1
I
1
1
I
1
I
I I
1
1
I
l
I
I
1
1 !
1
1
1
1
I
1
I
1
I л е о л л ° \
«О LA Л <У а m 0
-О -4 л .л л л о о о о
Ф -4 а о о о л л л Ю
О е»
О 033 0О сО а - I 1 I О О (а
СЧ сч сч сч о о о а л л л л О (. l ! а а о
° \ л л л
4 3 О
Ю л
С ф
Сб
I
Э
I . S
tA л л сп м
Ц (О
I1
I
I
X I
Э 1
ЭдФ
Ц I
3- X
О 3 (О
>е о
О SO ttl
X З лвлоц
C. -O V Z ttI
Ф-х о tz 3(- о е а э оОXX-X
I
I. I !
1
I.
1 л
Э I
О
С I
I S
1
1 1
Э Ц 1
Э Ф 1 ЯГ I- I
lQ Ф 1
X !
I
I
1
4
1 ! т х
31I дФ л о Ф (С I»
Щ (S
Ю tt % Ф
aX
Э сК l3I о s
1
I
)
1
I м л л м
-з.
° »
tD
I X
3 Ф
I
1 3. о
4! (»
I
3.
I
1 О л
CD л
LA л
3 I
4 Z
I,Ô
3 У
3 0ъ
Ц о
l С
О
I» .Х
-О Ф
9 X MttI (-f X 1 хX9а.
Ю
СЧ
° »
СЧ
z
Э
1 j. э ( л
ttI и
-!
I
1
LA
С(Ъ л О
C 4 (Ф
X:
СЧ
I
I
I
I о а (4 о а
X Ф
Э I«
Ф Ф ш X
2i ..X
I- (О (I ! m
I (О
1 ttl а
1 Э
I Ф с
I
1
1
I
CV л О
СЧ О
° » л
СЧ
СЧ л
СЧ
СЧ л
СЧ.(1
1
I
I
I
-1
l
I
3
1 (1
1 (1
I
СС
С(_#_ а
2!.
С (tD л
Ю л
К
X
Э с о
S х о о о х
ИЪ
СЧ
I
1
I !
l . (!
tII, о
Э л
X Q;
Э:>(l- lCD О л О
СЧ
CD . (-1.
СЧ
CD
I.
«»
СЧ
l
1
3
3 ! !
I !
1
1
4
3
I
I
1
I
1 б
4 .3
1
I (о х
4(С о
Ц о
ЬЪ
I (I
3
1
I
3 !
CD
° »
Ю
Ю л л
СЧ л
°
I О
° »
° . ф
СЧ
° \
« !
Ln л
° . -Ф
1. LA л
1 ——
Ф IS
ы о
tX tX сС, ОО Э
zI»X
>Х >Й Cl о-о о
zzz
1013/02
Ю
LA л О со
Д»
Л С=3,. CD
° 1 л л О . ъО- са
С(Ъ О1 Ш м м. л л
CV «4
4 3
СЭ
° » о
МЪ л л сО О
СЧ CV
iО Ln л л л л
СЧ CV
О LA л ° »
СО
CD a О О л О Л
CV СЧ
CO л л
СО LA
1 I О О
° » л
СС\
Ln «1» . л л ао .o
° 4 LA
I
1 (!
I. .1
1 !
I
1 !
l
1
I
1
1 (I
l !
I ( (1
3
3
3
3
I
1
t (! (1
1
1 !
1
1
l
1
1
t ( (1
4
I (l
1013502
10 Т а б л и ц а 4
Масса, г
Природа овия анодного окисления
Температура оС
Нитрат натрия
5,0-5,4 27-65
26 5
27>5
Нитрат калия
2,6-4,0 27,60
28,5
27,1
Хлорид натрия >+
2,6-6,4 27-.63
28,3
Сульфат натрия
26,8
27-65
2,6-5 0
27 5
Продолжение табл.4, Масс
Общее извлечение металла, 3 стальной основы от массы исходйого биметалла
Нитрат натрия
96,0
100
44,3
1,0
1 3
Нитрат калия+1
98,9
96,4
43,5
0 9
Хлор ид натрия 1,8
96,0
100
0,8
Сульфат натрия Н
100
43,8
97 5
0 7
/
820 А/и, Катоды изготовлены из стали марки СТ-3»
2.
500 А/и . Катоды изготовлены из матричной меди.
ВНИИПИ Заказ 2946/35 Тираж 625 Подписное
Филиал ППП "Патент", r. Ужгород, ул; Проектная, 4
Ф
З„= М р
А олученого м®дого кон ентрата
Содержание меди в медном концентрате, 3 перерабатываемого биметалла получен- ной сталь,ной ос" новы