Вольтамперометрический способ определения хлорид-ионов
Иллюстрации
Показать всеРеферат
ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ СПОСОБ ОПРЕЛЕЛЕНИЯ ХЛОРИДгИОНОВ, включающий концентрирование их на стационарном ртутном электроде в виде хлорида ртути и измерение тока восстёновленил его, отличающийся тем, что, с целью повышения чувствительности определения, производят накопление ионов хлорида в интервале потенциалов -
„„SU„„,1013834
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСГ1УБЛИ К
31Ю .4 01 М 2
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЬП ИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTOPGHOI4Y СВИДЕТЕЛЬСТВУ (21) 3368593/18-25 (22) 23.12.81 (46) 23.04.83. Бюл. И 1-5 (72) Н.Ф.Захарчук, H.À.Âàëèíåâà и И.Г.Юделевич (71) Новосибирский государственный университет им. Ленинского комсомола и Институт неорганической химии
AH СССР (53) 543 ° 257(088.8) (56) 1. Ройзенблат Г.H., Фомичева Т.И. Х.Ç.Брайнина. Определение микропримесей хлоридов в вольйраматах и молибдатах кальция и стронция.
Химические реактивы и препараты Тр, ИРЕА, 1966, т. ?8, с. 104.
Z. Ройзенблат Е,И., Сапожникова Э.Я. и Брайнина Х.З. Определение микропримесей хлоридов s нитра"
te алюминия методом пленочной вольтамперометрии. Методы анализа и контроля производства в химической промышленности. НИИТЭХИМ, 1967, в. с. 7-11 (прототип). (54) (57) ВОЛЬТАИПЕРОМЕТРИ4ЕСКИЙ СПО"
СОБ ОПРЕДЕЛЕНИЯ ХЛОРИД-.ИОНОВ, включаюц ий концентрирование их на стационарном ртутном электроде в виде хлорида ртути и измерение тока восстановления его, о т л и ч а юшийся тем, что, с целью повыаения чувствительности определения, производят накопление ионов хлорида в интервале потенциалов - (0,07» .
-0,10) В и регистрируют анодную кривую в диапазоне - (0,27-0,20) В.
1013834
Изобретение относится к анали" тической химии и касается опреде" ления хлорид-ионов методом вольтамперометрии в различных материалах и может быть использовано в химичес- 5 кой промышленности, производстве полупроводников, где необходимы высокочувствительные методы анализа.
Известен способ определения хло.рид-ионов, включающий концентрирование их в виде. каломели На2012 на поверхности стационарного ртутного электрода при потенциале.электроли" за (Е ) « равном - 0«05 В и измерение электрорастворения каломели во время регистрации катодной поляри" зационной кривой от Е> до Е <-(0,250,35) S E13.
Однако данный способ неселективен и требует устранения компонентов ана" 20 лизируемого вещества, Для анализа объектов, содержащих примеси иодид-, сульфид-, йерроцианид"ионов, способ непригоден.
Наиболее близким техническим ре" 25 ,шением к изобретению является вольтамперометрический способ определения хлорид-ионов, включающий концентри" рование их на стационарном ртутном электроде в виде хлорида ртути и из- 30 мерение тока восстановления его. Метод предполагает концентрирование хлорид-ионов в виде каломели (Hg Сl ) на поверхности ртутного электрода, при потенциале электролиза (Е ), равном ОВ, и измерение максимального катодного тока во время регистрации поляризационной кривой растворе" ния НЧ2С12 oT F> до - 1,0 R Г23.
Недостатком способа являетСя то, 40 чтоон неприменимдля анализа широкого круга объектов. Нижний предел определя-6 емых содержаний хлорид-ионов 1 10 М, поэтому требует применения больших
H8ВесОк при анализе высокО чистых 45 . веществ.
Целью изобретения является повышение чувствительности определения.
Поставленная цель достигается тем, 50 что в вольтамперометрическом способе
°, определения хлорид-ионов, включающем концентрирование их на стационарном ртутном электроде в виде хлорида ртути и измерение тока восстановЛения его, производят накопление ионов хлорида в интервале потенциалов — (0,07-, 0,10) В и регистрируют. анодную кривую в диапазоне — (0,?7-0,20) В.
В условиях электролиза при Е (0,07-0,10) В в отличие от известного способа концентрирование хлоридионов происходит не в виде каломели (Нц2С12 ), а в виде адсорбированных
t на йоверхности электрода ионов (Hg С1) согласно следующей схеме:
2М +СЕ (Н 2)age -- СЕ +gp (1
2 ыс с (Н, ).--И aqciI".e — tH CI«) а с.(й)
Протекание реакций, подобных ре- акциям 1 и II, в выбранных условиях электролиза характерно. только для хлорид-ионов, образование we труднорастворимых соединений ртути (I) с другими анионами (Нп2Г2) маловероятно.
Поэтому в процессе электролиза на поверхности ртутного электрода концентрируются t HgzC1) и Hg242 При потенциалах электрода более отрица" тельных, чем стандартный потенциал системы Hg hHgZС1 ) " Hg/Hg 42, адсорбированные частицы способны к вос.становлению. Но в отличие от figzC 12 крупный положительно заряженный ион (Нц2СI) при Г (Г тсильно поляризуется вследствие действия электростатических сил притяжения, передача электронов в системе электрод fHg201) затрудняется и не наблюдается сйгнал восстановления одновалентной ртути из (НП2С1 + при Гп -0,?7 В, тогда как Н0 42 легко восстанавливается и не мешает дальнейшему проведению процедуры анализа. Последующее смещение потенциала электрода в полояятельную сторону от Fä до -0,20 В уменьшает поляризацию иона fHg>Clf, и при потенциалах (0,25-0,21) В действие электростатических сил ослабевает настолько, что становится возможным процесс переда и электронов в системе Hg )Hg С1) . Поскольку это наступает. при потенциалах, более отрицательных, чем F т наблюдается аномальный (катодний1 максимум тока на анодной поляризационной кривой.
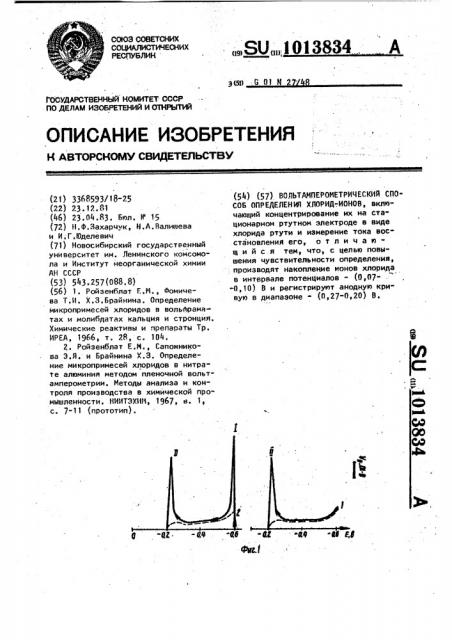
На Фиг. 1 приведены анодные поляризационные кривые растворов
0,1 М HN0 +INazS+1 «5,106 ИНСI (кривая 1) и 0,1 М HNO +I.HKI t1,5-1&l .HC 1 (кривая 2, записанные после электролиза при ЕЗ=-0,08 В в течение 80 с и переключения потенциала электрода с F. на -0,6 В. Пунктиром Отмечены поляризационные кривые этих we pa10138
3 створов, но не содержащих хлорид ионов. Сигнал 1 на кривой 2 в данном случае обусловлен восстановле нием Над<2 ?????????????????????? ?????? ??>.вместе с (Нд СГ)+.
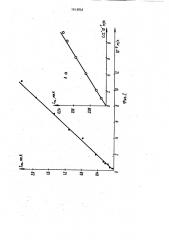
На .Фиг. 2 представлена зависимость максимального тока восстановления
fHg CЦ+, предварительно сконценТри" рованного при Е =-0,08 В в течение
180 с из раствора 1 И НИОЗ+1 И КУ+ 10
+ХИНС1. Как видно из этой зависимо" сти, сигнал П, наблюдаемый на анод" ной поляриэационной кривой в виде катодного максимума тока при выбран" ных условиях эксперимента, прямо про. 1% порционально зависит от концентрации
С Г -ионов в интервале от 1- 10 "до .1,1- 10%. Нижняя граница определяе" мых содержаний хлоридов по сравнению с известным на порядок ниже. 20
Пример 1. Определение С! ионов в иодиде калия.
1 r препарата помещают в мерную колбу емкостью 50 мл., добавляют
10 мл О, 1 м НМО ЗИ растворяют при слабом нагревании. Доводят до метки 0,1 И
tN03. Аликвотную -часть раствора (10 мл} переносят в электролитическую ячейку, подсоединяют станционарный ртутный .пектрод к отрицательномузв полюсу полярографа, меркур-сульФатный к положительному и ведут электро лиз перемеаиваемого раствора в течение 180 с при потенциале - 0,07 В.
Прекращарт перемевйваниеи переключают потенциал ртутного электрода на -0,60В
После падения броскового тока до ос" таточного (сигнал 1, фиг.3 ) регистри" руют анодную поляризационную кривую в интервале от -0-,60 до -0,20 В. Кон34 центрацию СГ-ионов определяют по вы" соте сигнала при Е -0,:?2 В с помо- щью калибровочного графика, В образцах иодида калия марки ОСЧ
3-3 ИРТУ6-09"3778-67 предложенным способом определено 7 ° 1A хлоридов при относительном стандартном откло" ненни, не превышающем 0,06.
fl р и м е р 2. При соблюдении всех условий по примеру l электролиз ведут при потенциале -0,1--В.
Найдено: Т 10 4 хлоридов. .П р и м е"р 3. Определение Cl ионов в молибдате кальция. 1,0 г npe" парата помещают s мерную колбу емкостью 50 мл и растворяют в 20 мл
253 -ной. винной кислоты при нагревании на водяной бане. В раствор добавляют
2-3 капли конц. HN03 и доводят до метки дистиллированной, проверенной на отсутствие СГ -ионов водой, Воду считают чистой, если на анодной поляризационной кривой не обнаруживают сигнала при Е=-(0,21-0,2 В}. Аликвотную часть раствора (10. мл1 переносят в электролитическую ячейку. В дальнейшем процедура не отличается от опи- санной в примере
В образцах молибдата кальция марки
ОСЧ 8-2ИРТУ 6-09-2474-65 предложенным способом определено 3 ° 10 хлоридов с относительным стандартным отклонением л,09, в отличие от известного
1-10 ;.
Преимущество изобретения заключается в высокой чувствительности способа 1 10 И,тогда как известным споспособом анализ растворов на содержание хлорид-ионов возможен в области концентраций не менее 1 ° 1(ГбИ.
3013834 3:
101383"
Составитель И,Рогаль
Редактор Р.йандор Техред Ж.Кастелевич Корректор.А Лзятко
Заказ 3007/52 Тираж 871 Подписное
ВНИИПИ Государственного комитета. СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4