Перхлораты 1-бензил-2-метил-3-арил-4(3н)-хиназолинония, обладающие анальгетической и противомикробной активностью
Иллюстрации
Показать всеРеферат
Перхлораты 1-бензил-2-метил-3-арил4 (ЗН)-хиназолинония общей формулы ClOi где R - водород или бром в положении 4 или метил, обладающие анальгетической и тивомикробной активностью. Изобретение относится к перхлоратам 1-бензил-2-метил-3-арил-4(ЗН)-хиназолинония общей формулы. ClOit где R - водород или бром в положении 4 или метил, обладающим анальгетической и противомикробной активностью. Указанные свойства позволяют предполагать возможность применения этих соединений в медицине. Известны перхлораты 1-зтил-2-метил-3арил-4 (ЗН)-хиназолиния, обладающие противосудорожной активностью. В качестве вещества, проявляющего 4i. анальгетическую активность, находит приГО СО менение 1-фенил-2,3-диметил-4-диметиламинопиразолон-5 (амидопирин), а в качестве вещества с противомикробной активностью - хлорамин Б. Способ получения предлагаемых соединений основан на известной реакции циклизации амидов 1М-бензил-Ы-ацетилантраниловой кислоты и заключается в том, что соответствующий ариламйд Ы-бензил-Мацетилантраниловой кислоты подверг1ают внутримолекулярной циклизации в среде метанола при температуре кипения реакционной смеси в присутствии хлорной кислоты .
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР)
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
nc„
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
1 (21) 3327560/04 (22) 24.07,81 (46) 23.11.92. Бюл. N 43 (71) Пермский государственный фармацевтический институт (72) Л.M. Коркодинова, Ю.В, Кожевников, И.И. Градель и В.С. Залесов (56) Авторское свидетельство СССР
М 689164, кл. С 07 0 239/88, 1978.
Машковский M.Ä. Лекарственные средства. — М.: Медицина, 1978, т, 1. с. 182.
Машковский M.Ä. Лекарственные средства, — М.: Медицина, 1978, т. 2, с. 436, (54) ПЕРХЛОРАТЫ 1-БЕНЗИЛ-2-МЕТИЛ-3АРИЛ-4(3Н)-ХИНАЗОЛИНОНИЯ, ОБЛАДАЮЩИЕ АНАЛЬГЕТИЧЕСКОЙ И
ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ
Изобретение относится к перхлоратам
1-бензил-2-метил-3-арил-4(ЗН)-хиназолинония общей формулы где R — водород или бром в положении 4 или метил, обладающим анальгетической и противомикробной активностью.
Указанные свойства позволяют предполагать возможность применения этих соединений вмедицине.
„„SIC „„1014231 А1 (я)л С 07 О 239/91, А61 K 31/505 (57) Перхлораты 1-бензил-2-метил-3-арил4(3Н)-хиназолинония общей формулы где R — водород или бром в положении 4 или метил, обладающие анальгетической и про- а тивомикробной активностью, Известны перхлораты 1-этил-2-метил-3- в арил-4(ЗН)-хиназолиния, обладающие про- С) тивосудорожной активностью. ° аюй
В качестве вещества, проявляющего ф анальгетическую активность, находит применение 1-фенил-2,3-диметил-4-диметиламинопиразолон-5(амидопирин), а в качестве вещества с противомикробной активностью — хлорамин Б.
Способ получения предлагаемых соединений основан на известной реакции циклизации амидов N-бензил-N-ацетилантраниловой кислоты и заключается в том, что соответствующий ариламид N-бензил-Nацетилантраниловой кислоты подвергают внутримолекулярной циклизации в среде метанола при температуре кипения реакционной смеси в присутствии хлорной кислоты.
1014231
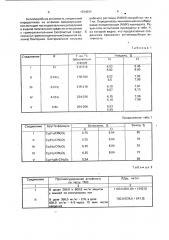
Целевые продукты представляют собой белые кристаллические вещества, трудно растворимые в спирте, толуоле, хлороформе, умеренно растворимые в диоксэне, хорошо — e диметилсульфоксиде.
Физические свойства данных соединений приведены в табл. 1.
В ИК-спектрах обнаружены полосы поглощения при 1716-1725 см (Ar-С=О у ароматического цикла), 1300 см (-С = N)
1110см (CION). Спектры ПМР синтезированных соединений также подтверждают их структуру. Триплет метильной группы в положении 2 соответствует области 2,3 — 2,4 м.д, Квадруплет метиленовой группы в положении 1 при 5,43 — 5,47 м.д., э мультиплет ароматических протонов находится в области 7,41 — 7,7 м.д, Пример 1, Перхлорат 1-бензил-2-метил-Ç-фенил-4(ЗН)хиназолинония.
4,14 г (0,01 моль) анилида N-бензил-Nацетилантраниловой кислоты растворяют в
30 мл метанола, приливают 1,76 г (0;01 моль)
57%-ной хлорной кислоты и выдерживают на водяной бане при 80 С с обратным холодильником в течение 45 мин. Затем отгоняют 15 мл метанола, выделившийся после охлаждения осадок отфильтровывают, промывают на фильтре 2 раза lla 20 мл метанолом и кристаллизуют иэ абсолютного этанола в виде призм.
ИК-спектр (вазелиновое масло) см
-1, 1750, 1630, 1563, 1510, 1468, 1300, 1110.
ПМР-спектр(1(СРз СООН),2,3 +0,05(СНз), . 545 + 0,05 (СН2), 7,7 0,05 (СНз).
Пример 2. Перхлорат 1-бензил-2-метил-3-(3-толил)-4(3 Н)хиназолинония.
4,29 г (0,01 моль) 4-толуидида N-бензилN-ацетилантраниловой кислоты растворяют в
45 мл метанола, приливают 2 г (0,01 моль)
50%-ной хлорной кислоты и выдерживают на водяной бане при 80 С с обратным холодильником в течение 40 мин, затем отгоняют 30 мл метанола, выделившийся после охлаждения осадок отфильтровывают, промывают дважды на фильтре по 20 мл метанола и кристаллизуют из абсолютного этэнола.
ИК-спектр (вазелиновое масло), см 1:
1730, 1630, 1560, 1500, 1460, 1290, 1110, ПМР-спектр (1, СРзСООН), м.д. 2,0+0,05 (СНз), 2,0+0,05(СНз), 5,43 0,05 (СН2), 7.53+ 0,05(С Нз), Остальныесоединения получены аналогично примерам 1 и 2.
Фармакологические исследования проводились на белых мышах обоего пола массой 16-22 г. Соединения вводились внутрибрюшинно в 2/О-ной крахмальной слизи.
Изучалась острая токсичность, противосудорожная активность по тесту максимального электрошока (ТМЭ) и анальгетическая активность по методике Эдди и Леймбаха.
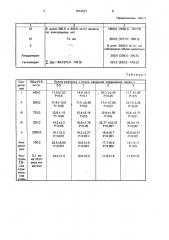
Результаты исследований по определению противосудорожной активности и токсичности приведены в табл. 2, из которой видно, что соединения не проявили противосудорожной активности в дозах 300 и 600 мг/кг при внутрибрюшинном введении их мышам, лишь соединение tl проявило незначительную активность в дозах 300,0 мгlкг (защита у двух животных из шести) и
600,0 мг/кг (защита у четырех животных из шести) через 15 мин после внутрибрюшинного введения.
Для определения анальгетической активности соединения вводились в эквитоксических дозах по отношению к амидопирину, т.е. s дозах в 2,5 раза меньших, чем ЛД5о. . Результаты опытов по развитию анальгетического эффекта и наступлению его максимума (пика действия) в сравнении с контролем и амидопирином представлены в табл.Ç. Как видно иэ табл, 3, соединения I I-V, обладают обезболивающим действием, два из них — 1Ч и V — на пике действия, 3 ч, активнее амидопирина (латентное время оборонительного рефлекса у них статистически достоверно отличается от такового у амидопирина).
Все эти соединения менее токсичны, чем амидопирин.
Пример 3. Перхлорат 1-бенэил-2-метил-З-(4-толил)-4(ЗН)-хиназолинония.
Обладает выраженным анальгетическим действием. Латентное время рефлекса нэ пике действия равно 36,0+16,0 (разница
40 с контролем статистически достоверна при
P < 0,001), Соединение увеличивает время оборонительного рефлекса на пике своего действия — 3 ч — в 2,5 раза более, чем амидопирин.
45 Малотоксичен. ЛД5о для белых мышей при внутрибрюшинном введении 800,0 (727,3 — 880,0) мг/кг; в 3,2 раза менее токсичен амидопирина.
Пример 4. Амидопирин (1-фенил-2,350 диметил-4-диметиламино-пиразолон-5), В дозе 100,0 мг/кг, равной ЛД5о/2,5, при внутрибрюшинном введении белым мышам обладает анальгетической активностью. Латентное время рефлекса на пике действия 30 мин равно 23,5+5,08 (разница с контролем статистически достоверна при Р < 0,001).
Малотоксичен. ЛД5о для белых мышей при внутрибрюшинном введении 250,0 (206,6 — 302,5) мгl кг.
1014231
Таблица 1
Продолжение табл.1
Таблица 2
Антимикробная активность соединений определялась на штаммах микроорганизмов методом последовательных разведений в жидкой питательной среде по отношению к грамположительным {золотистый стафилококк) и грамотрицательным (кишечная палочка) бактериям. Бактериальная нагрузка рабочего раствора 250000 микробных тел в
1 мл. Определялась минимальная ингибирующая концентрация (МИК) препарата. Ðåзультаты испытаний приведены в табл. 4, 5 из которой видно, что предлагаемые соединения проявляют антимикробную активность, 1014231
Продолжение табл.2
Л Дно/2,5, мг/кг
Соединение
0,5
440.0
11,0"=1,53
Р>0,5
14,8 «4, Р>0,1,7 «-1,85
Р>0,5
10,3 2,4
Р>0,25
280,0
11,9 +.2,48
Р>0,5
17,4 " 10,8
Р= 0,05
17,9 +7,65
Р<0,01
720,0
13,0+ 1,5
Р> 0,05
12,4+2,19
Р>0,5
12 6«-1 35
Р>0,5
36,0+ 16
Р<0.001
320,0
16,0+1,78
Р<0,05
14,2 +3,2
Р<0,05
2000,0
19,2+3 27
Р<0,001
16,1+2,5
Р<0,001
19,9 «-5,7
Р<0,001
20,8:"8,67
Р<0,001
Амидопирин
100,0
18,6+ 1,5
Р<0,001
23,5+5,08
Р<0,001
17,7+.5,9
Р<0,002
14 1 «-1 7
Р>0,5
0,1 мл на 10,0 г веса животных
12,0+ 2,3
1 1,6+ 1,6
11,6":1,5
10,2 +1.9
КоНтроль
2 ная крахмальная слизь
Время е лекса, с, 25,77 +15,47
Р<0,001
Таблица 3
12,7«- 3,29
Р>0,25
15,8 +3,77
Р>0,01
1014231
Таблица 4
Составитель
Редактор Т.Шарганова Техред М.Моргентал Корректор О,Кравцова
Производственно-издательский комбинат "Патент", г. Ужгород, ул.Гагарина, 101 г
Заказ. 550 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж 35, Раушская наб., 4/5