Способ получения производных 3,4,5-тригидроксипиперидина
Иллюстрации
Показать всеРеферат
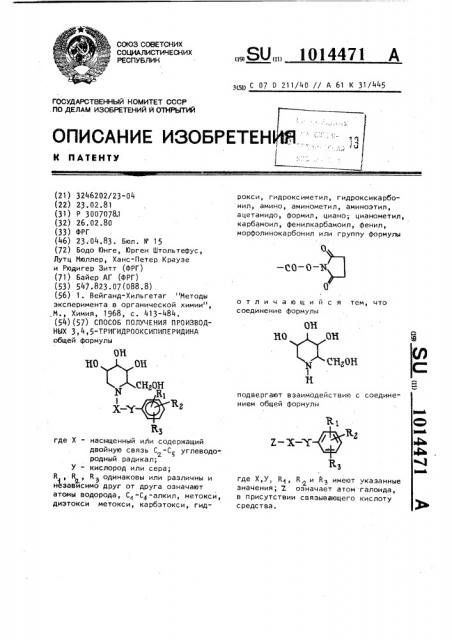
СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3,,5-ТРИГИДРООКСИПИПЕРИДИНА общей формулы ОН СНгОН RI X-Yгде X - насыщенный и;1и содержащий двойную связь углеводородный радикал; У - кислород или сера; R, , fl., Rj одинаковы или различны и независимо друг от друга означают атомы водорода, С -С -алкил, метокси, диэтокси метокси, карбэтокси, гидрокси , гидроксиметил, гидроксикарбонил , амино, аминометил, аминоэтил, ацетамидо, формил, циано-,- цианометил, карбамоил, фенилкарбамоил, фенил, морфолинокарбонил или группу формулы V -со-о-к 0 отличающий с тем, что соединение формулы ОН «OYV - СИгОН Н подвергают взаимодействию с соединением общей формулы
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ОПИСАНИЕ ИЗОБРЕТЕН
К ПАТЕНТУ
СНАМОМ
И1
Х-.Г-ф
>а
3.
z-х=
ГОСУДАРСТ8ЕННЫЙ КОМИТЕТ СССР . ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 3246202/23-04 (22) 23.02.81 (31) P 30070781 (32) 26.02.80 (33) фРГ (46) 23.04.83. Бюл. Ю 15 (72) Бодо Юнге, Юрген Штольтефус, Лутц Мюллер, Ханс-Петер Краузе и Рюдигер Зитт (ФРГ) (71) Байер AI (фРГ) (53) 547.823.07(088.8) (56) 1. Вейганд-Хильгетаг "Методы эксперимента в органической химии", М., Химия, 1968, с. 413-484. (54)(57) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3,4,5"ТРИГИДРООКСИПИПЕРИДИНА общей формулы где Х " насыщенный или содержащий двойную связь С -С углеводо-.
z родный радикал;
У - кислород или сера;
R „ R „ R > одинаковы или различны и независимо друг от друга означают атомы водорода, С -С -алкил, метокси, диэтокси метокси, карбэтокси, гид„„SU„„1014471 A
З5„ С 07 D 211/40 // А 61 к 31/445 рокси, гидроксиметил, гидроксикарбо" нил, амино, аминометил, аминоэтил, ацетамидо, формил, циано;- цианометил, карбамоил, фенилкарбамоил, фенил, морфолинокарбонил или группу формулы отличающийся тем, что соединение формулы подвергают взаимодействию с соединением общей формулы где Х,У, R, R и Й имеют указанные значения, 2. означает атом.галоида, в присутствии связывающего кислоту средства.
1014471
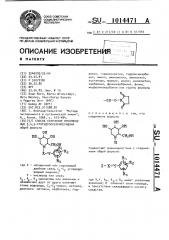
Изобретение относится к способу получения новых производных 3,4,5тригидроксипиперидина общей формулы где Х вЂ” насыщенный или содержащий двойную связь С -С- углеводородный радикал;
У вЂ” кислород или сера„:
R,,Й,К одинаковы или различны и независимо друг от друга означают атомы водорода, С„ -C -алкил, метокси, дизтоксиметокси, карбзтокси,, гидрокси, гидроксиметил, гидроксикарбонил, амино, аминометил, аминоэтил, ацетамидо, формил, циано, цианометил, карбамоил, фенилкарбамоил, Фенил, морфолинокаобонил или группу Формулы которые обладают ценными фармакологи-у ческими и биологически активными свойствами„ позволяющими использо.вать их в медицине и гельскпм хозяйстве.
Известен способ алкилирования аминов алкилгалогенидами в Ilрисутст вии связующих кислоту средств.
Реакцию предпочтительно проводят в среде инертного органического растворителя при нагревании f1) .
Цель изобретения - разработка на основе известного метода способа получения новых производных 3,4,5"тригидроксипиперидина, которые могут быть использованы в медицине в качестве средств от диабета, гиперлипемии и ожирения, а также в животноводстве в качестве средств, влияющих на соотношение мяса и жира в пользу мяса у животных, Поставленная цель достигается тем, что согласно способу получения проиэводных 3,4,5-тригидроксипиперидина общей формулы подвергают взаимодействию с соединением общей формулы10 где Х, Y R,, R и R имеют укаэанные
-1 значения; 7 означает атом галоида, в присутствии связующего кислоту средства.
Пример 1 . М -(-Йеноксизтил-1-дезоксинойиримицин.
Суспенэию иэ 9,7 г дезоксинойиримицина и 12,4 г порошкообразно о карбоната калия в 100 мл абс. диметилформамида и 15,7 r P-феноксиэтилбромида размешивают в течение 5 ч
30 при 90-10ООС, Затем реакционную массу охлаждают
v„ отсасывают, фильтрат сгущают при
О о0 С ванны на ротационном испарителе. Сгущенный остаток в горячем со35 стоянии растворяют в малом количестве воды и оставляют стоять в течение
18 ч при 5 С, полученные кристаллы отсасывают и промывают ледяной водой.
Получают 10„5 г кристаллического осад4Ñ ка с то кой плавления 146 С.
Пример 2. H- 5-Феноксипентил -1-деэоксинойиримицин.
4,6 г 1-дезоксинойиримицина, 1 .-;.г
5-Феноксипентилбромида и 6,? г порошкообразного карбоната калия размешивают в течение 5 ч при 100 С, Затем охлаждают и отсасывают. Фильтрат сгуо щают при 70 С в ротационном испарителе, Сгущенный осадок растворяют 0 à 300 мл этанола, После добавления осветляющей земли фильтруют и сгущают, Полутвердый продукт размешивают с ацетонитрилом, отсасывают и промывают ацетонитрилом и водой. Получают 6 35 г бесцветного продукта с точкой плавления 138-139 С.
Пример 3. и -(4-Фенокситоансбутен-2-ил)-1-дезоксинойиримицингидрат.
3 10
Суспензию из 3,6 г 1-.дезоксинойиримицина и 4,55 г размолотого карбоната калия в 40 мл абсолютного диметилформамида и 6,2 r 1-фенокси-4-бромтрансбутена-2 в течение 5 ч при о
100 С размешивают. Затем реакционную массу охлаждают и отсасывают от соли. о
Фильтрат сгущают при 60 С и сгущенный остаток размешивают с малым количеством воды. Полученный твердый продукт отсасывает и промывают водой и изопропанолом. После перекристаллизации из воды получают 3,1 r почти бесцветных кристаллов с точкой плавления 120 С.
Пример 4. N-(P-Фенилтиоэтил)
-1-дезоксинойиримицин.
19,4 г 1-дезоксинойиримицина, 24,8 г порошкообразного карбоната калия и 33,9 2-фенилтиоэтилбромида в 200 мл абсолютного диметилформамида размешивают в течение 8 ч при 90100 С. Затем охлаждают, отсасывают и фильтрат сгущают при 60 С на ротационном испарителе. Маслянистый остаток очищают на колонке высотой
120 см и шириной 6 см, содержащей в качестве неподвижной фазы целлюлозу. и в качестве подвижной фазы сначала ацетон, затем 95 -ный ацетон. Чистые фракции соединяют и сгущают. Затем перекристаллизовывают из изопрапанола
Получают 16,3 г бесцветного вещества с точкой плавления 121-1 3 С.
Пример 5. N-(4-(3-Метилфенилтио)-бутен-2-ил)-1-дезоксинойиримицин.
Смесь из 7,2 г 1-дезоксинойиримицина, 9,1 г порошкообразного карбоната калия и 22 г бромида 4-(3-метил.Фенилтио)-бутен-2-ила и 80 мл абсолютного диметилформамида размешивают в течение 7 ч при 100 С. Затем охлаждают, отсасывают и сгущают. Остаток наносят на колонну, содержащую в качестве неподвижной фазы целлюлозу и в качестве подвижной фазы ацетон.
Чистый продукт получают при применении 98 -ного ацетона. Чистые фракции упаривают. Кристаллизуют из небольшого количества этанола. Получают
12,5 t бесцветных кристаллов с точкой плавления 1 06в С .
Пример 6. N-(4-(4-Хлорфенилтио) -бутен-2-ил) -2-дезоксинойиримицин.
7,2 г 1-дезоксинойиримицина, 9,1 г карбоната калия и 20,8 г бромида 4"(4-хлорфенилтио) -бутен-2-ила в 80 мл
14471 4 абсолютного диметилформамида размешивают в течение 6 ч при 100 С. Затем реакционную массу охлаждают, отсасывают и упаривают . Остаток растирают с водой и образовавшийся твердый продукт отсасывают. После перекристИллизации из ацетонитрила с малым содержанием изопропанола получают 6,7 г бесцветных кристаллов с точкой плавно пения 93-95 С.
Аналогично примерам 1-6 получают следующие соединения.
1. N-(4-Феноксибутил)- 1-дезоксинойиримицин с точкой плавления 110 С.
15 Выход 322.
2. N-(p-(?.,6-Диметилфенокси) -этил) "
-1-дезоксинойиримицин с точкой плавления 155-156 С. Выход 304 °
N-($ (2,6-Диметоксифенокси)-прогв пил)-1-дезоксинойиримицин с точкой плавления 128 С. Выход 28,5 .
4. N-(p-(?,4-Дихлорфенокси)-этил)-1-дезоксинойиримицин с точкой плавления 175-176 С. Выход 26,5/ °
5. N-(Я-Феноксипропил)-1-дезоксинойиримицин с точкой плавления 152 С.
Выход 341.
6. N-(4-И-Метоксифенилокситрансбутен-2-ил)-1-дезоксинойиримицин с точкой плавления 163-166 С. Выход
22?, .
7 ° N- (4- (4-Карбэтоксифенилокси)"
-бутен-2-ил) -1-дезоксинойиримицин с точкой плавления 170-172 С. Выход
24 .
8. N- (P (4-Метоксифенокси) -этил)— 1-дезоксинойиримицин с точкой плавления 175-178 С, Выход 26,5i
N-(Р-(4-Хлорфенокси)-этил)-1-дезоксинойиримицин с точкой плавления 156-15 С. Выход 28:,.
10. N-(p-(4-Цианофенокси)-этил)-1-дезоксинойиримицин с точкой плавления 125 С. Выход 32,51.
11 ° N-(P-(3-Метилфенокси)-этил)4 -1-д зоксинойиримицин с точкой плавления 13?-134 С. Выход 31/.
12. N-(P-(4-Метилфенилтио)-этил)— — 1-дезоксинойиримицин с точкой плавления 126-1?7 С, Выход 29,5r-,.
13. N †(4"Трет-бутилфенилтио) -бутен-2"ил — 1-дезоксинойиримицин с точкой плавления 138-140 С. Выход 284.
14. К вЂ” 4- 4-Метилфенилтио(-бутен-?-ил)-1-д зоксинойиримицин с точ55 кой плавления 83 С. Выход 31 1.
15. N-(4-(4 .Фенилфенокси)-бутен-2-ил)-1-дезоксинойиримицин с точкой плавления 165-169 С. Выход 32,5Ф.
101 4471
И- (P (4 "Ацетамидофенокси)(-этил"7 "t-дезоксинойиримицин с точ" кой плавления 169-170 С. Выход 25ь.
17. N-(P"(4-Зтоксикарбонилфенокси
-этил)"1-дезоксинойиримицин с точкой плавлвния 154ОС. Выход ?83 С.
18. N"(Pr-(4-Формилфенокси)-атил)-1-дезоксинойиримицин с точкой плавления 149 С ° Выход 27 ° й"(P-(4-Гидроксифенокси)-этил)-1-дезоксинойиримицин с точкой плавления 149-15t С. Выход 26,5i.
20. N- (P- (3-Зтоксикарбонилфенокси)"этил)"1-дезоксинойиримицин с точкой плавления 116 С. Выход 293.
21. Гидра т N- (4-ацетамидофенокси) -.
-бутен-2-ил)-1-дезоксинойиримицина с точкой плавления 82 С. Выход 254.
22, N-(P-(4-Аминометилфенокси)-этил)-1-дезоксинойиримицин с точкой плавления 169 С. Выход 301.
23. И-(4-Гидроксиметилфенокси)-этил "1-дезоксинойиримицин с точкой плавления 173-174 С. Выход 23ã..
24, N-(4"(4-Аминофенокси)-бут-2-ен-ил)-1-дезоксинойиримицин с точкой плавления 110ОС. Выход 314.
25. N-(P-(4-Аминофенокси)-атил)-1-дезоксинойиримицин-дигидрохлорид с точкой плавления 272 С (разлагает- Зо ся). Выход ?83.
26. N-(P-(4-Гидроксикарбонилфенокси)-этил)-1-дезоксинойиримицин с точкой плавления 235-237ОС. Выход
243, 27. N-(-(3-Гидроксикарбонилфенокси)-этил)-1-дезоксинойиримицин (в виде пени). Выход 20,54, 6
28. N (P (4-Диэтокс иметоксифенокси) этил)-1 "дезоксинойиримицин с точкой плавления 118 С. Выход 22 .
29. N-(P-(4"Трет.-бутилфенилтио)-этил)-1-дезоксинойиримицин (в виде бесцветного масла). Выход 254.
30. М -(,4-Фенилтиобутен-2-ил -1-дезоксинойиримицин с точкой плавления 1t7-1t9 С. Выход 30 °
31.11 g pi- 4-Цианометилфенокси-этил -1-дезоксинойиримицин с точкой плавления 128-13? 26,54.
32. H gP- 4-Аминоэтилфенокси-этил)-1-дезоксинойиримицин с точкой плавления 159-162 С. Выход 28 .
33.й -(P 4-Гидроксикарбонилфенокси — этил -! äåýîêñèíîéèðèìèöèí в виде Й -гидроксисукцинимидового эфира о с точкой плавления 137-139 С. Выход
20 .
34. N -(P -(4-Карбамоил-фенокси)-этил )-1-дезоксинойиримицин с точкой плавления 183-!84 С. Выход 342, 35. N-(P-(4-Морфолинокарбонил-фенокси)-этил)"1-дезоксинойиримицин (в виде пены). Выход 18 .
36, N-(2-(4-Фенилкарбамоилфенокси)-этил)-1-дезоксинойиримицин с точкой плавления 196 С. Выход 31ь, 37. N- (2- (4-Фенилфенокси) -этил)-1-дезоксинойиримицин с точкой плавления 198 С. Выход 30,5i.
Предложенный способ позволяет получать новые биологически активные соединения, которые могут быТь использованы в медицине в качестве средств от диабета, гиперлипемии и ожирения, а также в животноводстве.
Составитель F :. Сергеев
Редактор О. Половка Техред К.Мыцьо Корректор А. Лзятко аказ 30 /68 Тираж 16 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
1130)5 Москва, Ж-)$ Раушская наб. д. 4/5
Филиал ППП нПатент", r, Ужгород, ул. Проектная,