Способ получения производных хинолинкарбоновой кислоты или их гидратов
Иллюстрации
Показать всеРеферат
Способ получения производных хинолинкарбоновой кислоты общей формулыQ ,-.. Hidl/Jfгде R-CaHg-, 4-Р, ,. Rj-F или С1 или представляют собой j CH-CHj, или их гидратов,, отличающ и и с я тем, что соединение общей формулы dooH. подвергают взаимодействию с формаль .дегидом в присутствии муравьиной кислоты с выделением целевого продук1 (Л та в свободном виде или в виде его гидратов. с
СОЮЗ GOBETCHHX
СОЦИАЛ ИСТИЧЕСНИХ
РЕСПУБЛИН (19) (И) 3(59 О 07 D 401 04 А 61 К 31 47
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ ),,;:3
К ПАТЕНТ .Ф
POOH
Ry 3g
Вз Я1 (21) 2968349/3254244/23-04 (22) 03.03..81 (23) 21.08,80 (31) 54-106776 (32) 22.08.79 (33) Япония (46) 30.04.83. Бюл. Р 16 (72) Цутому Ирикура, Хироси Кога и Сатоси Муралма (Япония) (71) Киорин Сейяку Кабусики Кайся (Япония) (53) 547.831.9(088.8) (56) 1. Физер Л., Физер М. Реагенты для органического синтеза..Т. 4, М., Мир, 1971, с. 68. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
ХИПОЛИНКАРБОНОВОИ КИСЛОТЫ ИЛИ ИХ
ГИДРАТОВе (57) Способ получения производных хинолинкарбоновой кислоты общей формулы 0
СООН где „— Сд Н, В",-F, .
Ry-F или Cl или Н„+Из представляют собой -СН -CH -СН-СНЗ а, Э или их гидратов,.о т л и ч а ю— шийся тем, что соединение общей
Формулы подвергают взаимодействию с Формаль .дегидом в присутствии муравьиной (9 кислоты с выделением целевого продук1 та в свободном виде или в виде его гидратов.
1015827
Изобретение относится к способу получения новых производных хинолинкарбановой кислоты общей формулы р (Е) где R Ñ Í, R i" F R — F или Cl или
R +Вз представляют собой -СН -СН вЂ” 10 л, Й"-СНэ, или их гидратов, обладающих сильным антибактериальным действием.
Известен способ алкилирования аминов формальдегидом в присутствии 15 восстановителя, например муравьиной кислоты $1).
Целью изобретения является способ получения новых производных хинолинкарбоновой кислоты общей .формулы I, обладающих ценными формакологическими свойствами.
Указанная цель достигается способом получения соединений общей формулы Е путем взаимодействия со2 единения формулы
СОИ
30 где R„-R > указаны выше,,с формальдегидом н присутствии муравьиной кислоты с выделением целе- 35 ного продукта в свободном виде или
)в виде гидратон.
Пример 1. 1-Этил-6,8-дифтор-
1,4-дигидро-4-оксо-7-(4-метилпиперазино)-хинолин-3-карбононая кислота.4р
Смешивают гидрохлорид l-этил-б,8дифтор-1,4-дигидро-4-оксо-7-пиперазинохинолин-3-карбоновой кислоты (0,75 r) формиат натрия (0,27 г), 87%«ную мураньиную кислоту (4 мл) и 37%-ный раствор формальдегида (4 мл) и смесь кипятят в течение
5 ч. Реакционную смесь выпаривают.
К остатку добавляют воду (10 мл), рН раствора доводят до 7 с помощью
10%-ного раствора едкого натра и экстрагируют дихлорметаном. Органический слой промывают водой, сушат безводным сульфатом натрия и выпаривают. Остаток перекристаллизовывают из смеси диметилформамида 55 (ДИД) и этанола, в результате чего получают (),45 г l-этил-б,8-дифтор1,4-дигидро-4-оксо-7-(4-метилпиперазино)-хинолин-3-карбоновой кислоты в вице бесцветных кристаллов. у)
T.ïë. 245-246 С.
Вычислено, В С 58,11; Н 5,.45;
К 11,86
С„ H q 0 NqFg
Найдено,в: С57.97; Н5,48; 12,02 65
Пример 2. 9-Фтор-6,7-дигидро-5-метил-1-оксо-8-(4-метилпиперазино)-1Н, 5Н-бензо (ij) хинолизин-2карбоновая кислота.
Смесь гидрохлорида 9-фтор-6,7-дигидро-5-метил-1-оксо-8-пиперазино-lН, 5Н-бензо (ij) хинолизин-2-карбоновой кислоты (0,9 г), формиата натрия (0,64 г), 87%-ной муравьиной кислоты (5 мл) и 37%-ного растнора формальдегида (5 мл) кипятят в течение 5 ч.
Смесь выпаривают досуха и добавляют водный раствор едкого натра, щелочной раствор нейтрализуют уксусной кислотой и экстрагируют дихлорметаном. Органический слой промывают водой, сушат безводным сульфатом натрия и выпаривают. Твердый остаток йерекристаллизовынают из смеси ДМФ и этанола и получают 0,70 г 9-фтор6,7-дигидро-5-метил-l-оксо-8-(4-метицпиперазино)-1H,5Н-бензо (ij) хинолизин-2-карбоновой кислоты в ви,це бесцветных игольчатых кристаллов.
Т.пл. 261-263 С.
Вычислено, Ъ: С 63,50; Н 6,17;
И 11,69
С„ ) Н О, Н
Найдено, Ъ: С 63, 45; Н 6, 20;
N 11,65
Пример 3. 8-Хлор-1-этил-бфтор-1,4-дигидро-4-оксо-7-(4-метилпиперазино)-хинолин-3-карбононая кислота.
Гидрохлорид 8-хлор-l-.этил-б-фтор1,4-дигидро-4- оксо-7-пиперазинохинолин-3 -карбоновой кислоты (0,25 r), формиат натрия (0,5 г), 87%-ную муравьиную кислоту (5 мл) и 37%-ный раствор формальдегида (5 мл) смешиt p вают и кипятят н течение 6,5 ч.
Раствор упаривают и подщелачинают водным раствором едкого натра. щелочной раствор нейтрализуют уксусной кислотой, экстрагируют дихлорметаном и нЫпаривают. Остаток перекристаллизовывают из этанола, в результате че го получают 0,21 r 8-хлор-1-этил-6фтор-1,4-дигидро 4-оксо-7-(4-метилпиперазино)хинолин-3-карбоновой кислоты в виде бесцветного порошка.
Т.пл. 213-216 С.
Вычислено,Ъ: С 54,84; Н 5,28;
N 11,29 с1 н р Оэ N g F cl 1/4 н О
Найдено, В: С 54,98; Н 5,20;
N ll,14
Эксперимент 1. Антибактериальное действие (in vitro), Антибактериальное действие соединений данного изобретения оценивают с помощью стандартного метода агарового разбавления против грамположительных и грамотрицательных бактерий „
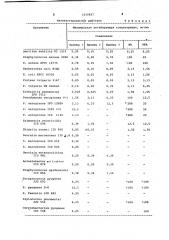
Полученные результаты в сравнении с данными для известных соединений представлены в табл. 1.
1015827
Т а б л и ц а 1
Лнтибактериальное действие
Организмы
Минимальная ингибирующая концентрация, мг/мп
Соединение
Пример 1 Пример 2 Пример 3 NA
PPA
0,10
6,25
pacillus subtilis PC 1219
6,25
0,20
0,20
Staphylococcus aureus 209P 0.,20
0,39
100
100
S. aureus ATCC 14775
0,78
0,39
100
Escherichia co1i NIHJ
0 05
0,10
1,56
Е. coli ATCC 10536
1,56
Proteus vulgaris 3167
0,05
3,13
3,13
P. vulgaris XK Denken
0,20
0,39
3,13
6,25
1,56
К1ebsiel lа pneumonial
IFO 3512
Pseudomonas aeruginosa V-1
0,05
0,025
1,56
12,5
1,56
3,13
6,25
100
12,5
P. aeruginosa IF0 12689
3,13
) 200
6,25
) 200
P. aeruginosa IIDI 2 .0
P. aeruginosa IID 1130
)200
Salmonella елаeritidis
IID 604
12,5, . 12,5
0,39
0 05
Shigella sonnei IID 969
1,56
1,56
Serratia marcescens IID ф,8 0,20
S. marcescens IID 619
S. marcescens IID 620
Gersinia entегоcolitica I ID 981.
0,20
0,39
0,39
Acinetobacter anitrabtus
IID 876
0,39
0,20
0,20
Staphylococcus epidermidis
IID 866
0,78
1,56
0,39
Streptococcus pyogenes
ТЛЭ 692
) 100
)100
) 100
)100
Diplococcus pneumonial
JJD 552
)100
)100
6,25
Corynebacterium pyogenes
IID 548
6,25
100
S. pyogenes S-8 .
S. faecalis ТЛ) 682
0,05
0,05
0,10
0,025
12 5
3,13
0,39
0,20
6,25
12,5
6,25
0 05
0,05
1,56
40,05
0,78
1,56
0 05
0,05
3,13
3,13
1015827
Соединения примеров 1,2 и 3 более активны, чем налидиксиновая кислота и пипемидиновая кислота про тив грамположительных и грамотрицательных бактерий.
Ф
Зксйеримент 2. Антибактериальное действие (in vivo).
Т а блица 2
Сравнительное действие соединений примеров 2,3 и 6 AM-715, NA РРА и МЕХ против системных поражений
ЕП, мг/кг
Соединение
S. marcescens S, aureus
G,N 7577 Smith
P. aeruginosa
G .N 1187 (17, 5
21,3
9,2
Пример 1
Пример 2
АМ-715
24,5
44, 9
38,0
38,0
> 400
>400
> 400
ЙА
183
280
)400
PPA
78,6
98,4
МЕХ
150.Ю
1-Этил-б-фтор-1,4-дигидро-7-пипераэино-4-рксохинолин-3-карбоновая кислота.
Составитель Н. Нарышкова
Техред М. Гергель Корректор Е. Рошко
Редактор.С. Пекарь
Заказ 3238/53 Тираж 4 18 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, МоСква, Ж-35 Раушская наб, д, 4/5
Филиал ППП Патент, r. Ужгород, ул. Проектная, 4
Системные заражения проводят на мышиных мужских особях (весом 20 i) внутрибрюшинным способом с помощью суспензий следующих испытуемых штаммов в 0,5 мл вытяжки центральной части мозга, содержащей 5% муцина:
Pseudomonas aeruginosa GN11187,3,3х х10 кнеток, Staphylococcus aureus
Smith 3,0х10 клеток. Яегга 1а шаг
cescens GN 7577,2,2х10 " клеток. Препараты вводят мышам орально дважды в день, сразу и через 4 ч после заАнтибактериальное действие соединений примеров 1 и 2 in vivo определяют методом системных заражений.
Реэулътаты испытаний представлены в табл. 2. в сравнении с данными
5 "для AN-715, налидиксиновой кислоты (NA), пипемидиновой кислоты (PPA) и милоксацина (NZX) .
35 ражения, терапевтическое действие препаратов оценивают по выживаемости.
Сравнение антибактериального действия in vivo проводят на основе средНей эффективной дозы (ЕД qp), рассчитанной по данным анализа проб.
Антибактериальное действИе in vivo соединений примеров 2,3 и 6 значительно больше, чем активность соедидинений AM-715, PPA и милоксацина против системных заражений мышей каждым типом бактерий.