Способ определения содержания живых микроорганизмов
Иллюстрации
Показать всеРеферат
СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ЖИВЫХ МИКРООРГАНИЗМОВ в исследуемом образце, предусмвтрк&акядий приготовление суспензии микроорганизмов в водной среде, отличающийс я тем, что, с целью ускорения и упроще НИН способа, суспензию микроорганизмов окрашивсиот красителем на мертвые клетки, ведут..подсчет окрашенный мертвых клеток, затем суспензию инактивируют путем нагрева при 70-100 с в . течение 0,5-5 мин или путем химической обработки, после чего ведут подсчет общего кэличества окрашенных мертвых клеток и по разнице двух пбщсчетов определяют содержание живых клеток в суспензии. (Л С
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИН
09) (И) М5)) С 12 N 1 00
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABT0PCROMY СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3293587/28-.13 (22) 28 ° 05.81, (46) Z3.05.83. Бюл. 9 19 (72) В. Х.Тихонов, A.H.Èåçeíöåâ, В.Л.Земляков и Н.В.Цветкова (71) Всесоюзный научно"исследовательский институт биологического приборостроения (53) -576.8.093.6(088.8) (56) 1. Практикум по микробиологии.
Под ред. Н.С.егоpoaa. Изд-во МГУ, 1976, с. 61-65. .2, Strugger S °, Fluorezenzmikroskopie цпй Nikrobiologie.. Verlag И.Н.Schaper, Hannover, 1949, с. 101113 °
3. Пешков Н.A. Цитологкя бактерий.
1955, с. 20ч (54) (57) СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖА
НИЯ ЖИВЫХ МИКРООРРАНИЗМОВ s исследуемом образце, предусметривающый приго" товление суспенэии микроорганизмов в водной среде, отличающийся тем, что, с целью ускорения и упроще ния способа, суспенэию микроорханиэмов -окрашивают красителем на мертвые клетки, ведут.:подсчет окрашеннык мертвых клеток, затем суспензию инактивкруют путем нагрева прк 70-100 С в течение 0,5-5 мин или химической обработки, после чего ведут подсчет общего квличества окрашенных мертвых клеток и па разнице двух подсчетов определяют содержание киных клеток в суспензии. В
;101ВН0
Изобретение относится к микробно- 70"100"С в течение 0,5-5 мин или пу огии, в частности к методам опреде" тем химической обработки., после чего ления живых микроорганизмов, и может ведут подсчет общего количества окрабыть использовано в микробиологичес- шенных мертвых клеток и по разнице кой промышленности. двух подсчетов определяют содержание
Известен способ определения числа 5 живых клеток в суспенэии. живых микроорганизмов путем высева Сущность способа заключается в на питательные среды с подсчетом чис" следующих операциях: добавление к ла выросших колоний (1). суспензии красителя, окраска в тече=
Недостатками данного способа явля- ние 3-5 мин, приготовление мазка для ются длительность, составляющая от 10 . счета мертвых клеток, инактивация одного до нескольких дней, и обяза" суспенэии, содержащей краситель, в тельное условие соответствия состава течение 0,5-10 мин, приготовление дреды потребностям определяемых мик- второго мазка для счета общего колироорганизмов, что трудно выполнимц чества клеток, счет клеток в двух при определении смешанных популяций )5 препаратах. микроорганизмов из ферментеров и объ- Одним из наиболее универсальных и ектов окружающей среды. удобных в работе красителей на мертИэвестен способ определения живых зые клетки является флуорохром примуи мертвых бактерий путем окраски об- лин, окрашивающий клетки различных разца красителем акридиновым оранже- 20 классов микроорганизмов . 1лертвые клетвым и подсчета числа бактерий, светя- ки дрожжей хорошо окрашивак>тся также щихся красным (мертвые) и зеленым флоурохромом тиазиновьм красным и аб(живые) светом (2). сорбционным красителем метиленовым
Недостатком этого способа является синим. неоднозначность результатов, обуслов- Оптимальным режимом тепловой инак(ленная, в частности, наличием в про- тивации является нагрев суспенэии при
,бах инактлвированных клеток, сохраня- 70100 С в течение 0,5-5 мин (фиг. 1 кщих ядерный компонент, которые окра- И 2)..Применение более низкс>й темпера шиваются красителем в зеленый цвет. туры, более короткого,и в ряде случаев
Наиболее близким по технической более длительного нагрева приводит к .сущности и достигаемому эффекту яв- З0 уменьшению степени окраски клеток. ляется способ определения содержания При этом хорошее прокрашивание инакживых микроорганизмов в исследуемом тивированных клеток, отмечалось для образце микроорганизмов, предусматри-, всех трех перечисленных красителей, вающий приготовление суспензии микро- причем окрашенные клетки хорошо видорганизмов в водной среде.. 35 ны как в препаратах мазков, так и
Спссоб состоит из следующих oIIepa- " раздавленной-капли . ций мазок бактерий подсушивают на Инактивация путем нагрева удобна воздухе, фиксируют в фиксаторе Кар- тем, что при небольшом времени нагренуа 20 мин, после чего снова подсуши- ва практически не меняется объем клеаают на воздухе не менее 1 ч. Подсу- 40 точной суспензии, что облеучает расшениый мазок окрашивают азур-зозчном чет количества живых клеток .о нри 29 .С в течение 24 ч, затем промы- Примером химической инактивации
Вают в дистиллированной воде, подсу- . может служить обработка фенолом, коШивают на воздухе 5-10 мин, докраши- торая дает наилучшие результаты при вают раствором крас теля светлого зе- концентрации фенола б-12% (фиг, 3) ,леного 1 мин, затем удаляют остатки причем достаточно даже 30-секундной краски, подсушивают и микроскопируют.. обработки (фиг. 4). Обработка меньшиЖивые клетки бактерий окрашиваются ми и болыаими концентрациями фенола в сине-фиолетовый цвет, .а мертвые приводит к ослабленной окраске клеклетки приобретают ярко"зеленУю ок" ток, кроме того, обработка большими раску (3). концентрациями фенола в случае примеНедостатками известного способа нения флуорохромс в ведет к повышению .являются большая трудоемкость и дли- люминесценции фона. Обработка фенолом тельнасть (более 26 ч). путем добавления спиртового раствора о целью изобретения является ускоре" или водной эмульсии приводит к хороше".. ние и упрощение способа. му окрашиванию клеток примулином и
Поставленная цель достигается тем, метиленовым синим (фиг. 3).. После обчто согласно способу определения со- работки фенолом можно готовить для держания живых микроорганизмов в ис- счета как препараты сухих мазков, так . следуемом образце, предусматривающем и раздавленной капли . приготовление суспензии микроорганиз"60 Инактивацию можно проводить и друмов в.водной среде, суспензию микро- . гимн дезинфектантами, например спирорганизмов окрашивакт красителем íà . том, мертвые клетки, ведут подсчет окра- Инактивацию путем добавления жид шенных мертвых клеток, затем суспен- кого химагента предпочтительнее прозию инактивируют путем нагрева IIpH 65 водить в тех случаях, когда по раэ1018970 личчым причинам нежелательна тепловая инактивация ..в случае определения термофильных микроорганизмов, при наличии в пробе низкокипящих приме сей и теде
Инактивация клеток в присутствии 5 красителей имеет следующие преимущест ва перед инактивацией неокрашенных клетокг она более экономична (требуется всего одна суспензия) и более удобна:для автоматизации. способ осуществим для различных .видов микроорганизмов: представителей энетероб@ктерий,, грамотрицатель.иых езробиых хемогетеротрофов, кокков,. бацилл, дрожжей ° 15
; После инактивации в предложенных режимах клетки всех:исследованньи микроорганизмов сохраняли размер и . Форму и поэтому легко были узнаваемы по морфологическим признакам. Количество микроорганизмов, окрашенных предлагаемым способом, можно определять различными методамиг све.товой и люминесцентной микроскопией, автоматическим счетом на микрофотометре, или микрофлуориметре, а также макрометодами, в.частности Флуоримет рйей.
На фиг. 5 показана калибровочная кривая для .окрашенной примулином суспенэИН кле;ок Е.со11 (17-часовая куль-30 рура, содержащая практически одни живые клетки) до. и, после тепловой инак» тивации с регистрацией флуоресценции. в кювете на спектрофлуориметре. Инактивация дает .возможность измерятв ко-35 личество первоначально живых клеток по приросту флуоресценции после инактивации и определению числа клеток по предварительнУ построенной калиб:ровочной кривой. Люминесценция сус- 4(} пензии ..мертвых клеток не. увеличива лась после .ийактивации.
Использовали .культуру. следующих возрастов: Kscherichia coli - - 7-ча совая, Вас .11ив thuringiensis - 17часовая, Saccharomyces cerevisial24 часовая. ,(итенсивность люминесценции от отдельных клеток s мазках на предметных стеклах измеряли (в условныс единицах О на лкыинесцентном-микроскопе а помощью Фотометрической насадки и выражали в процентах по отношению .к наивысшей величине, полученной в даиной серии опытов.
Величину оптической плотности вычисляют по формуле Е " вЂ, гд Х - интенсивность падаккцего света Х -. ин тенсивность света,. прошедшего через клетку. Хо и I измеряют иа микроскопе ИЛ-2 с помощью фототермической на-бО садки при освещении црепарата мазка снизу красным светом. Величину оптичесной плотности выражают в процентах по отношению к наивысшей величине, полученной в данной серии Опытов
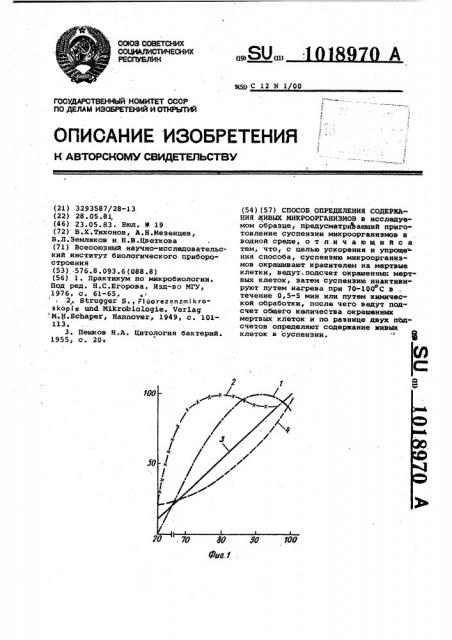
На фиг. 1 показаяа зависимость степени окраски клеток красителями. от температуры при тепловой инактивации: 1) Е .coli + примулин7 2) Вас.
thurincriensis + .примулин; 3} Sacch.
cerevisiae + метиленовый синий;
4) Sacch. cerevisiae + тиазиновый красный.
Время тепловой инактивации " 2 мин. По оси ординат - процент устред-. .ненной интенсивности. люминесценции отдельных клеток в случае флоурохромов-, ,или усредненной величины оптической плотности в случае мегиленового.сине-, гоо °
По оси абсцисс — температура инак-. тивации.
На фиг. 2 — зависимость .степени окраски клеток красителями от време ни тепловой инактивации. 1}. Е,coli+ примулин; 2) Bac. thuringiensis .1- примулин} -3} Sacch, cerevisiae + xe», тиленовый синий; 4) Sacch,: cerevi
siae + тиазиновый красный ° температура .инактивации в случае
Bac; thuringiensis. — 80 С, в оаталь" ных случаях - 98 С.
По оси ординат - то же, что и.на фиг. 1.
По оси абсцисс — время инактивацйи в минутах. . Ha фиг.3. - зависимость степейи ох+ рааки клеток красителями от, концентрат" ции Фенола при инактивацин l)E,cori+, ° ° ° римулин; 2) Вас. И пг5лщ1епвАв + римулин; 3)- Sacch. cerevisiae- + ме тиленовый синий. . По оси ординат — то же, что и иа
Фиг. 1.
По оси абсцисс - концентрация фе-. нола в процентах.
Возраст клеток - как На- фнг. 1.
На фиг. 4 - зависимость- степени окраски клеток красителями от времени инактивации Феиолом: 1) е.coli -+ примулин} 2) Ваа. thuri giensis + нринулину 3) Sacch. сегечЬ.вМе + метиленовый синий. концентрация:фенола в случае дрожжей — 1ОЪ, s остальных случая» - 7В..
По оси ординат - то ке, что и на фиг. 1.
По оси абсцисс --время йнактивации в минутах.
Возраст клеток - как иа Фнг. 1. на фиг. 5 — зависимость Флуоресценции суспензии 17-часовой кудьтуры
Е.со11, окрашенной примулииом, от концентрации клеток, до и йосле ииактивации: 1) суопензйя до инактивации
2) суспензия после инактивации при
98 С в течение 30 с. .По оси ординат - интенсивность лю" минесценции.при )-=490 им (Азоэб.
365.нм}.
По оси абсцисс - общая концентрация клеток.i пробе 10 кл/мл.
Концентрация примулина $0 «асг/ь
Ъ
П .р и м е г 3. К 1,8 мл суспензии клеток 17-часовой культуры Bac. thuringiensis, содержащей жиь ге:и мертвые клетки, добавляют 0,2 мл раствора примуллна (1 мг/мл) на 1/15 M фосфатном буфере рН 6,0-7,8, через 3 мин измеряют число мертвых ярко флуоресцируяцих клеток, как указано в примере 1, затем добавляют к суспензии фенол в виде концентрированного спиртового раствора до кенцентрации 7%, измеряют общее число флуоресцирукщих клеток, как указано в примере 1, и по разнице между двумя отсчетами находят число живых клеток.
Пример 4. К 1 8 мл суспензии
24-часовой культуры Sacer. cerevisiaey содержащей различные соотношения живых и мертвых (убитых нагревом) клеток добавляют 0,2 мл водного раство". ра тиаэинового красного (1 мг/мл), через 3 мин измеряют число мертвых ярко флуоресцирукщих клеток, как указано в примере 1, затем добавляют к измеряют общее число флуоресцирующих клеток, как указано в примере 1, и по разнице между двумя отсчетами находят число живых клеток.
Результаты определения числа живых н мертвых клеток предлагаемым и контрольным способами представлены в таблице.
10189
Объект
Условия обработки
Количество живых клеток, В
Задано в суспензии путем смещения известных коли» честв живых и мертвых клеток
Определено предлагаемым способом
Определено контрольным способомг посевом на питате;;ьную среду
Определено предлагае- мым способом Йicoli
Окраска примулином, ииактивация твплом
Окраска примулииом, инактивация фвиолом
Окраска метилвновым синим ииактивация теплом
100
102
Вас.
thrrin-„
eiesis
Sacch.
cereviа1ае
100
106
1:1,05
2,90г1 0
1:1
3г-1
1г3,08
1г3
Sacch.
cerevi
siae Окраска тиазиновым красным, инактивация этанолом
l. 1
3:1
1! 1,03
2 93г1,0
1г3 03
1г3
Измерения проводились на спвктрб=" флуориметре Aminco Bowman.
Пример 1. К 1,8 мл суспенэии клеток E. coli (8"часовая культура), содержащей живые и мертвые клетки, добавляют 0,2 мл раствора примулина (1 мг/мл) на 1/15 М фосфатном буфере рН 6,0 - 7,8, через 3 мин готовят клеточный препарат по Виноградскому, считают число ярко флуоресцирунщих мертвых клеток, а оставшуюся суспен- 10 зию пригревают 3 мин при 98 С, снова готовят клеточййй препарат по Виноградскому, считают общее количество флоуресцирукщих клеток и по разнице между двумя отсчетами находят число 15 живых клеток. Клетки в препаратах просчитывают на люминесцентном мйкроскопе при возбуждении сверху синефиолетовым светом (объектив r 90, окуляр 10). 20
Пример 2. К 1,8 мл суспензии
24-часовой культуры Sacch. cerevd.sia@, содержащей различные соотношения жи= вых и мертвых (убитых спиртом) клетогг, добавляют 0,2 мл водного раство» 5 ра мвтиг.енового синего (1 мг/мл) и проводят операции, как указано в примвре 1, за исключением того, что подсчет ведут на светопольном микроско,пе при освещении снизу и считают клетки, ярко окрашенные в синий свет.
Соотношение живыегмертф вне.101аюо
fS
Составитель В.Голнмбет
Редактор О.Половка Техреду.Костик КорРектоР Л.Бокван
Заказ 3636/20 Тираж 523 . Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий .
113035, Ж-35 Раушская наб., д. 4/5 юю Мюэ ВМВ Ю
Филиал ППП Патент, г,ужгород, ул.Проектная, 4
Такиьг образом, предлагаемый способ по сравнению с известная позволяет ускорить определение с 26 ч до
1-1,5 ч а также снизить трудоемкость в за счет проведения простых операций, не требующих омывок реактивов н поз воляющнх использовать один набор регистрнруюв ей аппаратуры.