Способ разделения смесей биоорганических соединений
Иллюстрации
Показать всеРеферат
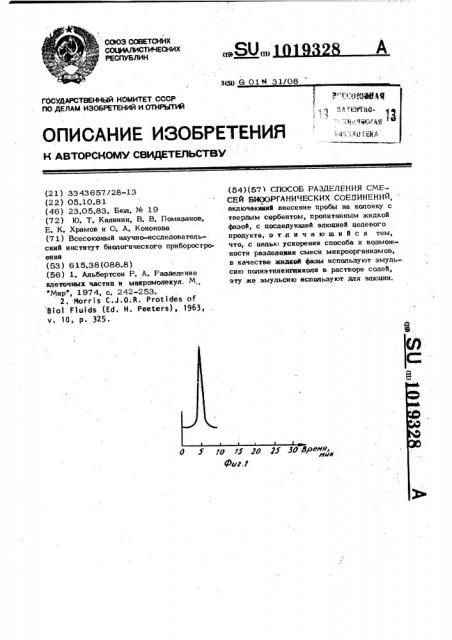
СПОСОБ РАЗДЕЛЕНИЯ СМЕСЕЙ БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙ, вклюмаюший внесение пробы на колонку с твердым сорбентом, пропитанным жидкой фазой, с последукщей элюцией целевого продукта, отличающийся тем, что, с целью ускорения способа и возможности разделекня смеси микроорганизмов, в качестве дксА фазы используют эмульсию полиэтиленгянкопя в растворе солей, эту же эмульсию используют для элюции. (О / 7J- 20 2S 30 Вреня, fjUit Фиг.1
СООЗ СОВЕТСНИХ
СМИАЛИСТИЧЕСНИХ
РЕС УБЛИН (1% O1) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Я01ЕИл к двтоескомм свидетельств
0 $;О 1$20 2$ 30 Вренйф ямм
Фиг.1
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
IlO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТЙЗ (21 ) 3343657/28-13 (22) 05.10.81 (46) 23.0-5.83. Бюп. No 19 (72) Ю. Т. Калинин, В. В. Помазанов, Е. К. Храмов и О. А. Кононова (7 1) Всесоюзный научно-исследовательский институт биологического приборостроения (53) 615.38(088.8) (56) 1. Альбертсон P. А. Разделение клеточных частиц и макромолекул. М,, "Мир, 1974, с, 242-253.
2, Nor r i s С. J. 0. R. Prot i des of Biol Fluids (Ed. H. Peeters), 1963, ч, 10, р. 325. (54)(57.> СПОСОБ РАЗДЕЛЕНИЯ СМЕCEA -БИ0ОРГАНИЧЕСКИХ CQEQHHEHHA, включающий внесение пробы на колонку с твердым сорбентом, пропитанным жидкой фазой, с последукацей элюцией целевого продукта, отличающийся тем, что, с целью ускорения способа и возможности разделения смеси микроорганизмов, в качестве жидкой фазы используют эмульсию полиэтилен1яиколя в растворе солей, эту же эмульсию используют для элюции.
19328 2 двузамещенного фосфата калия (КН Р04 ), е- 0,1% хлористого натрия (М аСФ ), pH - 7,0, образовавшиеся две фазы постоянно перемешивают1подают в колонку со скорос5 тью 0,4 мл/мин с помощью жидкостного насоса. Фаза, обогащенная солью, облада- ет сродством к сорбенту и выполняет роль неподвижной фазы, Анализируемую смесь, содержащую ), -аспарагин и 1„-изо10 лейцин (концентрация каждой аминокислоты 10 Mr /Më), вносят с помощью шприца, объем вносимой пробы 10 мкл. для регистрации аминокислот, вышедших из колонки, применяют их постколоночное окра)5 шивание 2%-ным фпуорескамином, который готовят на ацетоне и подают в проточную кювету со скоростью 0,01 мл/мин.
Флуоресценцию окрашенных веществ измеряют на спектрофпуориметре (Д. воэбужyg дения равна 390 нм, / эмиссии равна
505 нм) в проточной кювете 0 = 10 мм с Д = 0,5 мм, имеющей дополнительный вход для непрерывной подачи красителя.
Смесь аминокислот разделяют за 25 мин. д5 Хроматограмма пробы, содержащей L-аспарагин, представлена на фиг. 1. Хроматограммы пробы, содержащей ь - изолейцин, представлены на фиг. 2, Хроматограмма смеси аминокислот представлена на фиг. 3.
Результаты хроматографического анализа представляются биохимическими исследованиями фракции элюата. Элюат собирают с помощью коплектора фракций и проводят реакцию к ниитидрииом.
1 10
Изобретение относится к биологии и медицине, в частности к способам раздел ния смесей биоорганических соединений и микроорганизмов.
Известен способ р эфеления клеток микроорганизмов,. включающий многократное смешивание и отстаивание легкой и тяжелой фаз вкопонке,,состоящей иэ ряда камер, с последующим распределением клеток и выведением их из колонки.(1).
Недостатком является длительность анализа, обусловленная. многоступенчатостью способа разделения.
Наиболее близким к изобретению по технической сущности и достигаемому эффекту является способ разделения смесей биоорганическйх соединений, включающий внесение пробы в колонку. с твердым сорбентом, пропитанным жидкой фазой, с последующим элюированием целевого продукта.
Согласно этому способу сорбент насыщают фазой (имеющей к нему сродство), которая становится неподвижной. Разделяемые вещества распределяют между подвижной (элюент) и неподвижной фазами и выводят иэ колонки. Этим способом разделяют смесь из бычьего сывороточногоальбумина и лиэоцима,. Бремя анализа
20 ч Г2).
Недостатком способа явпяется длительное время анализа, что обусловпено низкой скоростью движения элюента, так как ,неподвижная фаза плохо удерживается сорбентом и смывается с него злюентом.
Целью изобретения является ускорение способа, а также возможность разделения смесей микроорганизмов.
Поставленная цель достигается тем, что согласно способу разделения смесей биоорганическчх соединений, включающему внесение пробы на колонку с твердым сорбентом, пропитанным жидкой фазой, с последующей злюцией целевого продукта в качестве жидкой фазы используют эмульсию полиэтиленгликоля в растворе солей, зту же эмульсию испопьзуют для элюции.
Способ поясняется примерами.
Пример 1. Анализ смеси двух аминокислот выполненный на колонке с сорбентом, в качестве полимера используют ПЭГ-6000, в качестве соли КН РО, 2. 4-
Берут колонку из нержавеющей стали (6 = 250 мм, d 4,6 мм), заполняют пористыми стеклянными шариками с
Д= 0,04-0,08 мм с порами Д = 186 А.
В качестве элюента применяют водный раствор, состоящий из 10% полиэтиленгликопя типа 6000 (ПЭГ-6000), 10%
Пример 2. Анализ смеси белка и попипентида, выполненный на колонке с сорбентом, в качестве полимера исО пользуют ПЭГ-6000, в качестве соли
КН,РО4.
Берут колонку и заполняют ее пористыми стеклянными шариками аналогично примеру 1. Берут элюент, перемешивают и подают в копонку со скоростью .0,4 мл/мин с помощью жидкостного насоса, Анализируемую смесь, содержащую альбумин и циклический декапептид (грамицидин С), вносят с помощью шприца, объем вносимой пробы 20 мкл. Окрашивание и регистрацию окрашенных биополимеров проводят аналогично примеру 1.
Смесь биополимеров разделяют за 40 мин.
Хроматограмма пробы„с одержащей альбумин, представлена на фиг. 4. Хромато55 грамма пробы, содержащей грамицидин С, представлена на фиг. 5. Хроматограмма смеси биополимеров представлена на фиг. 6, 3 . 10193
Результаты хроматографического анапиэа подтверждаются биохимическими ис-спедованиями фракций эпюата. Эпюат собирают с помощью коллектора фракций и проводят реакцию по Лоурй..5
Пример 3. Анализ баика и микроорганизма, вынопненный на кетонке с сорбентом, в качестве попимера испопь-. зуют ПЭГ-6000, в качестве сопи КН Р04.
Берут колонку из нержавеющей стали .та
° ° ° (С = 250 мм, д= 4,6 мм), заполняют текпянными шариками с д =. 0,18 ,25 мм. В качестве эпюента испопьзуют водный раствор, состоящий нз 10%.
ПЗГ-6000, 10% КН1Р04, pH - 9.6. Об- 15 разовавшиеся две фазы постоянно перемешивают подают в копонку со скоростью
Р
0,6 мп/мин с помощью жидкостного насоса. Фаза, обогащенная сетью, обпадает сродством к сорбенту и выпопняет роль неподвижной фазы. Анапиэируемую смесь, содержащую альбумин (концентрация 10 мгlмл). и Е.СоРт 1257 (концентрация 2-10" кп/мп), вносят в колонку с помошью шприца, объем вносимой пробы 4 мкл. для регистрации белка и микроорганизма, вышедших иэ колонки, применяют посткопоночное окрашивание
2%-ным фдуорескамином, который готовят на ацетоне и подают в проточную .кювету со скоростью 0,01 мп/мин. Фпуоресценцию окрашенных веществ измеряют на спектрофпуориметре (Л возбуждения равна 390 нм, ) эмиссии 505 нм) в проточной кювете = 10 мм, с с =
0,5 мм, имеющей допопнитепьный вход З5 дпя непрерывной подачи красителя. Смесь апьбумина и Е5ЬЕгИйа Соб разделяют за 10 утин, Хроматограмма пробы, содержащей альбумин, представлена на фиг. 7. Хроматограмма пробы, содержащей Е, Соьт 1257, представпена на фиг. 8. Хроматограмма смеси альбумина и Е.Cob 1257 представлена на фиг. 9.
Резупьтаты хроматографического анализа подтверждаются биохимическими (как 45 описано в примере 2) н микроскопичесKHMH исследованиями фракций элюата.
Пример 4. Анализ двух микроорганизмов Е.Соби 1257 и E,Сот М-17
50 выполненный на кслонке с сорбентом, в качестве полимера используют ПЭГ-6000, в качестве соли КН Р04, Берут колонку из нержавеюшей стали (t = 250 мм, д = 4,6 мм), заполняют пористыми стеклянными шариками с: о
, Д= 0,07-0,1 мм с порами d = 84,3 А, В качестве элюента применяют водный раствор, состояший из 10% ПЭГ-.6000, 2
8 а
10% ..КН,РО5, 0,1% М аСЕ, рН=9,0. Образовавшиеся две фазы постоянно перемешивают, подают в копонку со скоростью
0,4 мп/мин с помощью жидкостного насоса. Фаза, обогащенная сопью, обладает
cpoQcTBoM к сорбенту и выпонняет роль неподвижной фазы. Анализируемую смесь микроорганизмов E.Сой 1257 (концентрация 9,95-10" кл/мп) и Е.Соб М-17 (концентрация 1,7 10 кп/мп) вносят в копонку с помощью шприца. -Объем вносимой пробы 10 мкп. Окрашивание и регист- рацию окрашенных микроорганизмов проводят по примеру 1.. Смесь.микроорганизмов разделяют эа 10 мин. Хромато грамма пробы, содержащей Е.Со81 1257, представлена на фиг. 11. Хроматограмма пробы, содержащей Е.Cof j M17 представлена на .фиг. 10. Хроматограмма смеси микроорганизмов представлена: à фиг. 12. Результаты хроматографическог.î анализа подтверждаются микроскопическими исследованиями фракций эпюата. Эпюат собирают с помощью коппектора фракций.
Пример 5, Анализ микроорга»низма BQc1KKUQ Сбгвуь, выполненный на колонке с сорбентом, в качестве попимера используют ПЭГ-6000, в качестве сопи КН Р04 °
Берут копонку иэ нержавеющей стали (ъ= 250 мм, д = 4,6 мм), запопняют пористыми стеклянными шариками с
О= 0,07-0,1 мм с порами Д 84,3 A.
В качестве элюента используют водный раствор, состоящий из 8% ПЭГ-6000, 8% КНтР04, 0,1% MaCf, pH=9, Образовавшиеся две фазы, постоянно перемешивая, подают в копонку со скоростью
0,8 мп/мии с помощью жидкостного насоса. Фаза, обогащенная сопью, обпадает сродством к сорбенту и выпопняет ропь неподвижной фазы. Микроорганизм ЗОС. ,g|y ggq состоящий из вегетативной и споровой форм (м50% тай и другой формы), .вносят в колонку с помощью шприца, объем вносимый пробы 8 мкп. Окрашивание и . регистрацию окрашенных вегетативной и споровой форм проводят по примеру 1.
Хроматограмма микроорганизма оос c8l"905 представненного двумя формами, имеет два пика (фиг. т 4 ) . Микроскопическ. исспе» дования показывают, что первый пик, собранный с помощью коллектора фракций, содержит спороьую форму, второй — вегетативную. Время анализа составляет
8 мнн. Хроматограмма Вос. СВГВ05,,содержащей только вегетативную форму, представлена на фиг. 13.
5 1019
Пример 6. Анализ микроорганизма ВОС.Ю01 1 И Я 1Еп М9, содержащего вегетативную и споровую формы, выпапненный на колонке с сорбентом, в качест ве полимера используют ПЗГ-6000, в качестве соли КН Р04.
Берут колонку иэ н1зржавеюшей стали ((* 500 мм, d * 4,6 мм), заполняют пористыми стеклянными шариками с d о
0,15-0,18 мм и порами Д 126 А, В т© качестве элюента используют водный раствор, состоящий из 10% ПЭГ-6000, 8% КН РО, 0,1% йаС и 0,1% тритона Х-100, рН 9,2. Образовавшиеся две фазы, постоянно перемешивая, подат% ют в колонку со скоростью 0,8 млlмин с помощью жидкостного насоса, Фаза, обогащенная солью, обладает сродством к сорбенту и выполняет роль неподвижной фазы. Микроорганизм Вас.1ИОг1ирЕттч jS состоящий их вегетативной (концентрация 5,3 10 кл/мл) и споровой (концентрация 9,8.10 ui/ìë) форм вносят в колонку с помощью шприца, объем вносимой пробы 20 мл. Окрашивание и регистрацию вегетативной .и споровой форм Bar +Su г1и1
p enosis проводят по примеру 1, Хроматограмма споровой и вегетативной форм
)30сМта 1нреиМв имеет два пика (фиг. 16), i Микроскопические исследования показы- вают, что йервый пик, собранный с помощью коллектора фракций; содержит споровую форму, второй - вегетативную. Время 8H8+ лиза 17 мин. Хроматограмма Вос. 4%Urin18п бтра, содержащей только вегетативную форму, представлена на фиг. 15.
Результаты хроматографического анализа представляются микроскопическими исследованиями фракций элюата. Зпюат собирают по фракциям с помощью коллек- а@ тора фракций.
Пример 7. Анализ двух микро организмов Е.СоК 1257 и Вас. т.:Ьо чир
1тт Ина колонке с сорбентом, в качестве полимера используют: ПЭГ«6000, в качестве соли КН Р04.
Берут колонку из нержавеющей стали (E-- 250 мм, d = 4,6 мм), заполняют стеклянными шариками с Cf =0,18—
0,25 мм. В качестве элюента используют водный раствор,. состоящий из 10%
ПЭГ-6000, 10% КН РО, рН = 9,6, Образовавшиеся две фазы, постоянно перемешивая, подают в колонку со скоростью
0,6 мл/мин с помощью жидкостного насоSS са, Фаза, обогащенная солью, обладает сродством к сорбенту и выполняет роль неподвижной фазы. Анализируемую смесь микроорганизмов Е.Co(i 1257 (концент328 4 рация 2,0 ° 10 о кл/мл) и Зск + то -1Ир
Qns1s (концентрация 9 109 кл/мл) вносят в колонку с помощью шприца, объем вносимой пробы 4 мкл. Окрашивание и регистрацию микроорганизмов проводят по примеру 1.Смесь Б. Co h 1257 и BaC tburin$1ensis разделяют эа 8 мин. Хроматограмма пробы, содержащей Е, Cot 1257 представлена на фиг, 17. Хроматограмма пробы, содержащей ВаС, tgur1иДМ тбтб представлена на фиг. 18. Хроматограмма смеси Е, Сот.1 1257 и Ьос. ЪОг1ттрри 1 представлена на фиг. 19, Результаты хроМатог рафического айализа подтверждаются микроскопическими исследованиями фракций элюата. Зпюат собирают с помощью коллектора фракций.
Пример 8. Анализ двух микроорганизмов Е. Сой 1257 и 50 -садист а>а Х 5 выполненный на колонке с ñîðбентом,в качестве полимера берут ПЭГ6000, в качестве соли КН РО .
Берут колонку иэ нержавеющей стали (e = 250 мм, d = 4,6 мм), заполняют пористыми с-.еклянными шариками с cl = л
0,15-0,18мми порами cl= 126 А. В качестве элюента используют водный раствор, состоящий из 10% ПЭГ-6000, 10%
КН Р04, 0,1% NaC(, рН-9,2. Образовавшиеся две фазы, постоянно перемешивая, подают в колонку со скоростью
0,2 мп/мин с помощью жидкостного насоса. Фаза, обогащенная солью, обладает сродством в сорбенту и выполняет роль неподвижной фазы, Анализируемую смесь, содержащую Е,СоЮ 1257 (концентрация
2 10"о кл/мл) и SarC1na Я0ЧаМ 5 (концентрация 5,7 10 кл/мл), вносят в колонку с помощью шприца, объем вносимой пробы 18 мкл. Окрашивание и ре— гистрацию микроорганизмов проводят по примеру 1.Смесь Е. Со т 1257 и БОус1 о
HGVQ No. 5 разделя.ют за 14 мин. Хроматограмма пробы, содержащей Е.Сот т
1257,представлена на фиг,20. Хроматограммапробы,содержащей SarC
No.5,ïðeäñòàâëåíà на фиг,21. Хроматограмма смеси E. CoR1 1257и 6С1т С1иО Юозас
N. 5 представлена на фиг. 22. Результаты хроматографического анализа подтвер ждаются микроскопическими исследованиями фракций элюата. Элюат собирают с помощью коллектора фракций.
Пример. 9. Анализ двух микроорганизмов Е.Со4 329 и E,Co i AB 2463, выполненный на колонке с сорьентом, в качестве полимера берут ПЭГ-6000, в качестве соли KH. PO .
7 10 193
Берут стеклянную колонку (6 = 150мм
3 = 9 мм), заполняют пористыми стеклянными шариками с д= 0,1-0,16 мм и порами d = 126 А. В качестве элюента используют водный раствор, состоящий из
20% ПЗГ-6000, 10% КН Р04, 0,1%NaCP, рН=7., Образовавшиеся две фазы, постоянно перемешивая, подают в колонку со скоростью 1,8 млlмин с помощью жид. костного насоса. Фаза, обогащенная со лью, обладает сродством к сорбенту и
1 4
;выполняет роль неподвижной фазы. Анали зируемую смесь, содержащую E.Ñoá 329 (концентрация 1,4 ° 10 "0 кл/мл) и E.CoÈ
AB 3463 (концентрация 1,0 10" ил/мл)., т5 вносят в колонку с помощью шприца, объем вносимой пробы 300 мкл. Окрашивание и регистрацию окрашенных микроор ганизмов проводят Ilo примеру 1. Смесь микроорганизмов разделяют эа 10 мин. 20
Хроматограмма пробы, содержащей Е.Соб
329, представлена на фиг. 23. Хроматограмма пробы, содержащей Е.Соб АВ
2463, представлена на фиг. 24. Хроматограмма смеси двух микроорганизмов 2S представлена на фиг. 25. Результаты хроматографического анализа подтверждаются микроскопическими исследованиями фракций элюата. Элюат собирают с помощью коллектора фракций. 30
Пример 10. Анализ трех микро;организмов Е.Соб 1257, Е.Со6 329, Е.Соб Р678-54, выполненный на колонке с сорбентом, в каче<;рве полимеров
i используют декстрансульфат На (Д500 э04йа) в ПЗГ-6000.
Берут стеклянную колонку (6=150 мм, Й= 6 мм» заполняют пористыми стеклянными шариками с 1".т= 0,04-0,08 мм и порами д = 186 А, В качестве элюента используют водный раствор, состоящий из 10% декстрансульфата 14а (l1500
604Ма), 10% ПЭГ-6000, 17,5% йаС0, рН=7,9. Образовавшиеся две фазы, по, тоянно перемешивая, подают в колонку
,.со скоростью 1,2 мл/мин, Фаза обога щенная декстрансульфатом ga, обладает сродством к сорбенту и выполняет роль неподвижной фазы. Анализируемую смесь микроорганизмов Е.Соб 1257, Е.Соб
329, Е,Сой Р678-54 (концентрация
S0 микроорганизмов 1 10" кл/мл) вносят в колонку с помощью шприца, объем вносимой пробы 100 мкл. Окрашивание и регистрацию окрашенных микроорганизмов проводят по примеру 1. Смесь микроорга- низмов разделяют эа 30 мин. Хроматограмма пробы, содержащей Е.Со 1 1257, .представлена на фиг. 28. Хрометограм28 8 ма пробы, содержащей Е.Со6< 329, представлена на фиг. 27. \роматограмма пробы, содержащей E.Cori Р678-54, представлена на фиг. 26, Хроматограмма смеси трех микроорганизмов представпена на фиг, 29.
Результаты хроматографического анализа представляются микроскопически ми исследованиями фракций элюата, Элюат собирают с помощью коллектора фракций.
Пример 11. Анализ трех мик-. роорганизмов Е.Сой1 М-17, Е.Co(i -62
Е,Cori 329, выполненный на колонке с сорбентом, в качестве полимеров используют ПЭГ-4000, ПЭГ-20000, в.качестве соли КНд.1 04
Берут колонку из нержавеющей стали (8- =300 мм, с3 = 9,2 мм) заполняют пористыми шариками с d-0,04-0,08 мм и порами d= 88,8 А. В качестве элюента используют водный раствор, состоя1ший из 6% ПЭГ-4000, 5% ПЭГ-20000, :10% К11 Р04., О, 1% Й аСЯ, рН=7,0. Об разовавшиеся две фазы, постоянно перемешивая, подают в колонку со скоростью
2,4 мл/мин с помощью жидкостного насоса. Фаза, обогащенная солью, обладает сродством к сорбенту и выполняет роль стационарной фазы. Анализируемую смесь микроорганизмов F.CðИ М 17 (концентрация 5,0.10И кл/мл)., Е,Cotò -62 (концентрация 5,0 ° 10 о кл/мл), E.Coé
329 (концентрация 2,5 ° 10 "о кл/мл) вносят в колонку с помощью шприца, объем вносимой пробы 300 мкл, Окрашивание и регистрацию окрашенных микроорганизмов проводят по примеру 1, Смесь микроорганизмов разделяют за 10 мин. Хроматограмма пробы, содержащей E.Cof1
M-17, представлена на фиг. 32. Хроматограмма пробы, содержащей Е.Сот".1 -62, представлена на фиг. 31 ° Хроматограмма пробы, содержащей E.Cob 329, представлена на фиг. 30. Хроматограмма смеси трех микроорганизмов представлена на фиг. 33. Результаты хроматографического анализа подтверждаются микроскопическими исследованиями фракций элюата. Элюат собирают с помощью коллектора фракций.
Пример 12. Анализ трех микроорганизмов E.Co6 1237, E.CoP.1 j-62
Е.С081 УА-8(, выполненный на колонке с сорбентом, в качестве полимера берут
ПЭГ-6000, в качестве соли КН>Р .
Берут колонку из нержавеюшей стали (3 = 250 мм, д = 4,6 мм), заполняют пористыми стеклянными шариками с d о
0,1-0,16 мм и порами (3 = 126 A. В каПример 15. Анализ двух микроорга.измов E.coe HB-101, E.ño L. 329, выполненный на капиллярной колонке, в качестве полимера берут ПЭГ-GOOO, в качестве соли КН РО4.
Берут стеклянную капиллярную колонку (= 20 м с внутренним диаметром
0,3 мм. На внутреннюю поверхность капилляра наносят силикон ОУ-101. В качестве элюента используют водный раствор, состоящий иэ 10% ПЭГ-6000, 10%
КН РО,, 0,1 НаСР, рН = 7. Образовавшиеся две фазы подают в колонку со скоростью 0,4 мл/мин с помощью жидкостного насоса. Фаза, обогащенная ПЭГ-6000 обладает сродством к поверхности кашщпяра, покрытой силиконом ОУ-10 1, и вы9 1019 честве элюеита используют водный раст вор состоящий из 10% ПЭГ-6000, 10% . КН РО,, 0,1% КаС»?, рН=9. Образовавшиеся две фазы, постоянно перемешивая, lIollaIoT B колонку со cKopocTbro0 4 mr/MHH у с помощью жидкостного насоса, Фаза обогащенная солью, обладает сродством к сорбенту и выполняет роль неподвижной фазы. Анализируемая смесь микроорганизмов Е.Сос» 1257 (концентрация 5,0 " rî
«10 У кл/мл), Е.Со с» УА-87 (концентрация .2 ° 10 кл/мл) вносят в колонку с помощью шприца, объем вносимой пробы
30 мкл. Окрашивание и регистрацию окрашенных микроорганизмов проводят по»З примеру 1. Смесь микроорганизмов разделяют эа 14 мин. Хроматограмма пробы, содержащей Е.Сос» 1257, представлена на фиг..34..Хроматограмма пробы содержащей Е.Со1» )-62 представлена щ на фиг. 35. Хроматограмма пробы, сааержашей E.CîÈ УА-87, представлена на фиг. 36. Хроматограмма смеси трех микроорганизмов представлена на фиг. 37.
Результаты хроматографического анализа у подтверждаются микроскопическими ис- следованиями фракций элюата. Элюат собирают с помощью коллектора фракций.
Пример 13. Анализ двух микроорганизмов Е.Соб М-57, Е.Сос» 329, выполненный на капиллярной кспонке, в качестве полимера используют ПЭГ-6000, в качестве соли КН Р04, Берут стеклянную каниллярную колонку 6= 20 м с внутренним диаметром
d = 0,3 мм. На внутреннюю поверхность капилляра наносят силикон СУ-101. В качестве элюента используют водный раствор, состоящий из 10 ПЭГ-6000, 10 .КН Р04, 0,1% КаСР, рН=7. Образо40 вавшиеся две фазы подают в колонку со скоростью 0,4 мл/мин с помощью жидкостного насоса, Фаза, обогащенная ПЭГ6000, обладает сродством к поверхности капилляра, покрытой силиконом ОУ-101, и выполняет роль неподвижной фазы. Анализируемую смесь микроорганизмов Е.Cof ,б М-17 (концентрация 1,4 10 " кл/мл) и
lE.Cod 329 (концентрация 1,4 ° 10 " кл/мл) вносят в колонку с помощью шприца, объем вносимой пробы 15 мкл.,Окрашивание и регистрацию окрашенных микроорганизмов проводят по примеру 1. Анализируемую смесь микроорганизмов разделя- ют за 15 мин. Хроматограмма пробы, содержащей Е.СоЬ N-17, представлена на фиг. 39. Хроматограмма пробы, содержащей E,Coá 329, представлена на фиг. 38. Хроматограмма смеси микроор328 10 ганизмов представлена на фиг. 40. Результаты хроматографического анализе подтверждаются микроскопическими ис.следованиями фракций элюата. Элюат собирают. с помощью коллектора фракций.
Пример 14. Анализ двух микроорганизмов Е.СоЕ» 1257,. Е.СоР» M-17, выпопйенный на капиллярной колонке, в качестве полимера берут ПЭГ»6000, в качестве соли КН РО .
Берут стеклянную капиллярную колонку ь 22 м с внутренним д = 0 3 мм, На внутреннюю поверхность капилляра наносят силиконовую фазу ОУ-101, B качестве элюента используют водный раствор, состоящий иэ 10% ПЭГ-6000,. 15%
КН Р04, 0,1% HaCf, pH = 7. Сбраэовавшиеся две фазы, постоянно перемешивая, подают в копонку со скоростью 0,4 мл/мин.
Фаза, обогащенная ПЭГ-6000, обладает сродством к обработанной силиконом поверхности капилляра и выполняет роль неподвижной фазы. Анализируемук смесь микроорганизмов Е,СоВ» 1257 (концентрация 3,4,10»о кл/мл) rr E.Сой И-17 (концентрация 5,0 ° 10»0 кл/мл) вносят в колонку с помощью шприца, объем вносимой пробы 30 мкл. Окрашивание и регистрацию окрашенных микроорганизмов проводят по примеру 1. Смесь микроорганизмов разделяют эа 8 мин. Хрвматограмма пробы, содержащей E.Co 1257, представлена на фиг. 41. Хроматограмма смеси, содержащей E.Cori М-17, представлена на фиг. 42. Хроматограмма смеси двух микроорганизмов представлена на фиг. 43. Результаты хроматографического анализа подтверждаются микроскопиI ческими исследованиями фракций элюата.
Элюат собирают с помощью коллектора фракций.
11 10193
/ попняет роль неподвижной фазы. Анализи . руемую смесь микроорганизмов Е.Сой
HB-101 (концентрация 1,4 10 клlмл) и
Е.Cob 329 (концентрация 1,4 10 0 кл/мл) вносят в колонку с поыощью шприца, Объ- ем вносимой пробы 15 мл. Окрашивание и регистрацию окрашенных микроорганизмов проводят по примеру 1. Анализируемую смесь микроорганизмов разделяют за
l5. мин. Хроматограмма пробы содержа- . IO щей Е.Cori НВ-101, представлена на фиг. 44. Хроматограмма пробы, содержв° ° ° ° ° щей Е.Соб 329, представлена на фиг.45. роматогрвмма смеси двух микроорганиз мов представлена на фиг, 46.. Реэульта- IS ты хроматогрвфического анализа подтверждаются микроскопическими исследовани+ ями фракций элюата. Зпювт собирают с помощью коллектора фракций.
Пример 16. Анализ двух микро- 26 организмов E.Co6 ММ-383, Е.Cob
F678 54, выполненный на капиллярной колонке, в качестве полимера берут ПЯ-
6000, в качестве соли Кн F04..
Берут стеклянную квциллярную колон- И ку 8= 20 м с внутренним диаметром
О 3 мм. На внутреннюю поверхность капилляра наносят силикон УО-101. В качестве элюеитв используют водный раствор, состоящий из 15% ПЭГ-6000, 15% щ
КН РО,, 0,1% КаСР, рН=7. Обрвзоввешиеся две фазы подают в колонку со скоростью 0,4 мл/мин с помощью жидкостного насоса. Фаза, обогащев ая ПЭГ6000; обладает cponcTsoM к поверхно"= ти капилляра, покрытой силиконом ОУ101, и выполняет роль неподвижной фазы, Анализируемую смесь микроорганизмов
E.Cîá ИМ- 383 (концентрация 1,0 к 10" кл/мл) и Е.Соб Р678-54 (кон-центрация 1,0-10" клlмл) вносят в колонку с т омошью шприца, ооъем вносимой пробы 15 мкл. Окрашизание и регистрацию окрашенных микроорганизмов про,водят по примеру 1. Анализируемую смесь микроорганизмов разделяют за 20 мин.
Хроматограмма пробы, содержащей Е.Соб
ММ-ЗBЗ, представлена на фиг. 47. Хроматограмма пробы, содержащей Е.СЖ
Р678-54, представлена на фиг. 48. Хроматограмма смеси микроорганизмов пред-.
56 ставлена иа фиг. 49. Результаты хроматографического анализа подтверждаются микроскопическими исследованиями фракций элювтв. Элювт собирают с помощью коллектора фракций, Пример 17. Анализ четырех штамм ов E.Co& ММ-.ЗBЗ, E.Cod Р678-
54, Е.Cori 329, E.Ñoá НВ-101; выпол28, 12 пенный на капиллярной колонке, s качестве полимера используют ПЭГ-6000, в качестве сопи КН<РО4.
Берут стеклянную капиллярную колон,ку 3 20 м с внутренним диаметром
О, 3 мм. На внутреннюю поверхность капилляра наносят силикон ОУ-101, В качестве злюента используют водный раствор, состоящий из 10% ПЭГ-6000, 15% КИ Р04
0,.1% 8aCF, рН=7. Образовавшиеся две
1 фазы подают в. колонку со скоростью
0,4 мл/мии с помощью жидкостного насоса. Фаза, обогащенная ПЭГ-6000, обладает сродством к поверхности капилляра, покрытой.силиконом ОУ-101, и выполняй ет- роль неподвижной фазы. Анализируемую смесь микроорганизмов E.Соб ММ -383, Е.СоВ Р678-54, E.Соб 329, Е.Cori НВ-101 (концентрация каждого микроорганизма 1,0 ° 101 кл/мл), вносят в колонку с помощью шприца, объем вносимой пробы 15 мл. Окрвшиввние и регистрацию окрашенных микроорганизмов проводят но примеру 1. Анализируемую смесь микроорганизмов разделяют за
20 мин. Хроматогрвмма пробы, содержа-. щей Е.Cob ММ;383, представпенв нв фиг. 50, Хроматограммв пробы, содержащей Е.Cob Р678-54, представлена на фиг. 51. Хроматограмма пробы, содержащей Е.СоЬ 329, представлена на фиг.53.
Хроматограмма пробы, содержащей Е.СоД
Н8-1О1, представлена на фиг. 52. ХроФ матограммв смеси микроорганизмов прей. ставлена на фиг. 54. Результаты хрома. тогрвфического анализа подтверждаются микроскопическими исследованиями фрак ций элювта. Эцюат собирают с помощью коллектора фракций.
Пример 18. Анализ двух штам os Е.сои НВ-101, E.ñoé j 53, sb полненный на колонке с сорбентом, в качестве полимера берут ПЭГ-6000, в качестве соли (Й1$ )<$04.
Берут стекпянную колонку ((=150 мм, д = С мм}, заполняют пористыми стеклянными шариками с с) = 0,04-0,08 мм и лорами д = 186 А. В качестве злюентв используют водный раствор, состоя» ший из 10% ПЭГ-6000, 15% сульфата аммония (HQQS04, рН 1. Образовавшиеся две фвэы, постоянно перемешивая, подают в колонку со скоростью 1,2 мл/мин.
Фаза, обогащенная (NH<)<904, обладает срщством к сорбенту и выполняет роль неподвижной фазы. Анализируемую смесь микроорганизмов F.Cob НВ-101 и F.СоЬ ) 53 (концентрация микроорганизмов
1,0 10" - кл/мл) вводят в колонку с поремЯ
0 Х 10 15 Рд 25 30 ф И® 0 Х 10 15 20
ИиН
Фиг.я Фиг.3
elf Jjrp 9 fling
РЕ ЧЯ, Мин
4 6 8 10 12 М 16 1
4)иг. 5
1З 1019328 14 мощью .шприца, объем вносимой пробы Таким образом, использование предла100 мл. Окрашивание и регистрацию окра- гаемого способа по сравнению с известшенных микроорганизмов проводят по при- ным обеспечивает следуюшие преимумеру 1, Смесь микрооргайизмов разделя- шества: ют за 20.мин. Хроматограмма пробы, $ сокращение времени анализа за счет содержащей Е.Соб HB-101, представле увеличения скорости потока и упрощения на на фиг. 55. Хроматограмма пробы, со анализа до одного цикла; держащей E.Cob ) 53, представлена на анализ широкого спектра биологичесфиг. 5G. Хроматограммы смеси двух мик- кнх веществ и микроорганизмов - аминороорганизмов представлены на фиг. 57-60)0 кислоты, белки, антибиотики и клетки без изменения экспериментальных условий
Результаты хроматографического ана- (состава элюента, сорбента, скорости по. лиза подтверждаются микроскопическими тока элюента, рН и т. д.); исследованиями фракций элюата. Злю- сохранение нативных свойств биологиат собирают с помошью коллектора 3$ ческого материала за слет сокрашения фракций. времени анализа (с 20-90 до 1 ч).
10 19328 ум,миЮ у 5ранЦ нии
t У 3 4 5 Ю 7
Фиг.д
Я у Х б 1 Ю 9 8pt4tRьI 4/4
49ий. 9
1019328
ФО
1019328 ме,юим
gus. Ю
Фиф. я
Вреицнин.
Время ия кя, мин
1 1 5 4 5 6
Фиг. И у 3 4 Ю
Фий. 1У ею.
It ll(еия,нин Фиг. 21 емя,erw
Фи8. 2,?
10l9328
4, 1 б 7
Фиг. 20
У 10 Время,мин дрели,мин
101S328 фиг. ХУ!
01ОЗ26
10-19828 gy„prvs
Фиг. И феня,мин
0 7 у Я 4 Х Ф 7 Р ф аа няя, иим
4tgrp.JF
0 1 1 3 Ф S 6 У
Фиг.J6
РМ> мин.
1019328
1 б 1 д У 1О 11 11 13 1Ч ВРЕиЯ.мин
Фиг. Ю
0 1 6 7 8 9 10 11 12 13 И РемЯ,мин
Фиг. N
0 1 6 7 8 9 rO u a V Ю Время,мин
Фиг.40 оыз2е реня, нин. ремя,юж
1 Я У 4 5 б 7 8 9 10 11 М 73
Фиг.44
1 2 3 4 5 б У
Фи2.41
1 2 3 O Х д
Фиг. М ена, МаЮ ачУ, МиЙ 1019328 бремя, мин имя,мин
Фиг. 47
1019328 имя,иик.
1д 12 f
Фиг.4У мя,rrcie
put- SO уИлаВ,МФа
1019328
Фиг.57
10 19328 у ррур, сии
1 2 5 4 Х b 7 8 У 10 11 12 15.брЕИЯ,иин (фиг. ХУ ума, ниИ
Фиг.60
Составитель С. Каспаров
Редактор A. Шишкина Техред Д.Aи Корректор Е. Рошко
Закаэ 3693/38 Тираж 873 Подписное
ВНКИПИ Государственного комитета СССР по делам иэобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент, r. Ужгород, ул. Проектная, 4