Способ определения с-концевых аминокислот в пептидах
Иллюстрации
Показать всеРеферат
1. СПОСОБ ОПРЕДЕЛЕНИЯ С-КОНЦЕВЫХ АМИНОКИСЛОТ В ПЕПТИДАХ путем расщепления пептидных связей с последующим определением аминокислотного состава пептида, от ли ч а ющ ИИ с я тем, что, с целью одновременного определения деухС-концевых аминокислот, включая аминокислоты с замещенной С-концевой карбок- , сильной группой, к пептиду добавляют диенофилы в присутствии водоотнимающего агента, затем полученное производное гидролизуют, сопоставляют исходный аминокислотный состав пептида и полученного производного и по степени уменьшения соде|Якания аминокислот в производном пептида определяют их С-концевое полшсение. 2.Способ по п.1, о т я и ч а ю- . щ и и с я тем, что в качестве диенофилов используют производные малеиновой или фумаровой кислот. 3.Способ по п.1, о т л и ч а ю , щ и и с я тем, что в качестве врдоотнимающего агента используют ангидриды кислот.
СС10З СОВЕТСНИХ
Nu
РЕСПУБЛИК
Цю <111 ????) g 01 ii 3>
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
ГОСУД@ СтвЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) .3341665/28-13 (22) 14. 07. 81 (46) 23. 65. 83. Бюл. и 19 (72) Л.Ю.Скляров, Н.А.Копина, А.В.Евстратов и И.И.,Титов (71)Всесоюзный кардиологический научный центр АИН СССР (53) 547.96(O88,8) (56) 1. АшЬ1er R.P. Enzymic hydro.lysis with Carboxyjeptidases. Neth.
Enzym., 1967, т. II, р.. 155-166.
2. Min С., Fraenkel-Conrat Н.
Determination of termIriaI amInoacids
by.hydrazino1ysis. Am, Ch. Soc., 1955, т. 77, р.5882-83 (прототип), (54)(57) 1. СПОСОБ ОПРЕДГЛКНИЯ С-КОНЦЕВЫХ АИИНОКИСПОТ В ПЕПТИДАХ путем расщепления пептидных связей с последующим определением аминокислотного состава пептида, о т л и ч а ющ и и с к тем, что, с целью одновременного определения двух С-конце" вых аминокислот, включая аминокисготы с замещенной С-концевой карбок-, сильной группой, к пептиду добавляют диенофилы в присутствии водоотнимающего агента, затем полученное производное гидролизуют, сопоставляют исходный аминокислотный состав пеп тида и полученного производного и по степени уменьшения содержания аминокислот B производном пептида определяют их С- концевое положение.
2. Способ по n. I, о т л и ч а ю- . шийся тем, что в качестве диенофилов используют производные малеиновой или фумаровой кислот.
3. Способ по п.l о т л и ч а юшийся тем, что в качестве водоотнимающего агента используют ангидриды кислот.
1О 19336
Изобретение относится к химии, в частности к установлению структуры пептидов.
Известен способ определения С-концевых аминокислот с помощью ферментов, например карбоксипептидазы <1)
Однако этот метод непригоден для определения С-концевых аминокислот в пептидах с устойчивой пептидной
10 связью, например пролилпептидов. Кроме того, карбоксипептидаза не способна отщеплять С-концевые амиды, например глициламид.
Известен также способ определения
С-концевых аминокислот в пептидах
15 путем расщепления пептидных связей с последующим определением аминокислотного состава пептида. Это достигается с помощьЮ гидразинолиза Р 2).
Недостатком этого метода является невозможность определения С-концевой аминокислоты, если она находится в форме амида. Кроме того, способ позволяет определять только одну С-концевую аминогруппу.
Целью изобретения является одновременное определение двух С-концевых аминокислот, включая аминокислоты с эамещенной С-концевой карбоксиль- З0 ной группой.
Поставленная цель достигается тем, что согласно способу определения
С-концевых аминокислот в пептидах путем расщепления пептидных связей З5 с последующим определением аминокислотного состава пептида, к пептиду добавляют диенофилы в присутствии водоотнимающего агента, затем полученное производное гидролизуют, со- 40 поставляют исходный аминокислотный состав пептида и полученного производного и по степени уменьшения содержания аминокислот в производном пептида определяют их С-концевое . 45 положение.
Кроме того, в качестве диенофилов используют производные малеиновой или фумаровой кислот. 8 качестве водоотнимающего агента используют ангидриды кислот.
Способ осуществляют следующим образом.
Пептид подвергают взаимодействию с диенофилами, в качестве которых используют производные фумаровой или малеиновой кислот < нитрилы, ангидриды ) в присутствии водоотнимающих агентов-ангидридов кислот. Реакционную смесь гидролизуют кислотами или щелочами. При этом расщепляются все пептидные связи, кроме необратимо модифицированных, входящих в состав гетероцикла
IIq н Ц (ин )НО A.4 NH<-С-COoH+NH --С -coOH+...
"ь а „4 Си-йи, I
Rg где R R - радикалы аминокислотных
У остатков на С-конце пептида;
R, R4 +заместители диенофилов.
Две концевые аминокислоты входят в состав образующегося устойчивого к гидролизу гетероциклического соединения. При этом вследствие прохождения реакции С-ацилирования промежуточно образующегося оксаэального производного пептида, необратимой модификации в большей степени подвергается С-концевой остаток. Реакционную смесь после гидролиза упаривают и определяют аминокислотный состав на анализаторе: Вследствие необратимой модификации двух С-концевых аминокислотых остатков, содержание их в гидролиэате уменьшается, что отражается на аминокислотном составе.
Гидролиз исходного пептида позволяет получить его аминокислотный состав. По сопоставлению исходного аминокислотного состава пептида и по лученного, судят о С-концевых аминокислотах.
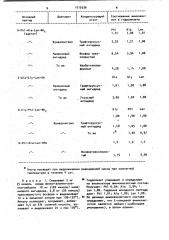
Аминокислотный анализ гидролизатов проводят на приборе "Лаботрон" (фРГ). Данные, подтверждающие воспро изводимость способа, приведены в таблице.
1019336
Соотношение аминокислот в гидролизате
Конденсирующий агент
Дне нофил
Исходный пептид
Н-Phl Аl а-7 еп-МН а. (ацетат) Ala Len
1,00 1,01
Phl l, 01
Фумаронитрил Трифторуксусный ангидрид
3,25 1,21 1,00
« I I»
Иалеиновый ангидрид
Фосфор треххлористый
6,54 3,94 1,00
«1l
То же
«It
Изобутилхлорформиат
lIi4 l,00
4,28
Z-Ala«Gly-Len-OH
Gly Len
1,08
А7а
Трифторуксус" ный ангидрид
Иалеиновый ангидрид
1,61
11»
3,65 1,02 1,00
Уксусный ангидрид
11»
То же
Н-С1у-Phl еп-ЙН„
Ph1 eп
1,00 1;00
1,00.Фумаронитрил Трифторуксусный ангидрид
1,48
1,05 1,00
1,02 0,97
То же
«11»
Н-Phl-Ala«Len-ONe.
1,0.
Фосфорт реххлористый
0,94
1,15
Опыты проводят при выдерживании реакционной массы при комнатной температуре в течение 4 сут.
Пример 1. Смешивают 2 мг
{5 мкмоль амида фенил-алайил-аланил"лейцина 10 мг (100 мкмоль1 малеинового ангидрида, 2,8 мг (20 мкмоль) треххлористого фосфора и выдерживают
12 ч в эапаяной ампуле при 100-l20oÑ.
Ампулу охлаждают, вскрывают, добавляют 0,5 мл 6711 соляной кислоты, запаивают и выдерживают 24 ч при 105 С.
$0 Тидролизат упаривают и определяют на анализаторе аминакислотный состав.
Получают: Phl 6,54; Ala 3,94;
Len 1,00. Гидролиз исходного пептида дает: РЫ 1,01; Ala 1,00; Len 1,00.
>> Ao разнице аминокислотного состава определяют, что С-концевой аминокислотой является лейцин (наибольшее уменьшение, а затем аланин.
1019336
Метод может быть использован в случае определения С-концевых амидов и эфиров пептидов, поскольку установление С-концевой аминокислоты из вестными методами затруднено. Кроме того, предложенный метод позволяет определять два концевых аминокислот . ных остатка, что важно при установлении структуры пептидов, поскольку сокращает время и упрощает процедуру определения аминокислотной последовательности.
Способ достаточно прост, исходные .реагенты доступны, аминокислотные анализаторы, необходимые для определения количества аминокислот выпускаются отечественной промышленностью.
Составитель Е.йитникова
Редактор А.йишкина Техред А.Бабинец
Корректор Е. Рошко
Заказ 3693/38 Тираж 873 . Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж"35, Раушская наб., д. 4/5 ч
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4