Способ определения протеолитической активности ферментного препарата
Иллюстрации
Показать всеРеферат
1. СПОСОБ ОПРЕДЕЛЕНИЯ П ОТЕрЛИТИЧЕСКОЙ АКТИВНОСТИ ФЕРМЕНТНОГО ПРЕПАРАТА, включающий инкубирование пробы с субстратом, добавление в инкубационную смесь 2,4 ,.6-тринитробензолсульфокислоты с последующим спектрофотсметрированием реакционной смеси, отличающийся тем, что, с целью повышения чувствительности способа, в реакционную смесь перед спектрофотометрированием вводят реагент, связывающий сульфит-ионы. 2. Способ ПОП.1, отлича ю-, ц и и с я тем, что в качестве реагента , связывающего сульфит-ионы, . используют фосахальдегид, метилвинилкетон или акрилнитрил в концентра- Щ цйи 0,3-0,6 М.1л ;
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК у(Я) С 01 N 33/48
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) .3375107/28-13 (22) 21.12.81 (46) 07.07.83. Бюл. Р 25 (72) Г .й.Денис, З.IÎ.Ионушене, E. Е. Уарпавичюс и Ю.Ю.Степонавичюс (71) Еаесоюзный научно-исследовательский институт прикладной энзимологии (53) 543.866(088..8) (56) 1. авторское свидетельство СССР
9 397843, кл. G 01 31/ 14, 1973.
2. Juan Lin, QaryE. Меапз., RobertE.
Fteney, Jhe action of ЕгайеойуМсепгувез on N imethyf proteins, У.В1оС., Chem, 2, з 4, 1969, р.789793.
„.SU„„1027141 А (54) (57) 1. СПОСОБ ОПРЕДЕЛЕНИЯ ЩОТЕОЛИТИЧЕСКОИ АКТИВНОСТИ ФЕРМЕНТНОГО .
ПРЕПАРАТА, включающий инкубирование пробы с субстратом, добавление в инкубационную смесь 2,4,6-тринитробензолсульфокислоты с последующим спектрофотометрированием реакционной смеси, отличающийся тем, что, с целью повышения чувствительности способа, в реакционную смесь перед спектрофотометрированием вводят реагент, связывающий сульфит-ионы.
2. Способ по п.1, о т л и ч а ю-, . шийся тем, что в качестве реагента, связывающего сульфит-ионы, используют формальдегид, метилвинилкетон: или акрилнитрил в концентра- щ
Ф
Ии 0,3-0,6 М.
1027141
Изобретение относится к биохимии.,, в частности к способам определения активности ферментов.
Известен способ определения протеолитической активности, в котором в гидролизат белкового субстрата, полученный при рН 8,5 и 40 С, добавляют трихлоруксусную кислоту и определяют количество неосаженных мелких пепти-.. дов спектрофотометрированием при помощи реактива Фолина Г11. 10
Недостаток этого метода заключается в том, что он позволяет работать только в узком интервале оптической плотности (0,15-0,35) и дает сравнительно низкую точность опре- 15 деления протеолнтической активности (коэффициент вариации составляет 59,).
Кроме того, протеолитическая активность .по этому методу выражается в относительных единицах, а желательно определять протеолитическую активность в абсолютных единицах, указывающих количество разорванных ферментом пептидных связей, .Наиболее близким к изобретению по .технической сущности и достигаемому эффекту является способ определения протеолитической активности, включающий инкубирование раствора ,фермента с субстратом, введение в инкубационную смесь буфера с рН 9,3, обработку полученного гидролизата
2,4,6-тринитробензолсульфокислотой с последующим его спектрометрированием ). 21.
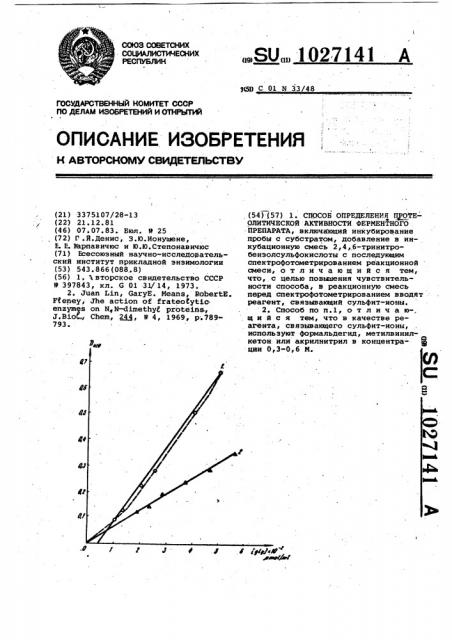
Недостатком известного способа 35 является его невысокая точность. Систематическим ошибкам и увеличению разброса результатов измерений способствуют образующиеся в реакции. сульфит-ионы. Они дают окрашенные . Щ комплексы с тринитробензолсульфо" кислотой (Х ц =470 нм) и с продуктами 1 ($ù, = 410 нму 500 нм). Поэтому измеряют не поглощение продукта, а суммарное поглощение ряда соединений. Вследствие комплексаобразования калибровочный график не является прямолинейным. При проведении прямой методом наименьших квадратов она не идет через начало координат (Фиг.l). Сульфит-ионы легко окисляются кислородом, растворенным в.реакционной смеси. Скорость окисления зависит от таких случайных факторов, как содержание кислорода в пробах, интенсивность перемешивания. Это приводит к колебаниям концентрации сульфит-ионов и, тем самьм, измеряемой оптической плотности.
Цель изобретения — повышение чувствительности способа. 60
Поставленная цель достигается,тем, что согласно способу определения протеолитической активности ферментного препарата, включающему инкубирование пробы с субстратом, добавле- Я
"ние в инкубационную смесь 2,4,6-тринитробензолсульфокислоты с последующим спектрофотометрированием реакционной смеси, в реакционную смесь перед спектрофотометрированием вводят реагент, связывающий сульфитионы.
При этом в качестве реагента, связывающего сульфит-ионы, используют формальдегид, метилвинилкетон или акрилнитрил в концентрации 0,30 6 N.
Сущность способа заключается в том, что в качестве субстрата могут быть использованы любые белки или пептиды, расщепляемые данным протеолитическим ферментом. Предпочтительно, чтобы свободные аминогруппы субстратов были блокированы (например, как в NqN-диметилказеине). В этом случае контрольные пробы имеют низкую оптическую. плотность, что повышает точность определения протеолитической активности.
Для проведения определения протеолитической активности исследуемый раствор фермента инкубируют с субстратом. В инкубационную смесь добавляют буфер рН=9,3, раствор
2,4,6-тринитробензолсульфокислоты, термостатируют при 30 С в течение
30 мин, добавляют формалин до кон-,. центрации Формальдегида 0,3-0,6 М, взбалтывают и спектрофотометрируют при 420 нм.
Способ проверяют на следующих ферментных препаратах: щелочночной протеазе из Вас.subt181s, химотрипсине, протосубтилине ГЗх.
Пример 1. Определение активности нейтральной протеазы в протосубтилине ГЗх.
В универсальном буфере рН=7,2 готовят 0,75%-ный раствор белкового субстрата. Концентрация ферментного препарата в универсальном буфере рН=7,2 0,25 мг/мл. В две пробирки наливают по 1 мл 0,75%.-ного раствора субстрата, термостатируют при 30 С в течение 5 мин. В одну пробирку приливают 1 мл ферментного раство- ра, в другую — 1 мл инактивированного кипячением ферментного раствора (контроль.) и инкубируют 10 мин при 30 С, после чего выдерживают обе пробирки в кипящей водяной бане
2 мин. В пробирки приливают по
10 мл буфера рН=9;3 и по 1 мл
О, 7%-ного раствора 2,4,6-тринитробенэолсульфокислоты.в дистиллированной воде, взбалтывают и выдерживают при
30 С в течение 30 мин, после чего добавляют по 1 мл 6М раствора Формалина, опять взбалтывают и определяют оптическую плотность раствора на спектрофотометре при 420 нм против контрольной пробы (с инактивирован1027141
Коэффициент вариации,.
Ч -. 100
ПА (%) Способ определения QA
Среднее значение . протиолитической активности, ед/r
Число определений
Дисперсия, я2
Серия
Предлагаемый
2,30
58, 73
44,86
332,8 .
1,91
353, 6
1,57
343,6 "
353,6
Пример 1.28,55
10
1»71
35,8
1,32
0i, l 3
Пример 2
10
0,46
2,37
28»5
0,17
1,49
27,8
l0 нъм ферментом). Средняя оптическая плотность 0,368.
Калибровочный график получают тем же путем, только вместо инкубационной смеси фермента с субстратом берут растворы глицина известной концентрации.
Протеолитическую активность (GA) вычисляют по формуле
Д 14
r3 l0 M 1000» где Д -- оптическая плотность раствора
14 - объем реакционной смеси, ГЭ - глициновый эквивалент, определяемый по калибровочной кривой (оптическая плотность, соответствующая 1 мИ глицеина, фиг.l) у
М - количество ферментного препарата, взятого на протеализ, мг;
1000 - переводный коэффициент по« лученных единиц на .1 мг . ферментного препарата.
3а единицу актизности принимается такое количество фермента, которое за 1 мин при 30 С образует 1 мкмоль. . свободных аминогрупп.
Пример 2. Определение актив- З0 ности щелочной протеазы из Bacif8us зрЬйИ is.
«««» «« й» 4««««
В универсальном буфере pH=10,5 готовят раствор белкового субстрата концентрации 0,753. Концентрация ферментного препарата в том же бу.фере рН=10,5 равна 2,0 мг/мл. В две пробирки наливают по 1 мл раствора субстрата, термостатируют при 30 С в течение 5 мин, В одну пробирку приливают 1 мл ферментного раствора, в другую 1 мл инактивированного кипя чением ферментного раствора и инкубируют 10 мин-при 30 С, после чего выдерживают .обе пробирки в кипящей водяной бане 2 мин. В пробирки приливают по 10 мл 0,7%-ного раствора
2,4,6-тринитробензолсульфокислоты, взбалтывают и выдерживают при ЗО C в течение 30 мин, после чего добавляют по 1 мл ЗОВ-ного (4,3 И) раствора метилвинилкетона;опять взбалты-. вают и определяют оптическую плотность при 420 нм. Средняя оптическая плотность 0,415.
Протеолитическая активность.ðàñ,считанная по формуле, приведенной в примере 1, равна, 46,9 ед/г.
В таблице представлена статистическая обработка результатов сравнения точности предлагаемого спосо ба с известным (на примере определе:ния прохеолитической активности про« тосубтилина Р3х).
1027141
Продолжение таблицы
Известный
1,80
4,24
2,72
4,69
46,2
4,68
4,38 3, 84
44,7
)О
45,5
2,11
3i)8
Ф точность определения в 2 раза, что дает возможность, в свою очередь повысить точность стандартизации окрашенных субстратов для определения протеолитической активности и точность измерения активности ферментных препаратов в абсолютных единицах.
Составитель С .Каспаров
Техред A.Áàáèéåö Корректор А.Ильин
Редактор О.Бугир
Ю»»
Заказ 4661/24 Тираж 471 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, 3t-35, Раушская наб., д. 4/5
Филиал ППП Патент ., г. Ужгород, ул. Проектная, 4
Средний коэффициент вариации ч по примеру 1 равен 1,92%, по примеру
2 - 1,72%, а по методике известного р5 способа - 3,5%.. Из этого следует, что точность предлагаемого способа выше примерно в 2 раза.
Таким образом, предлагаеыый способ по сравнению с известным повышает
469,6
452.,1
529,4
146, 01
798,21
451,33