Способ кулонометрического определения иридия
Иллюстрации
Показать всеРеферат
. СОЮЗ СОВЕТСКИХ . OUNll
РЕСПУБЛИК (!Е (1II
p(g) 6 01 N 27/42
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3375504/18-25 (22) 08, 10. 81 (46) 30.0 8. 83. Бюл. Р 32 (72) Ф. И. Данилова, И. A. Федотова, Г. Ф. Мустафина и T. Г. Андреева (71) Сибирский государственный научно-исследовательский и IlpoBKTHHA институт цветной металлургии (53) 543.257(088.8) (56) 1. Harrar J. Е., Shain A. Experiments as controlled patential.
Analytical Che@iitry, 1966, t 8, р.. 1148.
2 ° Vallon J. W., Раде J. Kulonometric delerfI1inat ion of rod ium and
iriduum in, concentrates., vol. 43
9 4, р. 602-603, 1071 (прототип) . (54) (57) . СПОСОБ КУЛОНОМЕТРИЧЕСКОГО
ОПРЕДЕЛЕНИЯ ИРИДИЯ (11,1) путем восстановления при контролируемом потенциале, заключакщийся в предварительном окислении перекисью водорода в присутствии соляной кислоты с последукщим электродоокислением при величине потенциала +1,00+0,01 Б иридия в иридий (1Ч) на платиновом электроде, отличающий с я тем, что, с целью повышения точности определения иридия в присутствии рутения и железа (111) растворы перед окислением иридия в иридий (IV) обрабатывают смесью соляной и азотной кислот, взятых в соотнсваении.1;1, а определение иридия (111) проводят в присутствии 5М фосфорной кислоты в области потенциалов платинового электрода +О .488-0,492 B относительно насыщенного хлорсеребряногоэлектрода.
38870.
Элемент Содержание
О, 1-0,6
2,0-2,6
Pb
Си
Рс О, 1-2,0
Pd 0,5-5,0
И1 10,0
0,2-2,00
11 0-30,О
4i0
C r.
3,0-5,0
0,5-3t0
0,2-0,3
0 5
1,0
0i02»»0t 3 ю
5п
5b
1, 0- 3, 0
10,0
3,0-10,0
0,3
О,О
0,02
Ag
510, Изобретение относится к аналитической химии и может быть использовано при анализе проььпаленных продуктов, содеражщих платиновые металлы.
Йзвестен также способ кулонометрического определения иридия в потенциостатическом режиме в окрестности потенциала платинового катода
+О 40 В (относительно насыщенного каломельного электрода) в синтетических растворах, содержащих миллиграммовые количества двух элементовиридия и палладия в двухкомпонентных системах (1) .
Этот способ также применим для анапиза растворов, не содержащих примеси цветных металлов и других металлов группы платины и золота.
Недостатком способа является то, что процесс подготовки проб к анализу длителен, так как иридий переводится в четырехвалентное состояние хлорированием (процесс хлорирования длится 30-40 мнн) °
Наиболее близким к предлагаемому является способ кулонометрического определения иридия путем восстановления при контролируемом потенциале, заключакщийся в предварительном окис ленин перекисью водорода в присутствии соляной кислоты с последукхцим электроокислением при +1,00+0,01В иридия (111) в присутствии иридия (i V) на платиновом электроде 2 .
Недостатком данного способа является то, что определение иридия
1 ведется в присутствии только родик после отделения от цветных и остальных платиновых металлов.
Требуется проведение дополнительных операций для переведения иридия в хлор-форму после дистилляции рутения и осмия иэ сульфатных растворов, что увеличивает длительность анализа! и понижает точность определения.!
Цель изобретения — повышение точности определения больших содержащий иридия в присутствии рутения и железа (1! 1) ..
Поставленная цель достигается тем, что,в кулонометрическом способе определения иридия путем восстановления при контролируемом потенциале, заключакщейся в предварительном окислении иридия до иридия (IV) перекисью водорода в присутствии соляной кислоты с последующим электродоокислением при величине на платиновом электроде потенциала +1,00+0,01B раство-, ры перед окислением иридия в иридий 5 (1Н) обрабатывают смесью соляной и азотной кислот, взятых в соотнсиаениях 1:1, а определение иридия,,(III) проводят в присутствии 5М фосфорной кислоты в области потенциалов плати-. новОго электрода +0,488-0,492 В от .носительно насыщенного хлорсеребрянового электрода.
Предварительную обработку раствоpos проводят смесью соляной и азот25 ной кислот (1 1), Определение иридия выполнябтся предпочтительно при потенциале
+0,492В относительно нормального каломельного электрода.
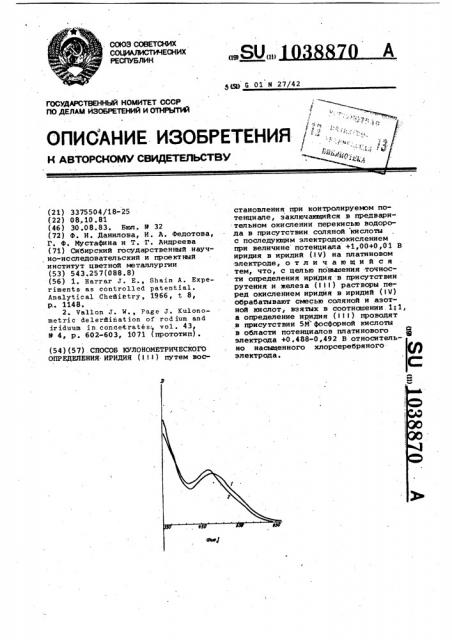
На фиг. 1 представлены электронные спектры поглощения рутения беэ обработки (кривая 1) и после обработки (кривая 2), на фиг. 2 - вольтамперные кривые соединений рутения, .представленных до обработки смесью
З5 кислот (кривая 3) и после обработки (кривая. 4); на фиг. 3 - вольтамперные кривые соединений ирйдия.
Способ осуществляется следующим образом.
4() Растворы, приготовленные из.про мжшенного концентрата состава, обрабатывают при нагревании смесью соляной и азотной кислот (1:1) °
В табл. 1 представлен состав ана. лизируемого концентрата. !
Таблица 1
Ъ Элеме нт Содержание, Ф, ф
10 38870
Потенциал
Среднее содержание, хЭ
Пробы
0,014
0,188
13,22
12,66
12, 19
+0,484
+0,486
+0,488
Проба НГМК ириди-. евого концентрата, август, 19 79
0,123 0,010
О, 164 0,013
0,317
0,181
0,315
0 i 314. +0,490
+О, 492
0,026
0,014
12,21
12,41
0,026
0,017
12, 12
18, 12
0,494
0,488
Проба НГМК ириди евого концентрата, ноябрь
0,018
0,328
18,11 .
О., 490
0iO13
0,025
0,235
0,445
18,12
18i00
0,492
0,494
При такой обработке рутений переходит в нитрозохлрридный комплекс
).11> НОС! ) (фиг. 1, кривая 2), волт-, амперная кривая этoro соединения (фиг. 1, кривая, 1) и соединения, полученного. аналогичной обработкой и окв1сленйого перекисью водорода в
, присутствии соляной кислоты (фиг. 2, кривая 4) сдвинута в более отрицательную область на 0,2В по отношению к волне восстановления иридия, что не мешает определению иридия в области потенциалов +0,488-0,492 В при их совместном присутствии, затем проводят предварительное окисление ,иридия Ill до иридия IV перекисью водорода в присутствии соляной кислоты при нагревании и последукицем кипячении раствора для удаления из° битка хлора и разложения избытка перекиси водорода.
Злектроокисление выполняют в электрохимической ячейке на платиновом электроде при потенциале +1,00
0,01 В до низкого остаточного тока (20-40 мкА)..
Из других элементов, присутствукщих в пробе, наибольшее влияние на кулонометрическое определение иридия оказывает Fe (111). Мешакщее влияние ионов железа устраняют введением в анализируемый раствор 3-4 мп фосфорной кислоты (5М) непосредственно иридия при их совместном Присутствии
В области 0,4-0,6 В в среде 0,2 н
HC l волна восстановления иридия имеет четко выраженную область диффузионного тока (фиг. 3, кривая 5).
Наиболвшее влияние из благородных металлов в этом диапазоне потенциалов оказывает рутений, присутству--кщий в виде смеси комплексных хпоридов. Однако нитроэохлоридный комплекс рутения в диапазоне потенциалов 0,48-0,52 В не обладает окислительно-восстановительными свойстваьк, о чем говорит низкий остаточный ток (фиг. 3, кривая 6) . Следовательно, при переведении его в нитрозохлоридный комппекс у стр аня ется влияние ру тения при электролизе, что позволяет определять иридий в присутствии рутения. !
О . В той же области потенциалов (0 4-0,6 В) на определение иридия оказывает влияние и железо (III) °
Добавлением фосфорной кислоты железо (!11) связывается в прочный комплекс, )5 равновесный потенциал сдвигается в область 0,490-0,492 В, т.е ° в этом диапазоне потенциала отсутствует окислительно-восстановительный процесс (фиг. 3, кривая 7)." Это позволяет снизить до минимума влияние железа (111) (табл. 2) .
Исходя из няшесказанного, для кулонометрического определения иридия в присутствии рутения, железа и других элементов выбран диапазон потенциалов 0,484-0,496 В, при котором устраняется нх мешакщее влияние.
Табл. 3 подтверждает правильность выбора диапазона потенциалов,.
Присутствующие в пробе РЬ, С 1 NI
З0,и другие элементы в области потенци апов +0,488+0,492 В практически не оказывают влияния на определение иридия-, так как дают незначительный
: ток.
ЗЭ, Непосредственно определение иридия восстановлением при контролируемом потенциале проводят в электрохим ческой ячейке в области потенци алов +О, 4 88-0, 492 B ..
В табл . 2 представлена зависимость определения иридия от величины потенциала рабочего электрода при
6.
Таблица 2
Среднее Относитель квадратич- ное отклоное откло- нение нение,,5 5
10 38870 Сравнительные данные по определению содержания иридия в промпапен10 ных концентратах в присутствии рутения предлагаемым способом и известным приведены в табл. 3.
Таблиц,а 3
Способ определения
n x%
24 11, 33 0,248 0,022 11, 33+0 10
28 1156 0388 0034 1156+015
Пр едл агае ьый
Из нестный
Конечная концентрация иридия определяется расчетным методом Мак
Невина-Беккера и Мейтса.
Пример. Опыты проводят в лабораторных условиях на синтетических растворах и проьыапенных концентратах, содержащих платиновые н цветные металлы, количества которых указаны в табл ° 1.
Навеску пробы промышленного кон центрата массой 0,5 г сппавляют с З5 пятикратным количеством перекиси натрия при 700 С в течение 30 ьын.
После охпаждения сплав выщелачивают смесью соляной и азотной кислот (3:1), упаривают до объема 40-50 см, переводят 6Н соляной кислотой в колбу вместимостью 100 мп. Для опрЕделения иридия отбирают апиквотную часть (содержащую 1,5-5 мг иридия) в стакан емкостью 50 см,.обрабатывают 20-25 см смесью соляной и 45 азотной кислот (1: 1) под крышкой при нагревании в течение 40-60 мин, упаривают на водяной бане до влажных солей, приливают 4-5 см HCI 6Н (дпя получения в электрохимической 50 ячейке кислотности по НС1 0,2-0,4Н).
В электролиэиой ячейке ЯСЭ»2 объем доводят водой до 75-80 см . Рабочим, электродом служит платиновая сетка, (4 = 31 мм, h = 33 мм). Вспомогатель- 55 ным электродом служит спираль иэ платиновой проволоки (6 = 0,3 ьэк, сС = 100 мм). Электрод сравйениянасыщенный хлорсеребряный. Отделения для вспомогательного электрода и 40 электрода сравнения заполняют 0,2Н соляной кислотой. Проводят электродоокисление анализируемого раствора для более полного переведения иридия
111 в иридий I×, при постоянном по25
У
К
ИЗ данных таблицы видно, что для достижения поставленной цели необходимо использовать область потенциалов 0,488-0,492 В> так как в этой области достигаются наиболее точные и воспроиэводиьые результаты, Величина среднего квадратичного отклонения показывает, что наиболее воспроизводиьые результаты получены при потенциале +0,492 В, в связи с чем предпочтительйо определение в этой области.
Таким образом операции по переведению рутения в нитроэохлоридный комплекс, устранение влияния железа и выбор определенной области потен-. циалов позволяют ускорить проведение анализа и улучшить точность результатов путем исключения операций по отделению цветных и благородных метаплов.. тенциале рабочего электрода +1,0 +
0,01 В, используя потенциостат
П-5827М, до остаточного тока 2040 мкА-. Затем потенциал рабочего электрода меняют на 0,492 В и проводят электролиэ раствора в присутствии 3-4 мп 5М фосфорной кислоты в течение 7-10 мин, регистрируя кривую ток - время на самописце ПДП-4.
Содержание иридия вычисляют по формуле, с учетом результата контрольного опыта, проведенного аналогично пробам, где Q - количество электричества, прошедшее на восстановление иридия IV, К;
1,9918 - электрохимюческий.эквивалент иридия, мг/к, М - масса навески пробы, г;
1000 - коэффициент перевода мгв г.
Количество электричества вычисляют по формуле где 14 - начальная ордината графика, 1911 относительно
К - тангенс угла наклона графика lglg относительно t, разделенная на 0,434 с- .
Предлагаеьый способ позволяет проводить определение иридия в промааленных концентратах и справах в присутствии рутения, который является основным мешакщим элементом1 а также в присутствии цветных и дру 8
10 38870 " гих платиновых металлов, причем точность определения выше и сроки выполнения анализа уменьшены за счет сокращения аналитических операций отделения цветных и благородных
ВНИИПИ Заказ 6223/52
Тираж 873 Подписное
Филиал ППП "Патент", г.ужгород,ул. Проектная,4 металлов (отгонка осмия и рутения из сульФатных сред, тиомочевинное осаждение благородйых металлов, растворение сульфидов благородных металлов) .