Состав мембраны ионоселективного электрода для определения активности перренат-ионов (его варианты)
Иллюстрации
Показать всеРеферат
1. Состав мембраны ионоселективного электрода для определения активности перренат-ионов, содержащий электродно-активное вещество на основе ионного ассоциата перренат-ионов с органическим катионом и органический растворитель, отличающийся тем, что, с целью повышения селективности и воспроизводимости , в качестве электродно-активного вещества использован ионный ассоциат перренат-ионов с 2,+,6-трифенилпирриллием с концентрацией 10 , а вкачестве растворителя использована смесь дихлорэтана и хлороформа при соотношении компонентов растворителя о6.%: Дихлорэтан10-90 Хлороформ80-20 . -pffeO
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (19) (11) А
З ;1> С 01 И 27/30
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
H ABTOPCH0MY СВИДЕТЕЛЬСТВУ («.1 «,«««, «« °
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 3296566/18-25 (22) 10,04.81 (46) 30.09.83 ° Бюл ° 1т 36 (72) В.А.Заринский, Л.В.Борисова, Л.К.Шпигун, Н.И,Петров, М.X ° Ïàâëîâà и A.Í ° Ермаков (71) Ордена Ленина Институт геохимии и аналитической химии им.В.И.Вернадского (53) 543.257(088.8) (56) 1. .Урусов и др. Разработка и исследование жидких мембранных электродов. Сообщение 9. Электроды, се лективные к перринат-ионат. MAX, т.30, 1975, N 9, с.1757.
2. Заринский В,A. и др. Разработка и исследование электрода селективного к перренат-иону, ЖАХ, т.31, 1976, N 6, с. 1191- 1195 (прототип). (54) СОСТАВ МЕМБРАНЫ ИОНОСЕЛЕКТИВНОГО ЭЛЕКТРОДА ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВЕ,4
7бР
И
1Я
Ю бО
-20
-ФО
-Ю
НОСТИ ПЕРРЕНАТ-ИОНОВ (ЕГО ВАРИАНТЫ) (57} 1. Состав мембраны ионоселективного электрода для определения ак. тивности перренат-ионов, содержащий электродно-активное вещество на ос" нове ионного ассоциата перренат-ионов с органическим катионом и органический растворитель, о т л и ч а ю шийся тем, что, с целью повы" шения селективности и воспроизводимости, в качестве электродно-активного вещества использован ионный ассоциат перренат-ионов с 2,4,6-трифенилпирриллием с концентрацией
-Ъ
10 -10 М, а вкачестве растворителя использована смесь дихлорэтана и хлороформа при соотношении компонентов растворителя об. . :
Дихлорэтан 10 90
Хлороформ 80-20
10451
2. Состав мембраны ионоселективного электрода для определения активности перренат-ионов, содержащий электродно-активное вещество на основе ионного ассоциата перренат-ионов с органическим катионом и органичес" кий растворитель, о т л и ч à l0 щ и й. с я тем, что, с целью повышения селективности и воспроизводимости„ в качестве электродно-активного вещест5-7
31-33
60-65
03 ва использован ионный ассоциат перренат-ионов,с 2,4,6-трифенилпириллием, а в качестве растворителя использована смесь поливинилхлорида и диоктилфталата при следующем соотношении компонентов мембраны, вес.3:
Электродно-активное вещество
Поливинцлхлорид
Диоктилфталат
Изобретение относится к потенциометрическим методам анализа и контроля концентрации ионов в водных растворах и может быть использовано в химической, металлургической про- 5 мышленности, в оптической химии и в практике научных исследований.
Известны мембраны, состоящие из соединений перренат-ионов, с бриллиан" товой зеленью в органическом растворс., обладающие перренатной функцией в диапазоне концентраций 10 - 10 М при рН 5,0-7,2, которые характеризуются довольно низкой селективностью по отношению к перренат-ионам, особенно в присутствии ионов С10 -SCN
4и ЧО;, (1j
Наиболее близким к предлагаемому . является состав мембраны ионоселективного электрода для определения 20 перренат-ионов, содержащий электродно. активное вещество на основе ионного ассоциата перренат-иона с органическим катионом и органическим раствоэителем. Мембрана электрода состоит из раствора ионообменника в органическом растворителе, в качестве кото. рого используют 1 ° 10 М раствор ионного ассоциата пеоренат-иона с катионом тетрафениларсония состава 30 (С Н )4 As)+Re0< в нитробензоле, Электрод на основе этого соединения сохраняет электродную функцию в диапазоне 10 " -10 М; обнаруживает независимость потенциала (при постоянной ионной силе) в широком интервале концентрации ионов водорода (от 1,5N
Н,, Г, до 5 М Н ОН), характеризуется коэффициентами селективности, равными
>,6 10 8,0"10 ; 7 4 10 1 10
10 соответственно в присутствии
501, ИО, VO ; С1, ИО и ионов любых катионов., однако потенциал этого электрода в большей или меньшей степени зависит от присутствия С10л, CNS l, Вг, С1, CA . Время установления равновесного потенциала для разбавленных растворов 3-5 мин, а для концентрированных 1-2 мин, в сложных по составу растворах это время значительно увеличивается, Воспроизводимость значений потенциалов этого электрода для растворов одной и той же концентрации +? мВГ2 1, Существенным недостатком ионообменника является также его токсичность и сложность синтеза.
Цель изобретения — повышение селективности и воспроизводимости.
Поставленная цель достигается тем, что в составе мембраны ионоселективного электрода для. определения активности перренат-ионов, содержащем электродно-активное вещество на основе ионного ассоциата перренат-ионов с органическим катионом и органический растворитель, в качестве электродно-активного вещества использован ионный ассоциат перренат-ионов с
2,4,6-трифенилпириллием с концентрацией 10 -10 М, а в качестве раство рителя использована смесь дихлорэтана и хлороформа при соотношении компонентов растворителя, об.3:
Дихлорэтан 10-ЧО
Хлороформ 80-20
Поставленная цель достигается также тем, что в сос" àâå мембраны ионоселективного электрода для определения активности перренат-ионов, содержащем электродно-активное вещество на основе ионного ассоциата перренат1045103 4
Пленочную мембрану готовят следующим образом.
60 мг перрената 2,4,6-трифенил@ериллия (ПТФП) растворяют в 6 мл смеси диоктилфталата 74 мг (ДОФ) и
1,2-дихлорэтана. Полученный раствор постепенно приливают к 40 мг поливинилхлорида (ПВХ), предварительно растворенного в 2 мл 1,2-дихлорэтана.
После тщательного перемешивания магнитной мешалкой ро получения однородной вязкой смеси последнюю выливают м в чашку Петри { внутренний диаметр
33 мм) и оставляют открытой на воздухе до получения прозрачной эластичной пленки. Оптимальный состав мемб,ранной-смеси, вес.б: ПВХ:ДОФ:ПТФП=
=33,3:62,7:5,0.
Изучение электрохимического пове1 дения мембран проводят путем измерения ЭДС гальванической цепи с переносом .AglAgC1, е А (Иембрама )
10 MNH
i lH(NH,) S0+ KC 1„, Арб!) Ао, Общее омическое сопротивление цепи, включающей жидкую и пленочную мембра" ны, соответствено равно 700 кОм и
10 МОм. ионов с органическим катионом и органический растворитель, в качестве электродно-акти вного вещества использован ионный ассоциат перренат-ионов с 2,4,6-трифенилпириллием, а в качест ве растворителя использована смесь поливинилхлорида и диоктилфталата при следующем соотношении компонентов мембраны, вес.3:
Электродно-активное вещество 5-7
Поливинилхлорид 31-33
Диоктафталат 60-65
Жидкую мембрану готовят экстракционным:методом.
В делительную воронку помещают
10 мл 0,01 М водного раствора перрената аммония и добавляют l0 мл
0,001 М раствора сульфата 2,4,6-трифенилпиррилия в смеси хлороформ
1,2-дихлорэтан. После 5 мий перемешивания фазы разделяют, органический раствор фильтруют через бумажный фильтр и используют в дальнейшем без предварительного контроля концентрации. Предлагаемый рабочий состав органической фазы — 0,001 М раствор (Сь Н ),,С -Н20) Ре02.
Нижний предел обнаружения рения с помощью предлагаемого электрода соC
-ставляет 1 10 М, в то время как линейная область функционирования электрода порядка 10 -10 М.
Предлагаемые пределы содержания компонентов в мембранах являются onтимальными, поскольку в случае жидкой мембраны электрода при концентрации ионообменника меньше 10 " М значительно ухудшаются кинетические свойства мембран и наблюдается дрейф потенциала вследствие увеличения их электрического сопротивления; при концентрации ионообменника больше
10 M в фазе мембраны наблюдается увеличение нижнего предела обнаружения перренат-ионов, Применение смешанного растворителя с концентрацией в указанных пределах продиктовано тем, что применяемый ионообменник хорошо растворяется в хлороформе а 1,2-дихлорэтан, диэлектрическая проницаемость которого 10,36, уменьшает электрическое сопротивление ионоселективной мембраны и тем самым улучшает ее рабочие характеристики, в случае пленочной мембраны содержание ионообменника 5-73 лимитируется растворимостью в диоктилфталате.
Указанные количества диоктилфтала (60-653) обеспечивают наилучшую совместимость ПВХ и иснообменника, а также придают гленке требуемую эластичность; при добавлении указанного количества ПРХ (31-334 получают плен. ки оптимальной толщины 0,3-0,5 мм
{более тонкие пленки обладают малой механической прочностью, а более толстые имеют худшие рабочие характеристики).
Для регистрации ЭДС используют цифровой вольтметр 11 1513, показания ко-,срого автоматически регистрируют с помощью цифрогечатающего устройства
9 5033l(, состоящего из транскриптора Ф 5033 и электроуправляемой пишущей машины ЭУМ-23Д.
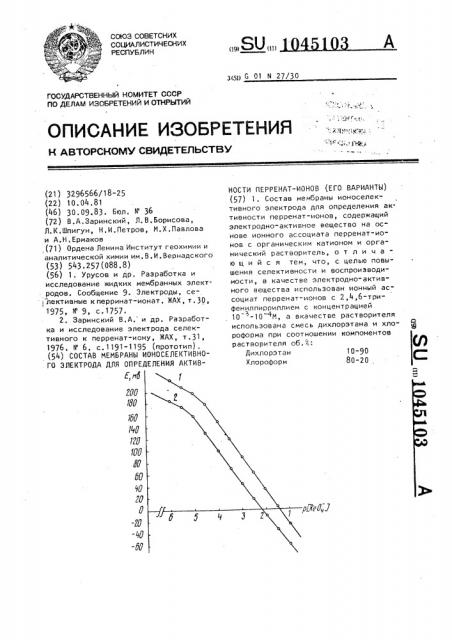
На чертеже представлены калибровочные графики, полувоенные для случая жидкой (кривая 1) и пленочной {кривая 2) мембран при температуре (22+1) С.
Как видно из чертежа„ электрохимическое поведение мембран на основе перрената. ?,4,6 -трифенил, периллия характеризуется широкими диапазонами функционирования 1 10
1 ° 10 М.
045103 Ь ется постоянным в течение рабочего дня с точностью +0,5 мВ.
Чувствительность мембрано-активного материала к изменению концентра
5 ции перренат-ионов в растворе в присутствии посторонних анионов оценивают путем расчета потенциометрических коэффициентов селективности, зна. чения которых, приведены в табл.1.
1О- Установлено также, что присутствии
* меди (!i), железа (11), никеля (i1), кобальта (11), цинка (li), кадмия(11), ртути (II), таллия (I) и других ка.тионов практически не оказывает влия15 -ния на потенциал электродной системы (при условии постоянства ионной силы раствора) коэффициенты селективности
Таблица но (3,4+0,2) 10 (2,2+0,2) 10 ой5 (1.3+0,3) 10" (9,5 0 Р).1Р-S (5,0+О, 1) нро4 2 2 наО} ИО„
10 s (1,6+0,3) 10 (1,0g0,1 ) so
vo., I >0 i,"1, { 5 + 0,5) 10% д
{),260,3) .10 (7,ь+О,) ) ° (7,2+а,р) 10 р р и ; е а н и е, R=0,95, я *б, ионная сила еоднбйх растаороа )11 0,1, температура 22+1
Состав мембраны: 1 ° 10 М раствср Зо
660ã>ðåíàTà 2,4,6-трифенилпериллия в смеси хлороформ - 1,2-дихлорэтан=1:1.
Как следует из данных табл.1, электрод с мембраной на основе перрената 2,4„6-трифенилпери.плия обладает значительной селективностью к перренат-ионам в присутствии хлоридов, ;;.>осфатов, сульфатов и целого ряда других анионов.
Присутствие ионов меди (1})!æåëåза (!}),íèêåëÿ(ii), кобальта(11), цинка(11), кадмия(11), ртути(I), таллия(!) и других катионов практически
Т а б л и ц а 2
Результаты потенциометрического определения Re в модельных растворах (Re-Mo-ИГ ) методом добавок
Re, мгlмл >» (6) 5х / и
Отн ° аоодо»о найдено 1X) 0,96
0,092 092
0,184
0,195
0,210
0;0Q5
0,005
0,181
0,192
0,2}3
1,6
1,6
0,06 i,4
0,006
3 1
Крутизна электродной функции соот 1 ветственно равна для жидкой и пленочной мембран (59}-1) мВ/р t.ReO„ ) и
57,5+0,5) мВ/р } йеО,}.). Перренатная функция мембран выполняется в области концентрации водородных ионов от
1МНО+до5МН(ОН, Электроды с этими мембранами характеризуются высокой стабильностью в работе и хорошими кинематическими свойствами.
Время установления равновесного потенциала для концентрированных растворов перренат-ионов составляет
30 с — 1 мин, а для разбавленных
2-3 мин. Мембранный потенциал остане оказывает влияния на мембранный потенциал (при условии постоянства ионной силы раствора) . Существенного различия в селективности мембран с различным содержанием описанного выше ассоциата в мембране, а также с растворителями различной природы замечено не было.
Для проверки функционирования перренатного электрода с вышеописанной мембраной проведены прямые потенциометрические измерения содержания рения в ряде модельных растворов различного
rnrTàRë { табл.2 и 3) °
1045103,продолжение табл. 2
Re, мг/мл, Ф ФЮЮ O введено найдено (Х) t одс (6) Sy (0) - п
Отн.
0,258 0,261
0,08
1,2
1,0
0,01
0,911 0,92
1,452
1,862.1,43
0,02
1,3
1,85
0 50,02
П р и м е ч а н. и е: Состав раствора: 1,10 И йа МоО +
+ 2 10 И Na ЧО на фоне 0,1 И Н SO. Таблица 3
Результаты потенциометрического определения в пробах аммиачного элюата
Найдено Re, мг/мл
Проба с помощью ионоселекTNвного электрода спектральным методом
09315 g 0,008
0 33
1,65 «+ 0,03
1,67
Составитель И.Рогаль
Редактор А.Власенко Техред И.Гайду Корректор В.Гирняк, Заказ 7541/44 Тираж 873 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раущская наб., д 4/5
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4
Результаты анализа производст.венных растворов, приведенные в табл.3, удовлетворительно согласу" ются с данными. спектрального .метода.
Полученные -результаты дают осно- 40 вание сделать вывод о том, что при.менение перрената 2,4,6-трифенил периллия в качестве мембраноактивного вещества позволяет получить селективную мембрану, чувствительную к изме- 4> . нению концентрации рения в форме перренат-ионов и сохраняющую работоспособность в присутствии значительных избытков посторонних аннионов и катионов.
Достоинством предлагаемой мембраны являются ее нетоксичность и простота синтеза реагента в отличие от тетрафениларсония. .Предложенный состав мембраны ИСЭ может быть использован для контроля содержания перренат-ионов в промышленных сернокислотных и щелочных растворах в технологии получения рения, а также для определения рения в жаростойких сплавах, содержащих молибден, вольфрам и т.д.