Способ фазового анализа серощелочных растворов на содержание анионных форм серы
Иллюстрации
Показать всеРеферат
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК (19) (11) з(5ц 001 й2 48
Г
ОПИСАНИЕ ИЗОБРЕТЕНИЯ Ъ
Ъ
Ц, w4l7
-а нп, ф!м AyNOy
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ
Н ABTOPCHOMV СВИДЕТЕЛЬСТВУ (21) 3384691/18-25 (22) 28.01.82 (46) 30.09.83. Бюл. 11 36 (72) Т.Д.Горностаева, В.A,Ïðoíèí и В.Я.Семенов (71) Иркутский государственный научноисследовательский институт редких и цветных металлов (53) 547.243(088.8) (56) 1, Шарло Г. Методы химического анализа. N., "Мир", 1969, ч.2, с.1000.
2. Рарр Дж,, Хавас Дж. Применение в аналитических целях мембранного электрода, обладающего селективностью по отношению к сульфид-ионам. - Венгерские химические записки, 1970, т.76, N 6, с.307-312. (54) (57) СПОСОБ ФАЗОВОГО АНАЛИЗА СЕРОЩЕЛОЧНЫХ РАСТВОРОВ НА СОДЕРЖАНИЕ
АНИОННЫХ ФОРМ СЕРЫ потенциометричес" ким титрованием с применением индикаторного электрода, о т л и ч а ю— шийся тем, что, с целью повышения селективности определения форм серы и полисульфидности серощелочных растворов, их титрование проводят ( раствором азотнокислого серебра с сульфидсеребряным электродом по скачкам потенциалов, при этом первый скачок потенциалов в диапазоне от -0,65 до -0,55 В используют для определения свободных сульфид-ионов, второй в диапазоне потенциалов от -0,50 до
®
-0,70 В - для определения полисульфидйонов, а третий в диапазоне потенциалов 0,10-0,40  — для определения тиосульфат-ионов.
3 1045
Изобретение относится к анаяити" ческой химии серы и может быть исполь" эовано в оперативном контроле фазового состава анирнных форм серы серощелочных растворов при гидрометаллур" гическом производстве цветных и благородных металлов, очистке сточных вод, а также в целлюлозно-бумажной промышленности.
Известен иодометрический способ 10 .определения концентрации анионов серы.
Сульфид- и полисульфид"ионы отделяют с помощью карбоната цинка и в фильт" рате определяют сульфит- и тиосульфат-ионы. Для определения полисульфидной серы полисульфид-ионы восстанавливают сульфитом натрия и отделяют сульфлд-ионы осаждением (1)
Недостатками указанного способа, являются многостадиальность, трудоемкость и большая затрата времени ;,родолжительность анализа одного раствора 3 ч). Главным же недостатком этого способа является то, что он, дает только указание на присутствие 25 полисульфидной серы и не раскрывает, качественно-количественного состава полисульфид-ионов.
Наиболее близким к предлагаемому является способ фазового анализа серощелочных растворов на содержание анионных форм серы потенциометрическим титрованием с применением индикаторного электрода 2 ) °
Недостатками известного способа определения концентрации анионов
35 серы являются невысокая экспрессность (продолжительность анализа одного раствора до 1,5 ч), применение высокотоксичного вещества - хлорида
40 ртути и невоэмо>нность раздельного определения сульфид-ионов, свободных и связанных с, полисульфидной серой, что в свою очередь, не позволяет определить число и в полисульфид-ионах (5, ).
Цель изобретения - повышение селективности определения форм серы и полисульфидности серощелочных растворов. 50
Поставленная цель достигается тем, что, согласно способу фазового анализа серощелочных растворов íà содержание анионных форм серы потенциоматрическим титрованием с примене-55 нием индикаторного электрода, их. тит рование проводят раствором азотнокислого серебра с сульфидсеребряным
105 2 электродом по качкаМ потенциалов, при этом первый скачок потенциалов в диапазоне от -0,65 до "0,55 В используют для определения свободных сульфид"ионов, второй в диапазоне потенциалов от -0,50 до -0,20 В - для определения полисульфид-ионов, а третий в диапазоне потенциалов 0,100,40 В - для определения тиосульфатионов.
Раздельное определение свободных сульфид-ионов, сульфид-ионов, связанных с полисульфидной серой, тиосульфат-ионов и других анионных форм серы проводят последовательно и непрерывно по характеристическим скачкам потенциалов, определяющих качественно и количественно вышеуказанные анионные формы серы эа счет образования на поверхности сульфидсеребря-. ного электрода сульфидсеребряных пленок переменного состава при потенциометрическим титровании серощелочных растворов раствором азотнокислого серебра, Образование сульфидсеребряных пленок переменного состава дополнительно подтверждено независимыми методами. Рентгенофазовый анализ образующихся пленок на поверхности электрода в ходе потенциометрического титрования свободных сульфид-ионов показывает их кристаллическую структуру типа Р -Ац S, а в ходе титрования сульфид-ионов, связанных с полисульфидной серой, рентгеноаморфную структуру типа Ag Sn > . Химический анализ подтверждает эти данные. На основе этого явления удается зафиксирова гь характериЧтические скачки потенциала индикаторного электрода при потенциометрическом определении серосодержащих анионов. После определения свободных и связанных с поли-. сульфидной серой сульфид-ионов в этом же растворе определяют тиосульфатионы, Для этого в раствор прибавляют по каплям раствор уксусной кислоты до рН 6,5-7,5. На нейтрализацию раствора расходуется 1-2 мл раствора уксусной кислоты, разведенной 1:19, в зависимости от содержания гидроксида в анализируемом растворе, Затем титруют тиосульфат-ионы раствором аэотнокислого серебра, В отдельной аликвотной части анализируемого раствора определяют полисульфидную серу. К раствору прибавляют 1 мл 0,5 М раствора сульфита натрия для восстановления полисуль50
3 10451 фидной серы и образования тиосульфатионов. Реакция восстановления проходит при нагревании раствора до 50+5 C (тиосульфат-ионы неустойчивы при более высоких температура раствора), Прибавляемое количество сульфита натрия является избыточным для восстановления в аликвотной части раствора предельно полученных количеств полисульфидной серы. Для связывания из- 1О бытка сульфита натрия в раствор прибавляют 5 мл формальдегида (товарный препарат без разведения). Затем титруют сульфид-ионы раствором азотнокислого серебра и после прцбавления раствора уксусной кислоты до pk 6,57,5 титруют тиосульфат-ионы. Разность количеств азотнокислого серебра, затраченных на титрование тиосульфат-ионов в двух аликвотных частях раствора, соответствуеФ объему раствора, пошедшего на титрование полисульфидной серы. После определения содержания всех форм серы рассчитывают среднюю степень полисульфидности и в полисульфид-ионах.
Для титрования серощелочных растворов, содержащих 1-10 г/л серы, применяют 0,05 М раствор азотнокислого серебра. При этом на 1 мл анализируе- Зо
1 мого раствора (раствор перед титрованием разводят до 10 мл 0,1 М раствором гидроксида натрия ) расход титранта составляет 1-10 мл. Последнее удобно при титровании с применением блока автоматического титрования
БАТ-15, так как в комплекте с ним поставляются бюретки емкостью 10 мл, Для титрования серощелочных растворов содержащих более 10 г/л серы приме1 40 няют 0,1 Ml раствор азотнокислого серебра.
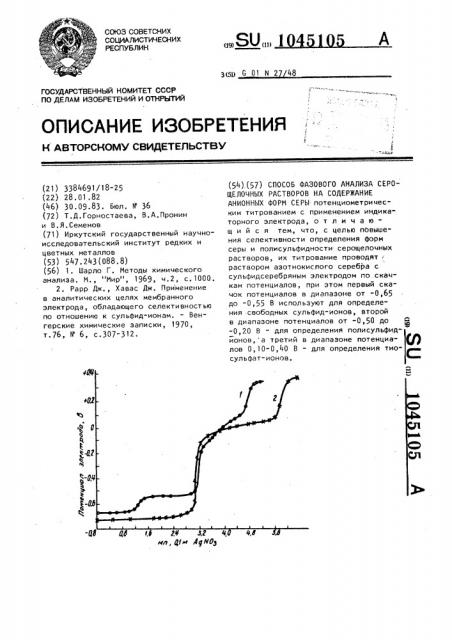
На графике приведены потенциометрические кривые титрования двух аликвотных частей анализируемого раствора раствором азотнокислого се- 45 ребра.
В первой аликвотной части раствора (кривая 1) титруют свободные суль фид-ионы (первый скачок потенциалов в интервале от -0,65 до -0,55 B), связанные с полисульфидной серой сульфид- ионы (второй скачок потенциалов в интервале от -0,50 до 0,20 В) и тиосульфат-ионы (третий скачок потенциалов в интервале 0,10-0,40 В) 55
Во второй аликвотной части анализируемого раствора (кривая 2) после восстановления полисульфидной серы
05 4 растворам сульфита натрия титруют сумму сульфид-ионов свободных и связанных с полисульфиднай серой (первый скачок потенциалов в интервале от
-0,70 до -0,20 В ) и сумму тиосульфатионов, имеющихся в анализируемом растворе и полученных в результате восстановления полисульфидной серы (второй скачок потенциалов в интервале 0,10-0,40 В) °
Пример 1. Анализируют серощелочной раствор с содержанием элементной серы 3,60 г/л. Титруют свободные сульфид-ионы в интервале потенциалов от -0,65 до -0,55 В и связанные с полисульфидной серой в интервале потенциалов от -0,50 до -0,20 В
0,05 М растворам азотнокислого серебра. Затем прибавляют по каплям раствор уксусной кислоты, разведенной 1:19, до рН 7 и титруют тиосульфат-ионы в интервале потенциалов
0,10-0,40 В, Ко второй аликвотной части анализируемого раствора при" бавляют 1 мл 0,5 М раствора сульфита натрия, нагревают до 50 С до обесцвечивания раствора и титруют сумму сульфид-ионов в интервале потенциалов от -0,70 да -0,40 В. Затем прибавляют раствор уксусной кислоты до рН 75 мл формальдегида и титруют сумму тиосульфат-ионов в интервале потенциалов 0,10-0,40 В °
Результаты фазового анализа анионных форм серы в расчете на элементную серу получают па формуле, Т V. 1000 х =
I а где x — - концентрация определяемой анианнай формы, серы, г/л;
Т - титр раствора азотнокислого серебра, г/л;
V — объем раствора азотноквслого серебра, пошедший на титрование, мл; а - аликвотная часть анализируемого раствора, мл.
Расчет титра раствора азотнокисло" го серебра по элементной сере проводят, исходя из реакций
S + 2Ag w Ag25, S2O g + 2Ag - Ac S Oq, 2Для 0,05 М раствора азотнокислого серебра титр по сульфид-ионам составляет 0,0008 г/мл S и по тиосульфатионам 0,00 16 г/мл S.
Исходя из этого, получают следующие результаты анализа, г/л:
1045 l
20 полчс
0,0008 981000
0,0008 0>52. 1000
О 0016 1, 14 1000
1
0,0016 0,32 1000 -т — — = 0,58 ,60
Расчет числа и в S, -ионах проводят по формуле
n= — +1, С где P - содержание полисульфидной серы серы, г/л; 15
С - содержание сульфид-ионов, связанных с полисульфидной серой, г/л.
В данном примере = î <2z+" = 2,38
Правильность результатов фазового анализа раствора установлена гравиметрическим методом. После окисления всех форм серы до анионов 50„ и осаждения их раствором хлорида бария было найдено общее содержание серы в раст- 25 воре 3,60 гlл.
Образующиеся в процессе титрования на поверхности сульфидсеребряного электрода и в растворе сульфиды переменного состава анализируют химическим и рентгенофазовым анализом. При титровании свободных сульфид-ионов образуется сульфид состава Ag2S, а при титровании связанных с полисульфидной серой сульфид-ионов — рентгено35 аморфный сульфид.
Пример 2. В анализируемом серощелочном растворе, содержащем элементную серу 75 г/л, титруют свободные и связанные с полисульфидной серой сульфид-ионы 0,1 М раствором азотнокислого серебра в интервале потенциалов от -0,65 до -0,55 В и от -0,50 до -0,20 В соответствеено. Затем прибавляют по каплям раствор уксусной кислоты, разведенной 1:19, до рН 7 и титруют тиосульфат-ионы 0,1 М раствором азотнокислого серебра в интервале потенциалов 0,10-0,40 В. Ко второй части анализируемого раствора прибав.
50 ляют 1 мл 0,5 М раствора сульфита с натрия, нагревают до 50 С до обесцвечивания раствора и титруют сумму сульфид-ионов 0,1 М раствором аэотнокислого серебра в интервале потенциалов от
-0,70 до -0,20 В. Затем прибавляют
5 по каплям раствор уксусной кислоты до рН 7,5 мм формальдегида и титруют сумму тиосульфат-ионов 0,1 М раство05
Ь ром азотнокислого серебра в интервале потенциалов 0,10-0,40 В. Содержание полисульфидной серы рассчитывают по разности результатов определения тиосульфат-ионов во второй и первой аликвотных частях анализируемого раствора.
Для 0,1 М раствора азотнокислого серебра титр по сульфид-ионам равен
--0,0016 г/мл S и по тиосульфат-ионам
-О <0032 ??>
В результате расчета получены следующие данные, г/л:
0 0016 1 56 1000 с eos В
0,0016 1,52 1000 12 16 смъ 0,2
О, 0032 1,52 1000 24 2
0,2
0,0032 1„60" 1000
0,2 7775à и = — -- + 1 = 3,10
25 60
12, 16 (Правильность результатов фазового анализа раствора устанавливают гравиметрическим методом. После окисле 2.— ния всех форм до аниона SO+ и осаждения его раствором хлорида бария было найдено общее содержание серы в растворе 74,72 гlл.
Методика позволяет определить концентрацию анионов серы в серощелочных растворах, содержащих от 0,2 г/л до
100 г/л серы. Растворы„ содержащие более l00 г/л серы, перед взятием аликвотной части раствора необходимо разводить раствором щелочи, Погрешность определения анионов серы соответствует следующим величинам относительно стандартного отклонения (S,):
Бсвоg О, 06; Spqь 0,04; S20,„0,04;
Snonwc О, 07
Селективность определения характеризуется следующими величинами допустимых соотношений определяемых ионов:
5 „о„ц определяют после восстановпо чс. ления до S O т.е. применимы соотношения (2), В серощелочных растворах, полученных растворением элементной серы в растворе щелочи, отсутствуют анионные соединения селена и теллура а также анионы CN u CNS, которые ме7 1045105 Я шают при соответствующих концентра- концентрацию тиосульфатной и полициях.определению анионных соединений сульфидной серы, общую концентрацию серы. растворенной серы, применять нетоксичные реагенты и доступную аппарату-
Таким образом, предлагаемый спо- ру и обладает высокой экспрессностью. соб фазового анализа серощелочных При проведении серийных анализов титрастворов.на содержание анионных рование проводят до заданного поформ серы превосходит известные спо- тенциала потенциала в точке эквисобы анализа по своим возможностям. валентности ) в автоматическом режиме
Способ позволяет раздельно и коли- 10 с использованием блока автоматичесчественно определить свободные и свя- кого титрования типа БАТ-15, При этом ванные с полисульфидной серой суль- продолжительность анализа раствора фидионы, число и в полисульфид-ионе, не более тридцаТи минут.
Составитель И.Рогаль
Редактор А.Власенко Техред А.Бабинец Корректор В,Гирняк
Заказ 7541/44 Тираж 873 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, N-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г. Ужгород. ул. Проектная, 4