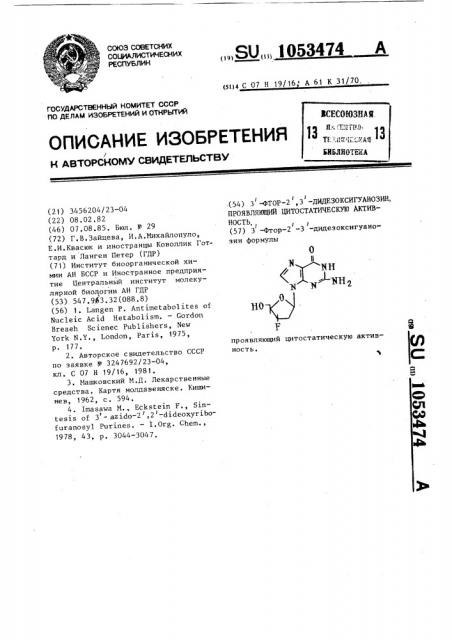
3-фтор-2,3-дидезоксигуанозин,проявляющий цитостатическую активность
Иллюстрации
Показать всеРеферат
3 - I Top-2 -3 -дидеэоксигуаноЗИН формулы О ХNH Н2 л но Чг проявляющий цитостатическую актив (Л ность. с ел О9 4 :
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСГ1УБЛИК
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
H АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
О
lI
5Н
„« -нн, ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3456204/23-04 (22) 08.02 ° 82 (46) 07.08.85. Бюл. Ф 29 (72) Г.В.Зайцева, И.А,Михайлопуло, E.И.Квасюк и иностранцы Коволлик Готтард и Ланген Петер (ГДР) (71) Институт биоорганической химии АН БССР и Иностранное предприятие Центральный институт молекулярной биологии АН ГДР (53) 547 963.32(088.8) (56) 1. Langen P. Antimetabolites of
Nucleic Acid Hetabolism. — Gordon
Breach Scienec Publishers, New
York N.Y., London, Paris, 1975, р. 177.
2. Авторское свидетельство СССР по заявке У 3247692/23-04, кл, С 07 Н 19/16, 1981.
3, Машковский М.Д. Лекарственные средства. Картя молдавеняске. Кишинев, 1962, с, 594.
4. Imasawa М., Eckstein F Sintesis of 3 - ааЫо-2,2 -dideoxyribofuranosyl Purines. — I.0rg. Chem., 1978, 43, р. 3044-3047.
„„SU„„1053474 А (s))4 С 07 Н 19/16 А 61 К 31/70.
-(54) 3 -@ТОР-2,3 -ДИДЕЗОКСИГУАНОЗИН, ПРОЯВЛЯ10ЩИИ ЦИТОСТАТИЧЕСКУЮ АКТИВНОСТЬ, I (57) 3 -@тор-2 -3 -дидеэоксигуаноэин формулы проявляющий цитостатическую активность.
1053 I 7/!
Изобретение относитсм к новым производным класса модифицированных нуклеоэидов, являющихся антиметаболитами обмена нуклеиновых кислот, / / конкретно к 3 -фтор-2,3 -дидезокси- 5 гуанозину формулы 1
ИО проявлякЩВму цитостатическую ак:тивность, который может найти гтрименение в медицине в качестве высокоэффективного противоопухолевого средст-20 ва.
Структурными аналогами предлагаеI I мого соединения являются 2,3 -дидеI зоксигуаноэин формулы II f1), 3 !
-@тор-2, 3 -дидезоксиаде нози н формулы III (2) .
1l (i ) г!/.1 — м.н 2
ЛО
Данных о биологической активности соединения формулы 1? в литературе ! I не имеется. 3 — Фтор-2, 3 -дидезокси-, 45 аденозин >>> проявляет цитостатическую активность.
Ингибируя синтез нуклеиновых кислот антиметаболиты действуют как циЭ тостатические агенты. К числу широко 50 применяемых в медицинской практике антиметаболитов, используемых для лечения зпокачественных новообразований, относится меркаптопурин (3), который является аналогом по назна- 5
/ / / чению для 3 -фтор-2,3 -дидезокси1 гуанозина . Однако сер ье э ным недос тат. ком меркаптопурина является его я<в!
1Ост аточ го Вы(Окан !гктг!В!.
Целью изобретения является новое производное класса модифицированных
Вуклеозидов, проявляющее высокую цитостатическую активность и расширяющее арсенал средств воздействия на живой организм. !
Цель достигается свойствами 3
/ фтор-2,3 -дидезоксигуанозина формулы (1), проявляющего высокую цитостатическую активность.
/ I l
Способ получения 3 -фтор-2,3 -дидеэоксигуанозина (1) основан на реакции трансгликозилирования (4) и заключается во взаимодействии 5-О-аце/ < . / тил-3 -фтор — 2,3 -дидезокситимидина (IV) с сильным производньгм (1/Ц N — — пальмитоилгуанина (1/) при кипячении в безводном ацетоггитриле в присутствии триметилсилильного эфира трифтсрметансульфоновой кислоты (трифлата) в ка— честве катализатора. Целевой продукт (1) выделяют в кристаллическом виде путем аммонолиза (раствор аммиака в метаноле) промежуточного 9-/5-О-ацетил-3-фтор-2,3 — дидеэокси-/3-1 -рибофуранозил/-N2 -пальмитоилгуанина (VII), ко.;-орый получают в индивидуальном кристаллическом состоянии в результате разделения продуктов реакции, используя колоночную хроматографию на силикагеле.
О
) (Н 0 (СН3)3$: С1 !
Il — Э J NHCICHq)I«CHg(ICHg)JSl)gNH
0$1(Щ)3
N N
Д. - :((-Н2)НСИ 3
$1(СН3) 3 (СИЗ)з 81
Ас0 (т рИгрлат)
C r,M)3S1((:Ö,), 053474 4 отделяя фракции по 15 мл. Фракции
25-37 собирают отдельно и получают
320 мг (24,6%) 9-/З-фтор-Z, 3-дидезокси-5-0-ацетил-P-D-рибофурэнозил/-N -пальмитоилгуанина (VII). Эти фракции после упаривания обрабатывают насыщенным ИН в метаноле при комнатной темпераrype. Спустя сутки реакционную смесь упаривают до небольшого объема, выпавшие кристаллы фильтруют, промывают метанолом, получают 120 мг (81%) 3 -фтор-2,3 -ди
О дезоксигуаноэина. При 265 С вЂ” потемО нение кристаллов (при 290 С не йла15 вятся). УФ: Я „,с,„. 255 нм (E 15000), плечо при 275 нм, 208 нм (Я 16400), Масс-спектр: пик молекулярного иона с m/е 269, углевсдный фрагмент
/$/С Н О, F cm/å 119, гетероциклическое основание /В + Н/ стп/е 151, C H5N О, С,îН 1г ОзN F /269, 25/.
Биологические испытания проводят на культуре клеток асцитной карциномы Эрлиха. Опухолевые клетки выделяют из подбрюшинной полости предварительно зараженных белых мышей на 5-6-й день инкубации. Процент ингибирования размножения опухолевых клеток определяется путем визуального подсчета числа клеток в контрольном экс-! перименте, в присутствии 3 -фтор-.
-2,3 -дидезоксигуанозина и в присутствии 3 -фтор-2,3 -дидезоксиаденозина. Степень размножения клеток в контрольных опытах составляла 86% эа 24 ч, В сравнении с контролем рост
1 клеток, обработанных 3 -фтор-2,3
-дидезоксигуанозином и 3 -фтор-2, 3
-дидезоксиаденозином, подавляется следующим образом (см. таблицу).
Растворы 3 -фтор-2,3 -дидезокси-! гуанозина (I) и 3 -фтор-2,3 -дидезоксиаденозина (III ) в воде готовят путем последовательного разбавления концентрированных обраэ—
Меркаптопурин — аналог 3 -фтор-!
-2,3 -дидеэоксигуанозина по назначению испытывают в тех же условиях, но из — за его плохой растворимости растворяют в диметилсульфоксиде.
Степень ингибирования размножения опухолевых клеток в присутстии меркаптопурина составляет 28% при кондентрации 1 10 моль °
Данные испытаний свидетельствуют о высокой цитостатической активности ! 1
3 -фтор-2,3 -дидезоксигуанозина, N
ЛсО
VII
О
Н мн
„Ф-х н, 20
5 р и м е р. 3 -Фтор-2,3 -диде зоксигуанозин.
1, б r (4 моль) 1! -пальмитоилгуЛнина (Й суспендируют в 13 мл гексаметилдисилазана и 0,7 мл триметилхлорсилана. Реакционную смесь кипятят, добавляя через 1 ч и 4 ч по
0,5 мл триметилхлорсилана. Через
5 ч полученный раствор упаривают в вакууме с добавлением толуола. . 30
Оставшийся сиропообразный остаток силилированного и -пальмитоилгуанина (VI растворяют в 15 мл безводного ацетонитрила, добавляют
0,68 г (2,4 ммоль) З-фтор-2,3-дидез окси-5-0-ацетилтимидина (1Ч), а 35 затем при перемешивании 0,55 мп (3,22 ммоль) триметилсилильного эфи. ра трифторметансульфоновой кислоты (трифлата) . Реакционную смесь кипя40 тят 3 ч с удалением влаги, затем охлаждают до комнатной температуры и выливают при перемешивании в
150 мл смеси насыщенного водного раствора КНСО, и этилацетата (1:1, 45 по объему). Слои разделяют, водныи слой промывают этилацетатом (2450 мл)
Объединенные органические фазы фильтруют для удаления 0,4 г выпавшего N -пальмитоилгуанина, затем
50 упаривают в вакууме досуха с добавлением безводного бензола. Маслообраэный остаток растворяют в хлороэ форме и наносят на колонну 120 см силикагеля (Kieselgel 60, Nerk), заполненную в хлороформе. Колонну элюи
55 руют сначала хлороформом, а затем смесью хлороформ-метанол с постепен
HblM увеличением содержания метанола, 1053474 проявляющейся даже в концентрации
-б
1 10 моль. Активность предлагаемого соединения сравнима по величине с ак-6
7 ингибирования при концентрации, х -10 моль
Соединение
3 6 10 30 50
100
33
98
100
Техред Т.Фанта
Корректор О.Тигор
Редактор О.Юркова
Заказ 5761/1
Тираж 354 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал IIIIII Патент, г. Ужгород, ул. Проектная, l „! I
3 -Фтор-2,3 -дидезоксигуанозин (1) I I
3 -Фтор-2,3 -дидезоксиаденозин (III) тивностью структурного аналога (III), и превышает примерно в 50 раз актив ность меркаптопурина.