Способ получения алкалоидов типа лейрозина или их кислых аддитивных солей
Иллюстрации
Показать всеРеферат
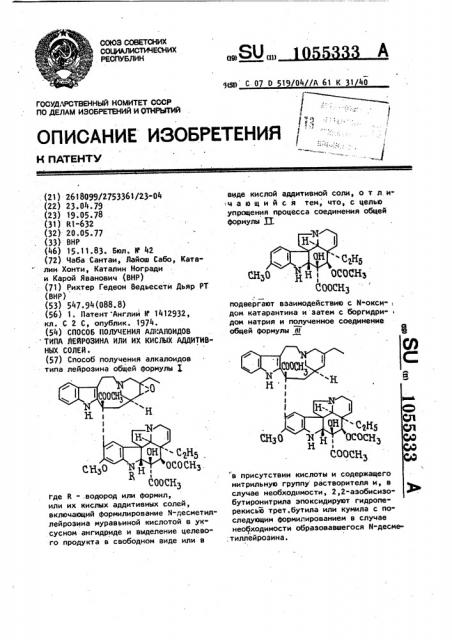
Способ получения алкалоидов типа лейрозина общей формулы I Где R .водород или формил, или их кислых аддитивных солей, включающий формилирование N-десметиллейрозина муравьиной кислотой в уксусном ангидриде и выделение целевого продукта в свободном виде или в вмде кислой аддитивной соли, о т л и . чающийся тем, что, с целью упрощения процесса соединения общей формулы и. СООСНз подвергают взаимодействию с N-окси- i дом катарантина и затем с боргидридом натрия и по лученное соединение общей формулы JK со СП СП СаНб ОСОСНз СНзО N Н I со оо н I СООСНз со в присутствии кислоты и содержащего нитрильную группу растворителя и, в случае необходимости, 2,2 азобисизобутиронитрила эпоксидируют гидроперекисью трет.бутила или кумила с последующим формилированием в случае нео1 ходимости образовавшегося N-десме ,тиллейрозина.
ае «и
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК 0 С 07 О 519/04//А 61 К 31 40
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
flO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ н пдтентм --- --... j виде кислой аддитивной соли, о т л. ич а ю шийся тем, что, с целью упрацения процесса соединения общей формулы Х
С2К5. "„Н ОСОСН
СООСН 3 подвергают взаимодействию с N-окси- дом катарантина и затем с боргидридом натрия и полученное соединение общей формулы N 2 5
H НЗ
C2H5 . Б ОСО СН .
СООС З
I-де К - .водород или формил, или их кислых аддитивных солей, включающий формилирование Й-песметиллейрозина муравьиной кислотой в уксусном ангидриде и выделение целевого продукта в свободном виде или в.(21) 2618099/2753361/23-04 (22) 23.04.79 (23) 19.05.78 (31) R1 "632 (32) 20.05.77 (33) ВНР (46) 15.11.83. Бюл. я". 42 (72) Чаба Сантаи, Лайош Сабо, Каталин Хонти, Каталин Ногради и Карой Яванович (ВНР) (71) Рихтер Гедеон Ведьесети Дьяр РТ (BHP) (53) 547.94(088.8) (56) 1. Патент Англии Н 1412932, кл. С 2 С, опублик. 1974. (54) СПОСОБ ПОЛУЧЕНИЯ АЛЫАЛОИДОВ ТИПА ЛЕЙРОЗИНА ИЛИ ИХ КИСЛЫХ АДДИТИВНЫХ СОЛЕЙ. (57} Способ получения алкалоидов типа лейрозина общей формулы в присутствии кислоты и содержащего нитрильную группу растворителя и, в случае необходимости, 2,2-азобисизобутиронитрила эпоксидируют гидроперекисью трет.бутила или кумила с последующим формилированием в случае необходимости образовавшегося N-десметиллейрозина.
1 1055333 2
Изобретение относится к усовершен- дом натрия и полученное соединение форствованному способу получения алкало- мулы идов типа лейрозина общей формулы ((гi ) 2 5 2Н5 ()con ссссо, особы
СОО
С 2Н
OOOO?1> (-, соосн подвергают взаимодеиствию с Й -оксидом катарантина и затем с боргидригде R.- водород или Формил, или их кислых аддитивных солей, обладающих фармакологической активностью. 20
Известен способ получения алкалоидов типа лейрозина общей Формулы Х, или их Кислых аддитивных солей, заключающийся в том, что лейрозин окисляют, предпочтительно хромовой кисло- 25 той или ее солью в присутствии уксусного .ангидрида в качестве растворите" ля и полученную смесь й-дезметиллейрозина и й-Формилейрозина разделяют ияи подвергают Формилированию муз0 равьиной кислотой в уксусной ангидриде с последующим выделением целевого продукта в свободном виде или в виде соли (1 .
Недостатком этого способа является использование в качестве исходно35
ro вещества Фармакологически активного лейрозина, который находит применение в медицине в качестве лекарственного средства.
Цель изобретения — упрощение процесса, связанного с использованием исходных веществ, не оЬладающих высокой фармакологической активностью.
Поставленная цель достигается тем,, ЧтО СОГЛаСНО СПОСОбу ПОЛучЕНИя аЛКаЛО- 45 идов тиВа лейрозина общей формулы Х или их кислых аддитивных солей, заключающемуся в том, что соединение
Формулы в присутствии кислоты и содержащего нитрильную группу растворителя и в случае необходимости 2,Y"азобисизобутиронитрила эпоксидируют гидроперекисью трет.бутила или кумила с по-следующим формилированием в случае необходимости образовавшегося М-дезметиллейрозина и выделением продукта в свободном виде или в виде соли.
Отличительными .признаками способа являются взаимодействие соединения
Формулы П с М-оксидом катарантина и затем с боргидридом натрия и после" дующее эпоксидирова ие полученного соединения Формулы Ш гидроперекисью трет.Ьутила или кумила s присутствии кислоты и содержащего нитрильную группу растворителя и в случае необходимости 2,2 -азобисизобутиронитрила и при неоЬходимости последующее формилирование образовавшегося й-дес" метиллейрозина.
Пример 1. N-Десметил-М-формилвиндолин
2,00 r (4,38 мол) виндолина раст" воряют в 200 мл безводного дихлорметана, затем этот раствор соединяют с 50 г активной окиси марганца (1Ч).
Реакционную смесь выдерживают в атмосфере азота в течение 10 ч при
0"5 С, затем фильтруют. Окислитель, остающийся на фильтпе, промывают
100 мл дихлорметана. Промывную жид- кость собирают вместе с фильтратом и испаряют при пониженном давлении.
Остаток, оставшийся после испарения, очищают методом послойной хроматограФии (адсорбент:силикггель:растворитель:смесь дихлорметана и ацетона в соотношении соответственно 100:10, элюент:ацетон). Из слоя, отличающегося повышенной удерживающей способностью, получают 0,5 r (253) непрореагировавшего виндолина; этот виндолин .после перекристаллизации из этанола
3 1055 можно использовать в качестве исходного продукта. Элюат, полученный из слоя с ацетоном, имеющего пониженную реак ионную способность, сушат и оса- док.растирают с эфиром; получают
0,7 г N-десметил-N-формилвиндолина (24,04); продукт, кристаглизованный иэ эфира, плавится при 140-144 С. о
Пример 2. N-Десметилвиндолин, 540 г (l 19 ммоль) N-десметил- 10
-Н-формилвинрслина в атмосфере азота растворяют при 0 С в 110 мл метанольной 103-ной соляной кислоты..В течение 3 ч раствор выдерживают при 5-10 С далее с помошью метанольного 10 "ного ls аммиачного раствора устанавливают зна. чение рН 7. Нейтрализованный раствор. при низком давлении испаряют до объема 20 мл и к остатку добавляют 30 мл ледяной воды, а далее с помощью раз" уО бавленного водного раствора гидрооки" си аммония (1:1) устанавливают значение рН 9. Полученный щелочной раствор экстрагируют троекратно 20 мл дихлорметана (каждый раз по 20 мл)., opra- p нические экстракты очищают, сушат с помощью сернокислого магния, фильт" руют и фильтрат выпаривают при пониженном давлении. Остаток кристаллизуют из 10 мл эфира, получают 400 мг
g-десметилвиндолина (78,73 ). Т.пл. fl8 С(из эф11ра).
Пример 3.N -Десметилвиндолин
Обработку производят, как и в примере 2 с той лишь разницей, что гид". ролиэ проводят в присутствии воднои
2i-ной серной кислоты вместо соляной, при 5ОС. Выход М -десметилвиндолина составляет 79,13.
fl р и и е р "- N -Десметил-3
-ангидровинбластин.
340 мг (1,01 ммоль ) катарантина растворяют в 17 мл безводного дихлоро метана. Раствор охлаждают до -lO С и при помешивании в азотной атмосфере в течение 15 мин вводят в раствор 4
240 мг 823-ной перпеларгоновой кислоты (1, 1 экв) в 3 мл дихлорметана.
Смесь охлаждают до -15 С, смешивают с 442 мг (1, 0 ммоль И -десметилвиндо-! лина с 0 82 мл (5 8 ммоль) свежепере- SO гнанного трифторуксусного ангидрида.
Смесь реагентов выдерживают в течение 18 ч при температуре между -10 и -20ОС, затем в смесь добавляют раствор из 140 мг натрийборгидрида в 14 мл безводного метанола при -10 С. Тече-о ние реакции контролируют посредством послойной хроматографии (адсорбент:си-.
333 4
1 ликагель:растворитель:смесь дихлорметана и метанола в соотношении соответ ственно 20:2). По окончании реакции смесь концентрируют на четверть объема при 20ОС. Остаток промывают 15 мл дихлорметана и потом с помощью разбавленного в соотношении 1:1 водногораствора гидроокиси аммония устанавливают значение рН 9. Фазы разделяют, органическую фазу дважды-.экстрагируют по 10 мл воды, водную фазу собирают . и дважды экстрагируют по 10 мл дихлорметана. Дихлорметановые фазы сушат с помощью сульфата магния, фильт." руют и фильтрат выпаривают при пониженном давлении. Выпаренный остаток очищают посредством послойной хрома-. тографии (адсорбент, растворитель и, элаент те же, что и в примере 1).
Элюат, получаемый из ацетона и содер" жащий продукт, выпаривают и остаток перекристаллизовывают иэ метанола, получают 315 мг й-десметил-3;-4 -ан1 гидровинбластина (40 23 от теории); т.пл. 202-204 С; (м) = +38,5©С (c = 1,06 в хлороформе).
Вместо N-десметилвиндолина при использовании эквивалентного количества виндолина выход 3,4 "ангидро".
Ф винбластина составляет 503. T.пл, -215-216ОС;(оЯ = +71 С (c = 0,7 в хлороформе).
Пример 5. И -Десметил-31,4ан гид ровинбластинсульфат
0,1 г N-десметил-3,4 -ангидро" винбластин суспендируют s 1 мл безводного метанола, далее добавляют метанольную 14"ную серную кислоту до достижения рН 5. После добавле", ния 3 мл эфира образуется кислая аддитивная соль. Полученные кристаллы отфильтровывают и сушат, Й"десметил-3",4 -ангидровинбластинсульфат пла1 вится при ?10 С. Выход составляет
95 от теории.
Пример б.й -Десметил. К-формиллейрозин.
100 мг (0,0124 смоль) М "десметил-N-формил-3,4 -ангидровинбластина растворяют в 3 мл бензола, далее к раствору добавляют 4 мг 2,2 "аэобис-изобутиронитрила. Смесь охлажда" ют до 0-5 С, потом добавляет раствор из 160 мг {0,75 ммоль) 70>-ного кумилгидроперекиси в 1 мл бензонитрила при перемешиванйи в атмосфере азота. Смесь реагентов выдерживают в токе азота 4 дня при 5-10 С, добйво ляют б мл бензола и далее смесь
1055333
Составитель Т. Левашова
Редактор А. Цолинич Техред M.Tenep Корректор A. Ильин
Заказ 9135/60 Тираж 418 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035 Москва Н«35 Раивская наб. д. 4/5
» ««» «ъ»Г» Й»» » «й».Л «««««»««» 8
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4 при 0-50С трижды экстрагируют водным
53-ным раствором серной кислоты в количестве 5 мл. Фазы разделяют, водно-кислую фазу смешивают с 2 мл бензола и фазы опять разделяют. С по- 5 мощью концентрированной водной гидроокиси аммония при 0 С значение рН водной фазы устанавливают 9. Полу" ченный щелочной раствор трижды экстрагируют дихлорметаном по 4 мл каждый 1ц раз, органические фазы объединяют, сушат и выпаривают при пониженном дав» пении, продукт кристаллизуют из 1 мл .метанола. Выход И-десметил-М-Формил" лейроэина-55 мг (543 от теории), И т.пл. 203"С.(0(0, = +79,5 С (с 0,60 в хлороформе).
Пример 7. М-десметиллейро. эин.
100 мг {0,128 .смоль) й"десметил- 20
-3,4 -ангидровинбластина растворяют в 3 мл безводного ацетонитрила, к раствору добавляют 29,0 мг(0,25 ммоль) . трифторуксусной кислоты и 4 мл 2,2 "
-азобис-иэобутиронитрила. Смесь реа" 25 гентов охлаждают до 0-5 С, далее сме" шивают при перемешивании в атмосфере азота с раствором 160 мл (0,75 ммоль)
703-ной кумилгидроперекиси в 1 мл безводного ацетонитрила. Реакционную 30 смесь выдерживают в токе азота в те" чение 22 ч,.разбавляют 6 мл безводного бензола.. Полученный продукт выкристаллизовывается из 1 мл метанола, кристаллы отделяют. и сушат, получают
40 мг й-десметиллейрозина. Из метанолъного маточного раствора путем препаративной хроматографии послойного разбавления (адсорбент и растворитель те же, что и в примере 1), получают 10 .мг продукта. Общий выход продукта 50 мг (484 от теории). Т.пл221оС (иэ метанолаЦ о = +49,7 С (с = 0,98 в хлороформе), Пример Я Я Десметил- И ф„р миллейрозим.
1 r В"десметиллейрозина растворяют в смеси b мл концентрированной муравьиной кислоты и 1 мл уксусного ангидрида, в течение 10 мин раствор оставляют при комнатной температуре.
Далее в смесь вводят 30 мл холодной воды с температурой 0-5 С, затем при, перемешивании вводят также холодный водный раствор гидроокиси аммония до достижения рН 9. Полученную щелочную смесь трижды экстрагируют дихлорметаном в количестве 30 мл. Органические экстракты собирают, су«. шат и выпаривают при пониженном давлении, получают 995 мг М-десметил"
-М-формиллейрозина.
П р и и е р 9. О, 1 r и -Десметил"И-Формиллейрозина растворяют в 0,5 мл безводного этанола, далее добавляют этанольный 14-ный раствор серной кис" лоты до достижения рН 4. Смесь выдерживают несколько часов при комнатной температуре, потом кислую аддитивную соль отфильтровывают и сушат. Температура плавления полученного N-десметил"й-формиллейрозинсульфата составляет 248-252 С; его выход 933, A р и м е р 10. 100 мг (0,128 ммоль)й-Десметил.3,4 -ангидровинластина растворяют в смеси
3 мп безводного ацетонитрила и 0,15 мл безводного бензола и к раствору добавляют 29,0 мг (0,25 ммоль) трифторуксусной кислоты и 4 мг (0,02 ммоль)
2,2> -азо-бис-изобутиронитрила. Смесь охлаждают до 0-5 С и в токе азота при
О перемешивании к ней добавляют раствор
80 мг 804-ной гидроперекиси трет.-бутила (0,7 ммоль) в 0,5 мл ацетонитрила. Реакционную смесь перемешива" ют при комнатной температуре 8 ч и затем выдерживают при - l5OÑ 14 ч. Содержащий кристаллический продукт раст вор отфильтровывают, кристаллы про" мывают 0,5 мл охлажденного до 0 С ацетонитрила и сушат. Получают Ц мг
11-десметиллейрозина. фракция 11 . Иаточный раствор упаривают при 20вС при пониженном давлении до обьема
0,5 мл, остаток выдерживают при -15ad
24 ч, затем выпавшие кристаллы отфильтровывают, промывают ацетонитри" лом или метанолом и сушат. Получают мг десметиллейрозина Фракция 2 . Общий выход 54 мг десметил-,. лейразина (51,83 от теории).