Способ вольтамперометрического определения теллура
Иллюстрации
Показать всеРеферат
69l (П), 3(Д) G 01 М 27/48
|-Т
Т
ОПИСАНИЕ ИЗОБРЕТЕНИЯ:
Н АВТОРОНОНН CCAKCTCllhCTBV
-О И -4М г -т
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЬПЪЮ (21) 3456174/18-25 (22) 05.04.82 (46) 0. .12 ° 83. Бюл. В 45 (72) Х.З. Брайнина, A.Â. Чернышева и Н.Ю. Стожко (71) Свердловский институт народного хозяйства (53) 543.257(088.8) (56) 1. Нейман Е.Я. и др. Некоторые особенности определения мышьяка, селена и теллура методом инверсионной вольтамперометрии на графитовых электродах. "Журнал аналитической химии", 1975, т. 30, с. 1132-1137.
2. Торопова- В.Ф. и др. Концентрирование и вольтамперометрическое:
-определение селена и теллура с испольэованием окислительно.-восстано- . вительных и каталитических процессов на стационарном ртутном микроэлектроде. "Журнал аналитической химии", 1980, т. 35, с. 296-300 (прототип ). (54 ) (57) СПОСОБ ВОЛЬТЪМПЕРОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ ТЕЛЛУРА, включающий концентрирование теллура (Ч) на поверхности электрода в присутствии реагента комплексообраэователя в электролите с последующим превращением концентрата, о т л ич а ю шийся тем, что, с целью повышения чувствительности определения, электролиэ проводят в две стадии соответственно при потенциале (-0,5 )- (-0,6) В и (-0,33 )- (-0,35) В в электролите, содержащем (0,6-2,5 ) 10-ЗМ Hg (NO 3)2 и (0,4-0,8 ) M K3, а электрохимическое превращение.концентрата ведут прн катодной поляриэации электрода от (-0,33)-(-0,35 )В Е
1059501
Изобретение относится к аналитической химии, в частности к способам определения, и может быть использовано при определении микроколичеств теллура в природных (речных, морских, минеральных ), промыш- 5 ленных и сточных водах, реактивах.
Известен способ электрохимического определения теллура на твердых электродах. Теллур накапливают в результате катодно о восстановления его до элементного состояния на золотом, платиновом или графитовом электродах в растворе хлористоводородной кислоты. Обязательным условием использования графитового электрода в известных методах является введение в анализируемый раствор ионов меди, золота, платины, палладия. В качестве источника информации используют анодные поляризационные кривые окисления осадка, образованного на электроде Ã1 .
Недостатком этого способа опреде- ления теллура является использование дорогостоящего материала для электрода золото, платина . Если же применяют графитовый электрод, то чувствительность теллура значительно уменьшается.
Кроме того, такой способ требует отделения теллура от многих .элемен- ЗО тов, в том числе от ртути (IT), так как ток окисления теллура находится в области потенциалов электрорастворения ртути.
Наиболее близким техническим ре- 35 шением к предлагаемому является способ вольтамперометрического опре- . деления теллура, включающий концентрирование теллура (IV) на поверх-. ности электрода в присутствии реаген-4О та комплексообразователя в электролите с последующим превращением концентрата j 2 g.
Известный способ включает следующие операции: создание рабочей поверхности электрода (ртутной капли ); продувание анализируемого раствора током аргона или водорода (для удаления кислорода из раствора )) концентрирование теллура в элементном виде на электроде из раствора 50
3 M НСЙ. или 2 М Н2S04+ 1 М К3 при разомкнутой цепи; промывание электрода с осажденным на его поверхности теллуром (О ) перенос электрода в другой раствор (1 M НВОН),.в кото- 55 ром производят электрохимическое определение теллура; электрохимическое определение теллура согласно реакции
Те + 2 е w Те .
Недостатком этого способа являет« ся низкая чувствительность минимально определяемая концентрация составляет лишь W 10 М Te(IV), так как степень концентрирования определяется равновесием окислительно-восстановительной реакции взаимодействия теллура (Iv) co ртутью (О ), Цель изобретения — повышение чувствительности определения.
Постановленная цель достигается тем, что согласно способу вольтампе- рометрического определения теллура, включающему концентрирование теллура (IV) на поверхности электрода в присутствии реагента комплексообразователя в электролите с последующим превращением концентрата, электролиз проводят в две стадии соответственно при потенциалах (-0,5 ) - (-0,6 ) В и (-0,33 ) -(-0,35 )В в электролите, содержащем (0,6-2,5 )-10 М Hg (NO >)> и (0,4-0,8)М К3, а электрохимическое превращение концентрата, ведут при катодной поляризации электрода от (-0,33 ) - -0,35 ) В.
Предварительная обработка электрода при потенциале (-0,5 ) -(-0,6 ) В приводит к тому, что на поверхности графита осаждаются атомы ртути, необходимые для концентрирования теллура.
Уменьшение концентрации иодида калия с 1 M до (0 4-0,8 ) M и кислотности раствора с 3 М до 1,5 М, введение дополнительно азотнокислой ртути (11 ) в количестве (0,6-2,5 ) 10 М, а также проведение электролиза два раза позволяет увеличить чувствительность определения теллура до. 5 10 >M.
Для выбора оптимальных концентраций выбранного состава раствора в данном способе проведены следующие исследования.
Графитовый электрод прляризуют при потенциале предэлектролиза Ч„ в течение 1,5-2 мин в перемешиваемом растворе с целью осаждения атомов ртути на поверхности электрода. Затем, не прекращая перемешивание, проводят электролиз этого раствора при потенциале Ч2 в течение определенного времени в зависимости от концентрации теллура (1Ч) в анализируемм растворе. Перемешивание выключают и регистрируют катодную поляризационную кривую с потенциала
Ч2 до (-0,9 ) В со скоростью развертки 80 MB/c. Используют среднее из 3-5 измерений значение аналитического сигнала.
Необходимым условием получения сигнала теллура является наличие в растворе следующих компонентов: азотнокислой ртути (I1 ), иодида калия, хлористоводородной кислоты.
Оптимальными условиями концентрирования и электрохимического определения теллура (.IV) согласно полученным экспериментальным данным являются потенциал предэлектролиза
М., -" (-0,5. )- (-0,6 ) В, потенциал
1059501 электролиза V =(-0,33 ) -(О, 35) В концентрация .хлористоводородной кислоты 1,5 М, концентрация азотнокислой ртути (1I} (0,6-2,5)10 М, концентрация иодида калия (0,4-0,8 } M. Аналитический сигнал зави- . 5 сит от времени предэлектролиза при потенциале .,Ч . В дальнейшем для разных диапазонов концентраций теллура (1Ч) в анализируемом растворе используют время предэлектролиза . 10 при потенциале Ч„ 2-5 мин.
Прямопропорциональная зависимость аналитического сигнала от концентрации теллура (?Ч ) в растворе наблюдается в диапазоне концентраций от 15
5-10= 0 о 10 M
Определению теллура (IV) предлагаемым способом не мешает присутствие растворе Со (II}, Сг (VI}, Сг (III ), ge (ll }, Fe (ТIIJ, Fe (II ), О
Zn (II}, Ag (I }, Ч (Y}, Mg (11}, М. (II}, Mo (VI}, Ni (11}, (1000:1}, И (II}, Cd (Il}, (500:1).
Предлагаемый способ концентрирования и электрохимического определения теллура (1Ч),благодаря низкому пределу обнаружения и высокой избирательности может быть полезен для анализа приводных вод. Возможности его проверены на примере определения концентрации теллура (IV) в питьевых водах БАМа, нормируемых по санитарно-токсикологическому признаку вредности, а также в питьевой водопроводной воде r. Свердловска.
Пример. В лабораторных ус- 35 ловиях приводят концентрирование и электрохимическое определение тели лура при исследовании воды
r. Свердловска.
Для этого 5 мл исследуемой воды 4р помещают в электролизер. Добавляют
2,5 мл б M раствора хлористоводородной кислоты, в качестве реагента комплексообразователя берут 0,5 мп
РаствоРа Hg (NOg )> с. концентрацией 45
10 г/л и 0,8 мл 8 M К 3 общий объем пробы доводят до 10 мл водой, что соответствует концентрациям
1,2 10 .> М ртути (II} и 0,5 М К 3.
Электрод предварительно поляризуют при потенциале (-0,6 } В в течение 2 мин в анализируемом растворе,. а затем проводят концентрирование теллура при потенциале (-0,33 )— (.0,35 ) В в течение 10 мин в том же растворе при перемешивании. Выключа- 55 ют перемешиватель и через 15 с регистрируют катодную поляризационную кривую при линейно изменяющемся во времени потенциале в интервале (-0,33 ) -(0,35 } В, измеряя величину 60 максимальному катодного тока, которая прямопропорциональна концентрации теллура в растворе.
Содержание теллура определяют методом добавок или по градуировочному графику с учетом содержания теллура в реактивах. Концентрация теллура в анализируемой питьевой воде равна 9,4.10 « r-ион/л.
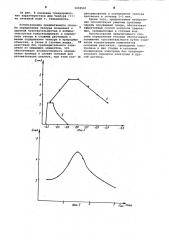
На фиг. 1 показаны поляризационные кривые, полученные в растворах.
Кривая 1 1,5 М HC1 + 2 ° 10 gr-ион/л
Те (1V); кривая 2 1,5 М НС1 +
2"10 г-ион/л Те (1Ч) + 0,4 М К7 кривая 3 1,5 М НС1 + 1,25"10 М
Hg (NO >)q + 2 10 6 г-ион/л Те; кривая 4 1,5 M HC1 + 1,25 10 З М
Н (ЮО + 0,4 М K3 + 2 ° 10 r-ион/л
Те (IV).
Потенциал предэлектролиза
O „= — 0,9 В; время предэлектролиза (i,)= 3 мин; потенциал концентрирова» ния (9>} = — 0,35 В; время электролиза (i} = 3 мин.
На фиг. 2 показана зависимость seличины тока электровосстановления теллура от потенциала Ч и Ч в растворе, содержащем 1,5 М НС1 +
0,4 М.К 3 + 1,25 10 M Hg(NOg)q+
+ 2 10 г-ион/л Те (IV);, = 3 мин, % = 3 мий.
Кривая 5 Ч„ = — 0,9, Ч2 = х
Кривая б .Ч.,; — Х, Ч = -0,5 В.
На фиг. 3 показана зависимость величины тока электровосстановления теллура от концентрации хлористоводородной кислоты в растворе, содержащем 0,4 M К 3 + 1,25 ° 10 з M . Hg(N03)>+
+ 2 .10 г-ион/л Te (IV );
-0,5 В, Ч. = -0,35 В;
Т = 3 мин, 1 = 3 мин.
На фиг. 4 дана зависимость величины тока электровосстановления теллура от концентрации азотнокислой ртути (П ) в растворе, содержащем
1,5 М HC1 + 0,4 К J + 2 ° 10 "r-ион/л Те, -0,5 В Ч1 — — -0,35  — 3 мин, Ф = 3 мин.
На фиг. 5 показана зависимость величины тока электровосстановления теллура от концентрации иодида калия в растворе, содержащем
1,5 М НС1 + 1,25 10 М Hg(NOg)2 +
2 10 г-ион/л Те (1Ч);
0,5 В, Ч2 = -0,35 В, — 3 мин; Ф, =. 3 мин.
На фиг. б показана зависимость величины тока электровосстановления теллура от времени предэлектролиза (t } при потенциале Ч„ в растворах следующего состава: 1,5 М НС1 +
1,25 10 ЗМ Hg(NOg)2 + 0,6 М К } +
+ 2-10 1 г ион/л Те (IV ), (g )
2 ° 10 Е г-ион/л Те (1Ч ) (2 }
2 10 г-ион/л Те (IV ) ° (3 }
На фиг. 7 изображена зависимость относительного стандартного отклонения от концентрации теллура в растворе, содержащем 1,5 HC1 + 0,6 М К +
+ 1,25 ° 10 ЗМ Hg(NO )
Ч, = -0,5 В; Ч = -0,3 В;
3 мин; 1 = 10 мин.
1059501
На фиг. 8 показана ™радуировочная характеристика для теллура (IV) на питьевой воде г. Свердловска.
Использование предлагаемого способа определения теллура позволяет с высокой чувствительностью и избирательностью концентрировать и определять теллур в сложных растворах с малым содержанием теллура в природных объектах, а также в сточных водах, реактивах беэ предварительного отделения от мешающих элементов, что обеспечивает экспрессивность определения таллура и служит основой для автоматизации анализа, при этом кон- !5
J, /ун,4 центрирование и определение теллура протекает в течение 3-5 мин.
Кроме того, предлагаемое изобретение способствует решению проблемы охраны окружающей среды, обеспечивая эффективный способ контроля природных, промышленных и сточных вод.
Использование предлагаемого способа определения теллура обеспечивает повышение чувствительности путем изменения концентрации компонентов основных реагентов, проведение электролиза в две стадии и катодной поляризации электрода беэ предварительного переноса электрода в другой раствор.
1059501
1059501
4 b 8 10 72
Фиг.b
$г Ф
1059501
f2 ОВ 04
Составитель И.Рогаль
Редактор A.ÌîòÛËü Техред С;Мигуноиа
Корректор A.Ïîâõ
Тираж 873 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, ж-35, Рауйская наб., д. 4/5
Закаэ 9822/49
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4