Способ определения активности протеаз
Иллюстрации
Показать всеРеферат
СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОС ТИ ПРОТЕАЗ, включаюиий инкубирование люциферазы совместно с протеа- ЗОЙ с последующим измерением умень- ; шения люциферазной активности образца и расчетом протеазной активности по константе инактивации люциферазы, отличаюшийс я тем, что, с целью повышения чувствительности способа, инкубирование люциферазы с протеазой осуществляют при температуре 17-21°С в течение 7-13 ч. 05 -чЛ 4
(19) (11), СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИН
Ц51) 0 01.)(33/48 (1 (САНИЕ ИЗОБРЕТЕНИЯ
ОПИ
ГОСУД-АРСТВЕННЬЙ HOMHTET СССР
ГО ДЕЛАМ ИЗОБРЕТЕНИЙ И (ЛНРЫТИЙ
Н АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21 ) 3345992/28-13 (22) 30.06.81 (46) 15.01.84. Бюл. 9 2 (72 ) Г.А. Кратасюк, В.Н. Петушков, Р..М. Фиш и И.И. Гительзон (71) Институт физики им. Л.В.Киренского .СО AH СССР (53 )а 577. 156 (088. 8) (56) 1. Федорова Л.Г. Лупова Л.М.
Уточ)(ение метода Фолп.-".Промьыленность товаров бытовой химии", 1976, )) 2, с. 17-18.
2. N)ns D., Baldmn T.О. Has-
tings 0.V. Asensitive assay for .p. roteolytisentymes using bac
terial lucifarase as à sabstrate.."Analyt Biochem"ъ 1974, 61, р.280. (54) (57) СПОСОБ ОПРЕДЕЛЕНИЯ AKTHBHOC
ТИ ПРОТЕАЗ, включающий инкубирование люциферазы совместно с протеазой с последующим измерением уменьшения люциферазной активности образца и расчетом протеазной активности по константе инактивации люциферазы, о т л и ч а ю щ и йс я тем, что, с целью повышения чувствительности способа, инкубирование люциферазы с протеазой осуществляют при температуре 17-210С в течение 7-13 ч.
1067441
Изобретение относится к биохимии и медицинской диагностике и предназначено для .:змерения следовых количеств ni аз, выделяемых из плазмы крови, а также иэ органов и тканей при медико-диагностическом и биохимическом исследовании. . Известен способ определения активности протеаз, включающий гидролиз белка казеината натрия препаратом фермента, который помещается в исследуемый .раствор, с последующей инактивацией фермента и осаждением непрогидролизованного белка трихлоруксусной кислотой. В полученном фильтрате определяют количество прогидролизированного белка по содержанию образовавшегося тироэина колориметрическим . методом с применением реактива Фолина. Протеолитическая активность препарата выражается в микромолях тирозина, образующегося в гидролиэате в.единицу времени (1 3.
Однако этот метод трудоемок, многостадиен, обладает малой чувствительностью и неприменим для оК рашенных, сильно поглошающих сред.
Наиболее близким к изобретению по технической сущности и достигаемому эффекту чвляется способ определения активности протеаз, включающий инкубирование люциферазы совместно с протеазой с последующим измерением уменьшения люциферазной активности инкубируемого образца и расчетом протеазной активности по константе инактивации люцифера(эы (2).
Недостатком данного способа является низкая чувствительность ! (20 кг протеазы на образец ).
Цель изобретения — повышение чувствительности способа.
Поставленная цель достигается тем, что согласно способу определения активности протеаэ, включающему инкубирование люциферазы совместно с протеазой с последующим измерением уменьшения люциферазной ак-. тийности образца и расчетом протеаэной активности по константе инактивации люциферазы, инкубирование люциферазы с протеазой осуществляют при температуре 17-21ОC в течение
9-13 ч. !
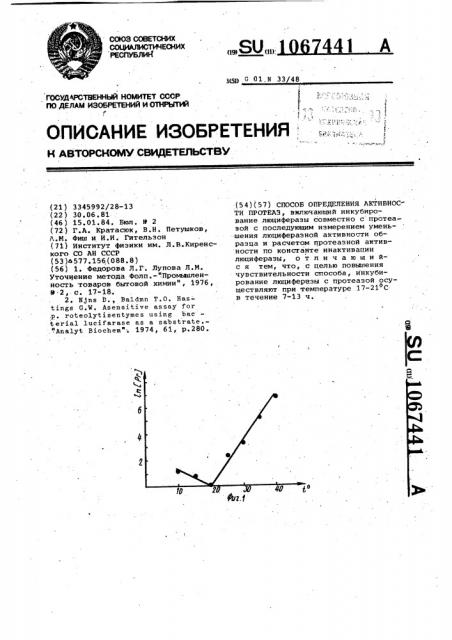
На фиг. 1 изображена зависимость предельной чувствительности метода от температуры, где по оси ординат отложены значения .натурального логарифма концентрации протеаэы (трип,син, нг/мл, по оси абсцисс — температура, на фиг. 2 - кривые изменения биолюминесцентной активности люциферазы в присутствии и отаутствйи протеазы (трипсин ), где по оси ординат показаны значения натурального логарифма интенсивности свечения в относительных единицах, по оси абсцисс - время в часах; на фиг. 3 - пературная зависимость минимального времени инкубирования препарата люциферазы с протеазой (трипсин, 5 нг/мп f.
Для определения активности протеаэы сливают вместе исследуемый раствор протеазы и препарат люциферазы. Полученный образец помещают в
10 термостат и отмечают время начала инкубации. В ходе инкубации через определенные промежутки времени про=изводят измерения биолюминесцентной активности образца, для чего из последнего отбирают аликвоты по 5 мкл.
Полученные данные представляют в виде графика, откладывая по оси абсцисс время в минутах, а по оси ординат натуральный логарифм интенсивности свечения. График представляет собой прямую линию, тангенс угла наклона которой к оси абсцисс соответствует константе инактивации люцифераэы. Константа инактивации люциферазы связана с.концентрацией протеазы в образце прямой пропорциональной зависимостью.
Для учета неспецифической инактивации люцифераэы измерения, аналогичные описанным, проводят
30 в отсутствии протеазы.
За предельную чувствительность метода принимают концентрацию протеазы, дающую. константу инактивация люциферазы, превышающую на
35 50% константу неспецифической инактивации. Измеряют предельную чувствительность способа при разных температурах (фиг. 1! . Максимальная чувствительность наблюдается в
40 интервале от 17 до 21 С.
Минимальное время совместного инкубирования люцифераэы с протеаэой при данной температуре определяется следующей формулой:
45 En—
3
О
kTp KÔ где Эо — активность люцифераэы в начале инкубирования;
3 — активность люциферазы через время t после начала инкубирования;
К вЂ” константа инактивации тр люциферазы при данной .температуре в присутствии протеазы, К вЂ” константа инактивации люцифераэы при данной температуре в отсутст60 вии протеазы..
Принимая во внимание, что ошибка в измерении активности люциферазы составляет +5%, очевидно, что ,достоверно отличающиеся значения
65 получаются только в том случае, ес- .
1067441
Учитывая значение констант инак!
О тивации для температурного диапазона 17-21РС, минимальное необходимое время совместного инкубирования составляет 9-13 ч.
Концентрация препарата люциферазы 50 мкг/мл. Уменьшать концентрацию препарата люцифераэы не следует, так как это приводит к уменьшению светового сигнала ниже уровня: чувствительности прибора. Увели- 20 чивать концентрацию препарата выше
100 мкг/мл также нецелесообразно, так как при этом не происходит увеличения чувствительности метода, расход препарата увеличивается. 25
П.р и м е р 1. В качестве протеазы используют сухой препарат трипсина иэ поджелудочной железы быка с удельной активностью 40 ед. на
1 .мг препарата ("Serva" ФРГ) и час- g0 тично очищенный препарат люцифераэы иэ Photobacterium phosphoreum.
25 мкл раствора трипсина (10 нг/мл ) сливают с 25 мкл препарата люцифераэы (50 мкг/мл ) и помещают в термостат при 20рС, отмечая время начала инкубации. Через каждые 2 ч проводят измерения биолюминесцентной активности инкубируемо.го образца, для чего иэ последнего отбирают аликвоты по 5 мкл. 40
Для измерения биолюминесцентной активности используют следующую реакционную смесь: 50 мкл 0,0025%-ного раствора миристинового альдегида в дистиллированной воде; 5 мкл ин- 45 кубационной смеси; 445 мкл 0,1 M фосфатного буфра, рН 7,0.
В полученной смеси свечение инициируют быстрым добавлением 300 мкл
5 10 6М ФМН-Нг. Для учета неспецифической инактивации люцифераэы аналогичные измерения проводят в отсутствии препарата трипсина.
Кинетика уменьшения биолюминес-. центной активности образца в присутствии и отсутствии трипсииа при55 ,ведена на фиг. 2.
Константы инактивации люциферазы в присутствии и отсутствии трипсина составляют 4,.4 * 10 4 ми н " и
0,5 "10 мин " соответственно. При
17 С эти константы составляют
3,0*10 4мин "и 0,4 ° 10 4мин- 1, при
21РС вЂ” 4,45 10№мин " и 1,5 > 19 №мий..
Константы достоверно отличаются, поэтому можно сделать вывод, что 65
50 ли разница между этими величинами будет не менее 20%, т.е.Э)Зр с 0,8.
Следовательнс., формулу для опреде.— ления минимального времени совместного инкубирования можно переписать в следующем виде: 5 чувствительность метода позволяет обнаруживать трипсин при концентрации 5 нг/мя или с .учетом объема образца (0,05 мл) — 0,25 нг трипсина на иробу
II р и м е р 2. 25 мкл раствора трипсина (10 нг/мл) сливают с
25 мкл препарата люциферазы . (50 мкг/мп) и помещают в термостат, отрегулированный на температуру
17 С, отмечая время начала инкубации. о
Через каждые 2,5 ч проводят измерения биолюминесцентной активности инкубируемого образца в течение
13 ч, для чего из последнего отбирают аликвоты по 5 мкл.
Для измерения биолюминесцентной активности используют следующую .реак-,. ционную смесь. 50 мкл 0,0025%-ного раствора миристинового альдегида в дистиллированной воде; 5 мкл инкубационной смеси, 445 мкл 0,1 М фосфатного буфера, рН 7,0.
В полученной реакционной смеси свечение инициируют быстрым добавлением 300 мкл 5 ° 10 М ФМН-Н .
Для учета неспецифической инакти вации люциферазы аналогичные измерения проводят в отсутствии препарата трипсина..
Константы инактивации в присутст-вии и отсутствии трипсина составляют
3,0 10 4 мин "и 0,4 . 10 4 мин "cooTветственно.
Пример 3. Полученную инкубационную смесь помещают в термостат при 20 С и отмечают время начала инкубации. Через каждые 2 ч проводят измерения биолюминесцентной активности инкубируемого образца в тече ние 10 ч. Для учета неспецифической инактивации люциферазы аналогичные измерения проводят в отсутствии препарата трипсина.
Константы инактивации. в присутствии и отсутствии трипсина составляют 4,4-10 4мин "и 0,5 10 №мин соответственно. Чувствительность. метода 0,25 нг трипсина на пробу.
Пример 4. Полученную инкубационную смесь помещают в термостат при 21рС и отмечают время начала инкубации. Через каждые 1,5 ч проводят замер биолюминесцентной активности инкубируемого образца в течение 11 ч. Для учета неспецифической инактивации люциферазы аналогичные измерения проводят в отсутствии препарата трипсина.
Константы инактивации в присутствии и отсутствии трипсина составляют
4,45 ° 104мин " и 1,5 ° 10 4мин-1, Чув-. ствительность метода 0,25 нг трипсина на пробу.
Таким образом, предлагаемый спо.соб позволяет повысить чувствитель ность определения активности протеаз на два порядка за счет изменения усло-. вий инкубации протеазы с люциферазой.
1067441
t,юане икр
Составитель С. Каспаров
Редактор М. Петрова Текред Й..Кастелевич! KoppeKTop S °
Заказ 11203/49 Тираж 828 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4