Макрогетероциклическое соединение в качестве промежуточного соединения для синтеза макрогетероциклических металлохелатов
Иллюстрации
Показать всеРеферат
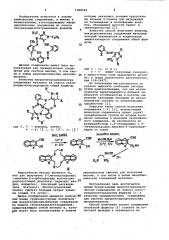
Макрогетероциклическое соединение формулы К Y 9П5 СНз II 1Г с (О (Л в качестве промежуточного соединения для синтеза макрогетероциклических металлохелатов.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК (19) (11) 3(51) С 07 D 487 12; С 07 . F 15/04
° юлю
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTOPCHOMY СВИДЕТЕЛЬСТВУ
> <()>s 3 к (5 XH M
I 6 4
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3422389/23-04 (22) 12.04.82 (46) 23.01.84. Бюл. )) 3 (72) В. М. Дзиомко, В. К. Вигран, Л. В. Шмелев, Г. М. Адамова, P. В.Попонова и Ю. С. Рябокобылко (53) 541.572.54:547.898(088.8) (56) 1. Авторское свидетельство СССР
)) 450816, кл. С 07 F 15/04, С 07 F 15/06, 06. 04. 73.
2. Дзиомко В. N. Нетрадиционные азотистые макрогетероциклические системы с высокой степенью сопряжения.
ХГС, 1Э82, Р 1, с. 3-18.
3. Gri ffiths D° .,, Hull B. Synthesi of à Tetraazacyclotetrasecasine
and à Pentaazacyclotetradecatriene.
Hetегоcucl. Chem, 1977, 14 (6), р. 1097-1100.
4. Авторское свидетельство СССР
)) 910619, кл. С 07 D 231/38, G 03 С 1/72, 31.08.78. (54 ) МАКРОГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ В КАЧЕСТВЕ ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ. ДЛЯ СИНТЕЗА МАКРОГЕТЕРОЦИКЛИЧЕСКИХ МЕТАЛЛОХЕЛАТОВ (57) Макрогетероциклическое соединение формулы в качестве промежуточного соединения для синтеза макрогетероциклических С металлохелатов.
10б8440
Изобретение относится к новому химическому соединению, а именно к безметальному аэотсодержащему макроциклическому соединению из класса гексаазациклотетрадецинов формулы
Мф М
М-С,К, ski
Данное соединение может быть использовано как промежуточное соединение для синтеза многих, в том числе и новых макроциклических металло- 2 хелатов.
Известны макрогетероциклические соединения металлов иэ класса гексаазациклотетрадецинов общей формулы
К 2 которые оказались ценными красителями зеленых оттенков для материалов из полиамидных и полиэфирных волокон, обладающих высокой термо- и светопрочностью 511.
Известен способ получения хелатнь. макроциклических соединений металлов который заключается в конденсации аминогалоидного соединения общей формулы
10 г
Я=Му-(HKg N
l где Х - Cl-, 3r и
R †. R имеют указанные значения, в присутствии соли переходного металла, в среде апротонного растворителя, при 130-160 С.
Иэ полученных металлохелатов не удалось выделить .свободные.лиганды
5 путем деметаллиэации, так как металлохелаты характеризуются болвшой химической устойчивостью и поэтому выделение свободньж лигандов нэ металлохелатов связано со значительными трудностями 21.
Известен также способ получения соединения (IV) (3l, использующий известную подвижность алкил (арил) сульфонильной группы во втором положении хинолина в реакциях нуклеофильного замещения. Он заключается во взаимодействии 1,2-зтандиамина с 2(метилсульфонилi.õèíîëèí Ç-карбальде-.. гидом по схеме !
Ц
° "Ы г . к-М
Пе риодст юмРиЦ
Net, ДМФА и Ê
Недостатком, метода является то, что для получения 2-(метилсульфонил)
-хинолин-3-карбальдегида используют дорогостоящие реагенты (периодат иат-55 рия, иодметан), токсичный растворитель 9еетанол). Многоступенчатый синтез требует больших затрат времени (caaaae 3-х суток). целью изобретения является получе- 60 ийе ранее труднодоступных безметальных макрогетероциклических соединений иэ класса гексаазациклотетрадиенов, представляющих собой интерес-и, кото«ве могут быть использованы в. тонком где В, R — водород, алкил;
М вЂ” Ni (Ié l), Cu (Я ), Co (ц ) органическом синтезе для получения многих, в том числе и новых макроциклических соединений металлов.
Поставленная цель достигается новым безматальным макрогетероциклическим соединением из класса гекса азациклотетрадиенов формулы (7.) в качестве промежуточного соединения для синтеза махрогетероциклических металлохелатов.
Способ получения нового соединения указанной формулы () основан на известной реакции и заключается во
1068440
1 нзО О О
СН Э 06Ú К-Ю г
Ф
N
ci, N —.И
СН3 СВ,й5
Э
ЩОЗО,О
Ю щ 15
МН2
Ме
„Qw-ãê и (Ъ Я
Ph
М(ОЛС)2
gan9A, К2СО
N= Ni (2); Си(П) взаимодействии высокореакционноспособного бис-кватернизованного аэогетероциклического соединения (V) Способ обычно проводят в среде апротонного растворителя при нагревании, желательно при 130-140 С, в течение 5-7 ч, без применения или с применением соединений основного характера с последующим выделением целевого продукта известными приемами. В качестве соединений основного характера используют карбонат калия или триэтиламин. Одновременно с реакцией циклозамыкания происходит реакция деалкилирования с образованием незаряженного лиганда типа Н L
Пример 1. Синтез 1,8,9,20-тетрагидро-3, б-диметил-1,8-дифенил-дибенэо 5с, m1äèïèðàçoëo (3,4-f:
4,3 - j) C1, 2, 5, 8, 9, 12) гексаазациклотетрадецина (1) с применением в ка- З5 честве основания карбоната калия.
066 г (0001 моль) (V) 021 г (0,001 моль) (V) ), 0,55 r 0,004 моль
К СО в 8, 0 мл диметилформамида нагревают с перемешиванием при 130- 40
140 С в течение 5 ч, Ход реакции контролируют TCX на пластинах Hilufol
UV-254, элюент — хлороформ. После охлаждения реакционную смесь. фильтруют от осадка, осадок промывают 2- 45
3 мл диметилформамида.
Из объединенного фильтрата в вакууме отгоняют растворитель, остаток растворяют в .100 мл бенэола и хроматографируют на колонке с силикагелем (элюент — бензол). Собирают темно-коричневую зону, перекристаллиэо-. вывают из сухого ацетона, получают
0,1 г (20,08Ъ) (1 ), красно-коричневое кристаллическое вещество с т.пл.
265-266 С. Соединение. хорошо раство- ряется в хлороформе, . гексане, гептане, бензоле, толуоле, хуже — в ацетоне, этаноле.
Найдено, Ъ: С- 69,91; " 4,78;
N 25,30.
Сэ Н«н,ю
Вычислено, Ъ: С 69,80; Н 4,76;
N 25,44.
Масс-спектры: беэметальное макроциклическое соединение с молекулярной массой 550. Основные осколочные ионы отвечают фрагментам с "" 275, 261, 91.
ИК-спектры: 3316 см 9кН щд (3229 см цмсдяз
ПМР-спектр (Ю м.д- относительно
ТМС) 0,1 м раствор в CHC)-,; 3-СНЗPyi" 2,45 синглет (6Н) N-С Н 7,12мультиплет (10Н); (С .Н ) — отдельные мультиплеты 6,35, 6,76, 7,25, 7,64 8Н ; -NH-10,95 уширенный сннглет (1H); -NH- 11,75 уширенный синглет (1Н).
Беэметальное макрогетероциклическое .соединение нессиметрична,- поэтому
NH-протоны, попадающие в разные области магнитной анизотропии ароматических колец, дают два различных сигнала в ПМР. !
Пример 2. Синтез соединенио. (Ь ) беэ применения основания.
0 66 г (О 001 моль) {U)., ",.:1 г (0,001 моль) (Vl), 8,0 мл г:сметнлформамида нагреваю = в =;:. —.: ..::. - — .":.ем при 130-140 С в течеки= = ::-:. реакции контролируют "CX на г:.-:.=:.Нах
Silyfol UU-254,. =-асиент — хлор форм, После охлаждения реакционную с:есь фильтруют от осадка
2-3 MJI диметилфор ..a:" .: 1!::. =:i F диненного фильтрата в ва<уу:;:;. отгоняют растворитель, ос =- -.-, .:;., :::=..:граФируют на колонке с силикагелем {злюент — бензол) . Соб .;;..-— невую зону, перекрис таллизовывают иэ ацетона, получают 0,06 г (12,05%) (4)
Из полученного соединения могут быть получены соответствующие металлохелатные комплексы в более благоприятных условиях по сравнению с темплейтным синтезсм.
Так, известны соединения формулы (Yll ) и (VRI. ), полученные в ходе темплейтного синтеза
106844 О
Данные по ИК-спектрам, УФ-спектрам, ЯМР- Н- и " C-спектрам (соединение VII ) также подтверждают идентичность ссединений. 55
Для макрогетероциклических соединений переходных металлов, полученных темплейтной циклиэацией, круг металлов ограничен. Известны металхюхелаты Cu (II ), Ni (II ), Pd (5 ), 60
Co (5 ), pt (Н ). Новый квадридентатный макрогетероцйклический лиганд позволяет расширить круг металлов. и получить ранее. недоступные комплексные соединения.
Данные соединения нашли применение в качестве фотопроводящих материалов (41. Проведение реакций требует жестких условий: температура 140-150 С, время реакции б и 13 ч, необходимо
5 применение К СО3. Выход макрогетероциклических продуктов низок .
Новый макрогетероциклический свободный лиганд (1 ) образует соединения (VII ) и (Ч Л ) при .комнатной температуре с количественным выходом.
В таблице сопоставлены данные по получению макрогетероциклических соединений темплейтным синтезом и на основе макрогетероциклического свобод ного лиганда, 15
Идентичность макрогетероциклических соединений Ni (II ) и Си (11 ), полученных на основе соединения (ь) и полученных ранее, в ходе темплейтного синтеза подтверждена данными 20 элементного анализа, масс-спектрами.
Соединение (ч?)
Найдено, Ъ: С 62,7; Н 3,9,.
N 23,2; Ni 9,5.
СЯ Н2м,Н о Ni 25
Вычислено, Ъ: С 63, О; Н 4, О;
N 23,2; Ni 9,8.
Масс-спектры: как и следует для комплексных макрогетероциклических соединений с фенильным заместителем в пиразольном ядре, осколочные ионы практически отсутствуют, наблюдаются только пики молекулярного иона с молекулярной массой 606 (по изотопу никеля 58). Распределение интенсивностей в молекулярном ионе подтверждает наличие атома никеля.
Соединение (VII)
Найдено, Ъ: С 62,4; Н 3,9;
N 23,1; Си 10,8.
С»Н, N» Cu
Вычислено, Ъ: С 62 8; Н 3,9;
М 22,9; Си 10,4.
Присутствие атома меди идентифицируется по изотопной распространенности пиков в молекулярном ионе, а 45 отсутствие интенсивных фрагментов этого соединения характерно для распада комплексных макрогетероцикличес. ких соединений, имеющих в качестве заместителя в пираэольном ядре Ph. 50 Пример 3. Синтез 1,8,9,20-тетрагидро-3 б-диметил-1,8-дифенил
-дибе нэоГс, mi дипиразоло 3, 4- Г: 4, 3 j) 53,2, 5,8, 9,123гексаазациклотетрадецината Ni (П ) {VB ).
0,11 г. (0,0002 моль) соединения (1), О, 05 г (О, 0002 моль) Ni(CE!>COO> х 4Н О в 20 мл ДМФА перемешивают при комнатной температуре в течение 12 ч. Сразу наблюдают образование целевог0 продукта (контроль реакции осуществляют тонкослойной хроматографией). Затем в вакууме отгоняют растворитель. Остаток растворяют в 2030 мл бенэола, наносят на колонку с
SiO в бензоле. Элюент:бензол. Собирают зелено-коричневую зону, перекристаллизовывают из смеси ацетон бензол, получают 0,115 г {95,83) (И1 ), темно-зеленое кристаллическое вещество, растворимое в бензоле, хлороформе,,диметилформамиде, диметилсульфоксиде, плохо растворимое в ацетоне, спиртах и нерастворимое в воде.
Пример 4. Синтез 1,8,9,20тетрагидро-3,б-диметил-1,8-дифенилдибензо{.с, и1дипиразоло(3,4-f:4,.3 —
J1 t1,2,5,8,9,121гексааэациклотетрадецината Cu { II ). (VHl ), !
0,11 r (О, 0002 моль) соединения (1), 0,04 г (0,0002 моль) Си(СН С00)
Й Н О в 14 мл ДМФА перемешивают в течение 5-10 мин при комнатной температуре. Реакцию контролируют тонкослойной хроматографией. В вакууме отгоняют растворитель . Остаток растворяют в 15-20 мл бензола, наносят на колонку с SiO в бензоле. Элюент: хлороформ. Собирают темно-коричневую зону, перекристаллизовывают Hз аце-тона, получают 0,12 r (98,1%) (".Л ) темно-коричневое кристаллическое вещество растворимое в хлороформе, бензоле, диметилформамиде, четыреххлорис-том углероде и нерастворимое в воде, Пример 5. Синтез 1;8,9,20-тетрагидро-3,б-диметил — 1,8-дифенилдибензо с, п1дипиразоло 3,4-f:4, 3
i g 1, 2, 5,8, 9, 121 гексаазациклотетрадецината Еп (n ) (Ix) .
0,11 r (О, 002 моль ) соединения (1 ), 0,1 г (О, 0004 моль) Еп(СНэ 000) х х 2Н О, О, 56 г (О, 0004 моль ) Y СО
0,17 r (О, 002 моль) Мп0 в 14 мл
ДМФА нагревают с перемешиванием до
130-140 С и выдерживают 5-6 ч. После охлаждения реакционную смесь фильтруют из осадка, осадок промывают 5б мл ДМФА. Иэ объединенного фильтрата отгоняют в в акууме растворитель.
Остаток растворяют в 4-5 мл СНС1 и подвергают очистке хроматографией в тонком слое. Элюент: смесь бензолацетон (ацетон — 2%). Отделяют красную зону, экстрагируют ацетоном. Пос е отгонки растворителя получают
0,10 r {81,5Ъ) (IХ), кристалличес—
1068440
Синтез . Соединение Раствори- Температу- Время Основа- Выход, Ъ тель ра, оС ние
ДМФА . 140-150 б ч КоСО 28, 8
Темплейтный
140-150 13 ч К СО>, .2,1
-1002-3 мин
20-25
ДМФА
CHCC -H@O 20-25
-100
5-10мин.На основе соединения
ДМФА
"100
20-25 2-3 мин
-100
CHCI - H O 20-2 5 5-1 Омин
Составитель Г. Коннова
Редактор Г. Волкова Техред Т.Маточка Корректор И. Шароши
Заказ 11389/20 Тираж 414 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4 кий порошок красного цвета, хорошо растворимый в хлороформе, метаноле, диметилформамиде, хуже растворимый в бензоле, ацетоне и нерастворимый в воде.
Пример б. Синтез 1,8,9,20тетрагидро-3, б-диметил-1, 8-дифенил-дибензоtc, тп1 дипираэоло 3, 4-Г: 4,3—
J I (1, 2, 5, 8, 9, 121 гексааз ациклотетрадецината Нсу CH) (Xl . 10
0,22 г (0,0004 моль) соединения (>), 0,2 г (0,0004 моль) Н CCH COOQ
1,12 г (0,008 моль К СО в 14 мл
ДМФЛ перемешивают в течение 10-12 ч при комнатной температуре. Ход реакции, полноту прохождения контроли руют тонкослойной хроматографией.
Затем реакционную смесь фильтруют от осадка, растворитель испаряют при комнатной температуре. Остаток темно-фиолетового цвета растворяют в
СсНс и подвергают хроматографической очистке. Колонку заполняют SlQq в
С На, элюент — С@Н . Собирают темнофиолетовую зону. Получают 0,25 r (83,3® (Х), темно-фиолетовый кристаллический порошок, растворимый в бензоле, хлороформе, диметилформамипе, ацетоне и нерастворимый в воде.