Способ определения о-дифенолов в водных растворах
Иллюстрации
Показать всеРеферат
СПОСОБ ОПРЕДЕЛЕНИЯ О-ДТЛФЕНОЛОБ В ВОДНЫХ РАСТВОРАХ, включающий измерение электрохимического Сигнала, отличающийся тем, что, с целью упрощения определения , устанавливают рН 6-8 анализируемого раствора, вводят lld3 d о-бензохинона или о-хлоранила , или о-броманила, а в качестве сигнала фиксируют изменение тока при 0,23 1 0,01 В. (Л О5 00 ф о: S т, мин
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТ ИЧЕСНИХ
РЕСПУБЛИК
ÄÄSuÄÄ l 068796
SCSO G 01 Б 27/48
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ABT0PCHOMV СВИДЕТЕЛЬСТВУ
1,00
0,60
020, иин
Фиг3
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И OTHPblTHA (21) 3476299/18-25 (22) 30.07.82. (46) 23. 01. 84 . Бюл. Ь 3 (721 С.Н.Суслов и С.С.Тимофеева (711 Научно-исследовательский институт биологии при Иркутском государственном университете им.А.A.Жданова (53) 543.257(088.8) (561 1. Унифицированные методы анализа вод. Под ред. Ю.В.Лурье. М., "Химия", 1973, с. 327-329.
2. Авторское свидетельство СССР
871051, кл..G Î) Н,27/48, 1981 (грототиг 1. (541 (57) СПОСОБ ОПРЕДЕЛЕНИЯ О-ДИФЕHOJIOB B BOpHHX PACTBOPAX, включающий измерение электрохимического сигнала, отличающийся тем, что, с целью упрощения определения, устанавливают рН 6-8 анализируемого раствора ° вводят 1. 10-4
1 ° 10 3 М о-бензохинона или О -хлоранилэ, или о-броманила, а в качестве сигнала Фиксируют изменение тока при 0,23 + 0,01 В.
1068796
40
Концентрация, М, О-дифенола
1;10 Ь
1 105 1;10
1-10-5
1 101
Скорость. распада О-бензохинона, мМ/мин
5,4
6,9
8,0
3,2
2,0 г
Таблица 2
Концентрация
О-бензохинона, М, 1-.10 4
1 - 10-5
10 3
Скорость распада
О-бенэохннона мМ/мин
6,9
6,9
6,9
Изобретение относится к анализу сточных вод и может быть использовано для количественного определения о-дифенолов - основных компонентов сточных вод предприятий целлюлознобумажной, нефтехимической и других 5 отраслей промышленности.
Известен .способ определения о-дифенолсв колориметрическим методом, основанным на реакции D --дифенолов с ионами железа в кислой среде. В ре- 0 зультате.этой реакции р2сТВор окрашивается в фиолетовый цвет, интенсивность которого пропорциональна содержанию многоатомных фенолов. Результаты определения этого метода не всегда восгро-,5 изводимы (1 ).
Недостатком этого метода является низкая чувствительность (интервал определяемых концентраций 1"10 4 .10 М )и точность определения, которая. обусловлена тем, что аналитические Полосы поглощения анализируемых веществ перекрываются с полосами поглощения сопутствующих компонентов стоков.
Наиболее близким техническим решением к изобретению является способ определения о -дифенолов в водных растворах, включающий измерение электрохимического сигнала.
Сущность этого способа заключается в измерении скоростей окислительновосстановительного потенциала при введении, в анализируемую пробу ацетонового препарата 0-дифенолоксидаэы при концентрации 10035
300, мг/л, рН 5,5-6,8 (2).
Недостатком известного, способа является применение неустойчивого ферментноГо препарата, который необходимо специально готовить, Йранить при определенных условиях (устойчив на воздухе до месяца), чтобы избежать ннактивирования.
Целью изобретения является упрощение определения.
Поставленная цель достигается тем, что согласно способу определения о-дифенолов в водных растворах, включающему измерение электрохимического сигнала, устанавливают рН 6-8 анализируемого раствора, вводят 1.10 4 — 1.-10 З М 0-бензохинона или 0 -хлоранила или О-броманила,.а в качестве сигнала фиксируют изменение тока при 0,23
0,01 В.
Сущность способа заключается в применении в качестве реагента о-бензохинонов или о-броманила или о-хлоранила и фиксирования кинетики их распада при катализе о -дифеналов, присутствующих в пробе. о -Дифенол катализирует реакцию распада О-.бензохинонов при рН 6,5-7,0. В оптимальных условиях проведения реакции наблюдается пропорциональная зависи мость между скоростью распада О -бензохйнона и концентрацией о-дифенола в интервале 10 " — 10 2 М. Предел обнаружения составляет 0,1 мг/л.
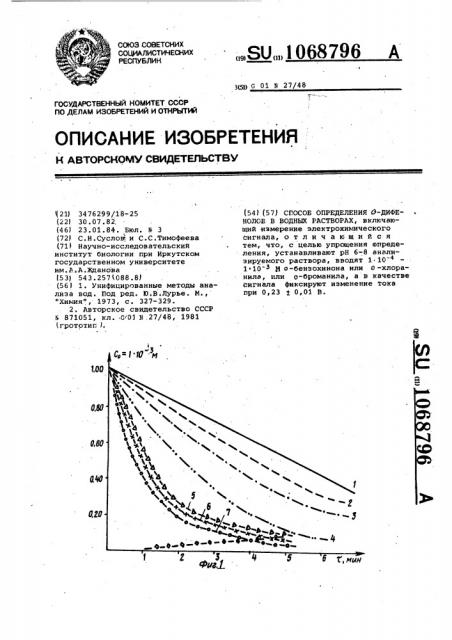
На фиг..1 приведены кинетические кривые распада о-бензохинона (.1 ..10 > М ) при введении различных добавок О-дифенола (1-0 Мг/Л, 2-1;10 2(, 3-1.-103 М, 4-1 10-,4М, 5- -10 . N, 6-1.10 М, .7-1 10 М}, на фиг. 2 — градуировочная кривая скорости распада 0-бензохинолина от
1gC 0 -дифенола.
В табл. 1 приведена зависимость скорости распада 0 -бенэохинона от концентрации 0 -дифенола. В табл. 2 приведена зависимость скорости распада О-бенэохинона от его концентрации при С @1 = 1 -10 З . Таблица 1
1068796
Область рН 6,5-7,0 выбирается с учетом скорости и периода полураспада хинонов. В табл. 3 указаны .значения скорости распада о -бензохинона, которые достигают максимального значения при рН.8-9 и минимального при рН 4-5, однако вести анализ в этих условиях затруднительно, так как в первом. случае идет интенсивная побочная реакция гидроксилирования о -хинонов, а во втором кислотный катализ, маскирующий ускоряющее действие о-дифенолов, поэтому наиболее приемлемым оказывается диапазон рН 6-7, где имеет место ярко выраженный автокаталитический характер реакции распада о-хинонов.
Концентрация о-хинона, требуемая для анализа, варьируется от 1 10-"
1 (4 5 6 рН
7 (8 9
Скорость распада
О-бензохинона, MY8/ÌÈН
6,9 78б
4,0
6,9
4,2
7,0
Пример. Пробу, содержащую
0,011- 0,1 мг/л О-дифенола, доводят рН Фосфатным буфером до 6,0-8,0 и отбирают для анализа 9 мл. В стакан, емкостью 50 мл вводят 9 мп пробы .и при перемешивании на магнитной мешалке(м =1000-1200 об/мин I, вводят в течение 1-2 с 1 мп 1 10 2 М раствора О-бенэохинона или ортохлоранила или О-броманила., при этом концентрация их )поддерживается в диапазоне
1-10 4 — 1. 10 3 М, и фиксируют изменение величины тока при E-б,23 В в течение 5-.7 мин (в зависимости от концентрации 0-дифенола ). В стаканНайдено X (мг/л) Х
Введено (мг/л) о-дифенола
Известный способ
Гредлагавыай способ
11012,1
12 0 3
1, 0+0, 04
108i4,8
110
10,0iO 6
11,0
1,1910,02
0,11
0, 10+0,003
0,12+0,028
Не определяется
0,012+0,000
0,011
Предлагаемый способ позволяет исключить использование малодоступного Ферментного препарата, сокрадо 1;10 3 Y. хотя начальные скорости распада о -хинонов в присутствии а-днфенола равны (табл. 27 и не зависят от начальной концентрации о-хинона, но глубина превращения и периоды полураспада (К/ J различны, (возрастают по мере уменьшения концентрации от 1, 10-3 до 1;10 М почти в сто раэ) и работать с концентрацией о -хинона 1 ° 10 М неудобно, вследствие увеличения времени для анализа. Концентрации выше 1 10 И применять также нецелесообразно ввиду укаэанной зависимости Ф ei2 от концентрации и очень быстрого самопроизвольного распада.
В табл. 3 приведена зависимость .скорости распада 0-бензохинона от рН раствора (С к98ном - 1:10 3 М, С n/1ñ
=1;10 М).
Таблица 3 чики опускают два электрода: индикаторный — платиновый или пирографитовый, электрод сравнения - насыщенный каломельный. Концентрацию о-дифенолов определяют по- градуи35 ровочному графику скорость распада концентрация о-дифенолов (фиг. 2).
h. -дифенолы и другие Фенолы определению не мейают, так как не проявляют каталитического действия
4Q в исследуемом интервале концентраций.
Результаты определения о -дифенолов Ы =0,95, 99 =9 приведены в табл. 4.
Таблица 4 тить время, затрачиваемое на приготовление препарата, и упростить определение о-дифенолов.
1068796
f4 12
Фиа 2
Составитель И. Рогаль
Редактор р. цицика Техред С.Мигунова корректор Р. Тяско
Тираж 8828
Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г.. Ужгород, ул. Проектная, 4
Заказ 11803
-2
tg С (О- дяренал)