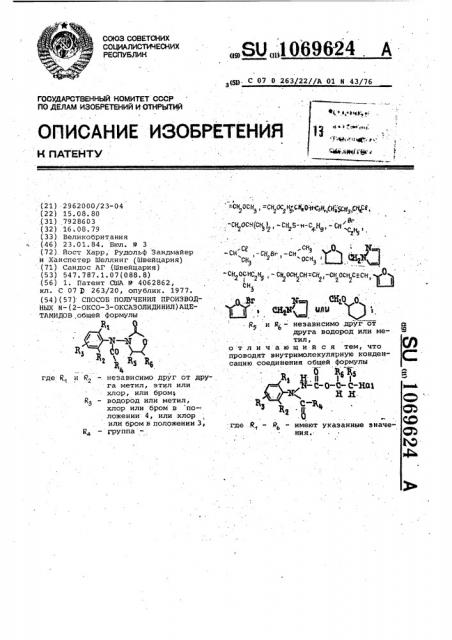
Способ получения производных @ -(2-оксо-3-оксазолидинил) ацетамидов
Иллюстрации
Показать всеРеферат
СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ М-
GOIO3 СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
O(° у < ч - Б — М
1о
Я 1 р,. р
Ц вЂ”. независимо друг от друга метил, этил или хлор, или бром водород или метил, хлор или бром в по-< ложенни 4, или хлор или бром в положении 3, группагдеR и г
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
flO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЦТИ)4 (21) 2962000/23-04 (22) 15. 08. 80 (31) 7928603 (32) 16.08.79 (33) Великобритания (.46) 23.01.84. Бюл. Р 3 (72) Йост Харр, Рудольф Зандмайер и .Ханспетер Шеллинг (Швейцария) (71) Сандос АГ (Швейцария) (53) 547.787.1 ° 07(088.8) (56) 1. Патент CUlA Р 4062862, кл. С 07 1) 263/20, опублик. 1977. (54)(57) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ й-(2-ОКСО-3-ОКСАЗОЛИДИНИЛ)АЦЕТАМИДОВ.общей формулы..SU„„1069624 (6Р, С 07 0 263/22//A 01 и 43/76
С«2008, -CH Oc Н-С)Ц.Н „Н У < Р СУ
-СН2Осн(сН ), -CK S-н-С Н, - СН "
2 + 9 стну.СЕ .сн, Q т ,-СН 8r -СН сн г осн З (Ф
- CH 0СНС Н, - СН ОСН СН =СН -q 0
2 2. 2 2 н2
СН„
- 1 СИ . ЯЛО
R и R - независимо .друг от друга водород или метил, о т л и ч à ю шийся тем, что проводят внутримолекулярную конденсацию соединения общей формулы
Я Е. 01 R6 Rl5
,,в- с-о-с- с-наг
Е Е
83 р где .Р„ — Р - имеют указанные значения.. ЯЪ
Ю
4:ь
1069624
Изобретение относится к способам получения производных N-(2-оксо-3-оксазолидинил)ацетамидов общей форК, Π— о -
Р,г а
30 где К и и — независимо друг от дру2
za метил, этил или атом хлор, или бром, Р— водород или метил, хлор или бром в положении 4, или хлор или бром в положении 3, д. — группа
- Н ОС,H -СН О н C. Н СН 5СН
-сн,с, -сн Осн(сн 1,— сн 5-н-с н
СН вЂ” С Н
2 5
8 сн-сн,, снаОН, сн ОСНС Н
1 1 31 i Ъ| 2 i 25t НЗ э
Щ )М -СН OCg СН,=СН, сн Осн c=-сН
2 2 2 2 2
Т") 31, X СНО
Li i,,tt g un u ();, я и p — независимо друг от дру 5 Ь га воцород или метил, которые обладают фунгицидной активностью и могут найти применение в сельском хозяйстве.
Известен способ получения производных оксазолинона общей формулы я 40
0 где ) - алкил, который заключается в том, что соединение общей формулы (Б-г нг
o- co-ын, Где Р - имеет укаэанные значения, псдвергают внутримолекулярной циклизации в среде растворителя при на ревании (1 J.
Соединения общей формулы П обладают физиологической активностью.
Целью изобретения является получение новых производных оксаэолинона, расширяющих область применения соеди-.бО нений класса оксазолинона.
Эта цель достигается получением соединений общей формулы 1, основанным «а реакции циклизации 1, которая заключается в том, что проводят внут-61 римолекулярную конденсацию соединения общей формулы
0 В 3щ
/ КК
2
1 где Р„ — к имеют указанные значенйя.
Пример 1. 2-Метокси-N-(2,6-диметилфенил -N-(2-оксо-3-оксазолидинил)ацетамид.
11,8 г (0,0375 моль) 2-хлорэтил-2-(метоксиацетил}-2-(2,б-диметилфенил)гидр;зинкарбоксилата добавляют при комнатной температуре в атмосфере азота порциями к суспензии 2,0 r гидрида натрия (в виде 55%-ного, вес.Ъ раствора} в минеральном масле в 100 мл абсолютного толуола. В процессе добавления температура в результате протекания реакции постепенНо возрастает до 40 С. После окончания добавления реакционную смесь перемешивают, не охлаждая, в течение
30 мин, а затем охлаждают до 10 С, Непрореагировавший гидрид натрия разлагают, добавляют к реакционной смеси этанол. Полученный раствор промывают водой, высушивают с помощью сульфата магния и отгоняют растворитель в вакууме.
В результате получают целевое coe zev e, которое после перекристаллизации иэ этанола дает бесцветные кристаллы. T: пл. 103-104 С.
Пример 1а. 2-Хлорэтил-2-(метоксиацетил)-2-(2,б-диметилфенил)гидразинкарбоксилат.
Использующееся в качестве исходного материала по примеру 1 соединение получают следующим образом.
Смесь 14,7 г (0,06 моль) 2-хлорэтил-2-(2,б-диметилфенил)-гидраэинкарбоксилата и 16,2 г (0,1 моль) ангидрида метоксиацетоуксусной кислоты ((СН ОСН СО) О) перемешивают в среде сухого толуола в течение часа при
800C. После охлаждения раствор промывают водой, затем 5Ъ-ным водным раствором НаНСО и снова водой.
Раствор высушивают с помощью
HgS04 и отгоняют растворитель в вакууме. В результате получают целевое соеди не ние.
Пример 1d. 2-Хлорэтил-2 -(2,б-диметилфенил )гидраэинкарбоксилат.
К смеси 127 r (0,935 моль) 2,6-диметилфенилгидразина, 102,5 r (1,3 моль) пириди.на и 400 мл воды добавляют при 0-5ОС 133,5 r (0,935 моль р -хлорэтилового эфира хлормуравьнной кислоты. После окончания добавления смесь перемешивают в течение 2 ч при комнатной температу1069624 ре, выпадающий осадок отфильтровывают, промывают водой и высушивают.
Полученное целевое соединение перекристаллиэовывают из толуола. В результате получают бесцветные кристаллы с т. пл. 74-75 С. 5
По другому предпочтительному варианту осуществления способа в соответствии с примерами 1, 1о и 1б процесс проводят следующим образом.
il p и м е р 2. 2-Метокси-й (2,6- Щ
-диметилфенил)-й-(2-оксо-3-оксазолидинил)ацетамид.
236,1 г (0,75 моль) 2- хлорэтил-2†(метоксиацетил)"2-(2,б-диметилфенил) гидразинкарбоксилата, 275 мл ксилола и 187 мл воды перемешивают, охлаждая смесь, и добавляют к ней 82,5 мл (0,82 моль) водного раствора гидроокиси натрия с содержанием 0,,4 r
Na0H (в мп) с такой скоростью, чтобы температура смеси равнялась при" мерно 20 С. После окончания добавления смесь перемешивают в течение часа при 20 С а затем.в течение еще 2 ч при О С. Выпадающий осадок отфильтровывают, промывают 150 мл воды и высушивают. В результате получают целевое соединение в виде слегка окрашенных кристаллов с т.пл. 102-103 С.
H р и м е р 2а. 2-Хлорэтил-2- 30
-(метоксиацетил)-2-(2,6-диметилфенил)гидразинкарбоксилат.
200 г (0,825 моль) 2-хлорэтил"
-2-(2,б-диметилфенил)гидразинкарбоксилата в 500 мп ксилола нагревают до 90 С и добавляют к горячему (при 80 С ) раствору 2-метоксиаце.о тилхлорида в 250 мл ксилола, полученного i n s i t u путем взаимодей ствия 73,5 г 0,826 моль) тионилхлорида при 80 С в течение 2 ч. Смесь выдерживают в течение 30 мин при
80 С, а затем проводят те же операции, что и в примере 1о, Пример 25. 2-Хлорэтил-2— (2,6-диметилфенил) гидразинкарбо- 45 ксилат.
Смесь 17,7 r (0,1 моль) 2,б-диметилфенилгидраэингидрохлорида, 21,2 г (0,2 моль)карбоната натрия в 50 мл воды и 50 мл ксилола перемешивают в течение 30 мин при комнатной температуре и затем охлаждают до 5 С. К охлажденной смеси доо бавляют 14, 3 r (О, 1 моль ) 2-хлор- Ыэ этилового эфира хлормуравьиной кислоты в течение 1 ч., поддерживая температуру ее равной 5 С. Смесь перемешивают при этой температуре в течение еще часа и в конце пере- Щ мешивания добавляют к ней 100 мл води. Выпадающий в результате осадок отфильтровывают, промывают водой и высушивают. Далее проводят те же
%To H B примере 16.
По способу, аналогичному описанным в примерах 1 и 2, получают соединения формулы 1, представленные в таблице.
Тест А, Фунгицидная активность по отношению к Phytophthore infestans.
Высаженные в горшок молодые растения картофеля (на стадии появления у них 3-5 листьевым опрыскивают водной суспензией, содержащей
Î,0О3Ъ (вес./об.) соединения форму,лы 1, например 2-метокси-й-(2,6-диметилфенил)-й-(2-оксо-3-оксаэолидинил)ацетамида. Через 2 ч обработанные таким образом растения заражают суспенэией спор phytophthora infestans, после чего их переносят в парник, где выдерживают при.16 С, относительной влажности о воздуха 100% и продолжительности дня 16 ч. Степень поражения растений оценивают через 4-5 дней путем сравнения с таким же образом зараженными растениями, которые, однако, не подвергают предварительной обработке. Испытуемое соединение в значительной степени подавляет развитие грибкового заболевания, не оказывая при этом фитотоксического действия на растение-хозяин.
Тест Б. Фунгицидная активность по отношению к Рlasmopara viticola.
Высаженные в горшки молодые растения винограда -винородного, (на стадии появления у них 3-6 листьев) опрыскивают водной суспензией, содержащей 0,0008% (вес./об.) соединения формулы 1, например, 2-метокси-й-(2,6-дифенил)-й-(2-оксо-3-оксаэолидинил)ацетамида. Через
2 ч обработанные таким образом растения заражают суспенэией спор
Рlasmopara vitiсо1а,после чего их переносят в парник,где выдерживают при
15-22 С (при колебании с 24-часовым периодом ) и относительной влажности воздуха 1003, при продолжительности дня 16 ч. Степень поражения растений оценивают через 6 дней после заражения путем сравнения с таким же образом зараженными, но не обработанными растениями. Испытуемое соединение в значительной степени подавляет развитие.грибкового заболе- вания, не оказывая при этом фитотоксического действия на растениехозяина.
Тест В. Лечебное фунгицидное действие по отношению к Plasmopara
viticola.
Высаженные в горшки молодые растения винограда винородного - (на стадии развития 3-6 листьев) заражают таким же способом, как в тесте Б. Обработку их соединением, например 2-метокси-й-(2,6-диметилфенил)-й-(2-оксо-3-оксаэолидинил)аце-
1069624
1 физик@-химические характеристики соединений общей формулы 1
Т.пл.
ОС
6 9
СН, СН Н
СН С1 Н
СН3 СНЗ Н
62-4
99-100
190-1
СН ОС Н
СН20CHЭ
Н Н
Н Н
Н Н
3 Н Н
4 Н Н
5 Н Н
3 3
ССНН5 ССНН3
СНЗ СН3
Э 3
107-9
4-С1 СН ОСН б Н . Н
Н Н
Н СН ОСН
7 Н СНЗ СН3
Н СН,SCH
Н СН2С1
8 Н Н
9 Н Н
113-5
134-6
Н Н
Н Н тамидом, проводят лишь спустя три дня после заражения. Условия инкубации те же, что и в тесте Б. Степень поражения оценивают так же, как и в тесте Б. Испытуемое соединение в значительной степени подавляет грибковое заболевание.
Тест Г, Уничтожающее действие по отношению к P1asrnopara vitiсо1а, Оценка этого вида активности осуществляется так же, как и в тесте Б, 10 с той разницей, что обработку растений испытуемым соединением осуществляют через 6 дней после заражения, когда на нижней стороне листьев наблюдается явная споруляция. Сте- )5 пень поражения оценивают через 7 дней после обработки растений испытуемым соединением, например 2-метокс»-N-(2,б-д»метилфенил)-N-(2-оксо-З-оксазолидинил)ацетамидом.
В результате установлено, что такая
20 обработка приводит,к полному прекращению споруляции пораженных зон.
Тест Ц. Транслокация обработанных листьев винограда винородного;
Нижнюю сторону срезанных листьев винограда нинородного обрабатывают водной суспензией, содержащей
0,0 1.2о- соединения формулы 1„ например 2-метокси-й-(2,6-диметилфенил)—
-N (2-оксо-3-оксазолидинил)ацетамида. Через 2 ч листья целиком заражают суспензией спор Рiasmopaга
vitIсо1а, после чего их выдерживают при относительной влажности воздуха
100% в тех же условиях, что и в 35 тесте В. Несмотря на то, что обработке испытуемым соединением подвергается только нижняя сторона листьев, фунгиц»дное действие его проявляется на обеих сторонах зараженных 4() листьев. Такой же эффект наблюдает" ся » в том случае, когда обработке
Ч
Р R R R Р нение э 1- 9 6 ч испытуемым соединением подвергают только верхнюю сторону листьев. Таким образом, можно сделать вывод, что действием 2-метокси-й-(2,6-диметилфенил)-N-(оксо-3-оксазолидинил) ацетамида на листья распространяется как акропетально, так и базипетально.
Тест Е. Обработка почвы. Опыты
iu vivo с использованием Py th!um
aphau.
Указанные грибы выращивают в стерилизованной смеси песка и пшеничной муки (в объемном соотношении 97:3), к которой добавляют воду в соотно.шении (o6 ° 1. 1 .4, в течение 4 дней. при 25 С. Полученную культуру смеши0 вают с полустерильной смесью торфа и песка и обрабатывают образующийся субстрат суспензией испытуемого соединения с таким расчетом, чтобы концентрация активного компонента составляла 100-160 р.p.m. (например 10, 40 и 160 р.р.в) активного компонента в одном объеме субстрата.
Обработанным таким образом субстратом заполняют горшки диаметром 5 см и сажают в них семена огурцов. Горшки помещают в теплицу и выдерживают »х в ней в течение 7 дней при 24 С и относительной влажности воздуха 6070%. После этого проводят оценку степени поражения растений, определяя количество взошедших здоровых растений и сравнивая полученные ре зультаты с результатами контрольного опыта, в котором растения выращивались в зараженной таким же образом, но не подвергнутой обработке почве.
Полученное в соответствии с примером
1 соединение (испытуемое в виде смачивающегося порошка ) полностью тормозит развитие грибкового заболевания растений.
1069624.Продолжение таблицы 5 "6 7 Э
Т.пл.
0С
Соединение 3 4
Н . СН С1
135-6
Н Н
Н Н
Н . CHóÎÑÍ(9НД Н СН ОСН (СН з)у
12 Н Н
13 И Н
Н СН 5 С, Н (д1
СН С1
СН . Сн
166-7
Масло
Н Н
14 Н Н
15 Н Н
Н Н
Н СН ЬС Н (и!
С1
Б 3
Н Н
123- 4
НСН-СН
Br
16 Н Н Н Н
147-8
17 Н Н
Н Н
Н СН -СН
С1
3 3
14 3- 4
119-20
18. H H
19 Н Н
Н Н
C»З
Н Н
СН
Н . CH ОСН
Н СН С1
20 Н Н
Н Н
Н Н
21 . Н Н
Н Н С1 . Ci н 4,НР 1
22 Н Н
Н Н 23139-41
СН
Н Н
Н Н
С»3 снз
3 2 3
Н CH C1
Н Н
Н Н
Н Н
С Нз
СН
3 3
Н Н
H Н
СН
CH3
3-8r,. СН С1
29
Н Н
» Н
Н Н
3-Br
4"Сн СН ОСН сН3
Н Н
Br
31 Н Н
СН
Н Н
4CR CH C1 е.r
Н Н
32 Н Н
4-СН9
33 Н Н Н Н СН СН Н
90-4
СНОСН
О
С»з Снз Н
С» СН 4-С1 СН С1
Н Н
149-52
Н Н
Смола
Н Н
Н Н
Н Н
Н Н
Н Н
Н Н
СН С1
Э сн С1
СН
С1
СН3
3 Н CH Br
0 Яр
1 1
3-С1 СН OCH
3 Br С»2ОСН
107-9
142-4
173-4
90-2
96-7
182-3
145-8
125-6
124-6
193-4
1069624
1 Продолжение таблицы е аде
Те пл °
R С
« »» 4 ° соеди" нение В В
Н .R
О
СН 4-С4
164-5
109-12 н н. снэ.
36 с н н
37 н н
СН ОСН9
cH oc3н.("
СН ОС4,Н9 1
Масло
39 н н
40 Н . Н
CH сн осн-с н
98-100
91-93
107-8 . н сн осн сн-сн н . сн осн с=сн н н н н
41 н н сн сн, н н н . н снэ сн3
42
43 н СН40 О н н сн сн, Н Н СН3 Н СН, СН, Н
79-80
СН ОСН н н н н сн сц
56 н н н н
142-4 с н с,н
47 Н Н Н Н
88-9 сн с1 сн осн с н с н5 н
150-2
8r н
128-9
114-6
4-с1 сн осн с1 с н с1
4-С1
131-4
4-сн
С2Н сснн
96-8.
137-8
4-Br
CHÝ сн
Составитель С. Кедик
Редактор Н. Егорова ТехредЖ.Кастелевич КорректОр И Эрдейи
Г ь
Заказ 11508/59 Тираж 410 .. Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4
48 н н
49 н н
50 Н Н
51 Н Н
52 н н
53 Н н н H н н н н н н н н н н н н н н н н н н
С2н
3 сн сн
СН ОСН
СН20СН
СН ОСН сн,осн