Способ получения азолов или их кислотно-аддитивных солей их стереоизомеров
Иллюстрации
Показать всеРеферат
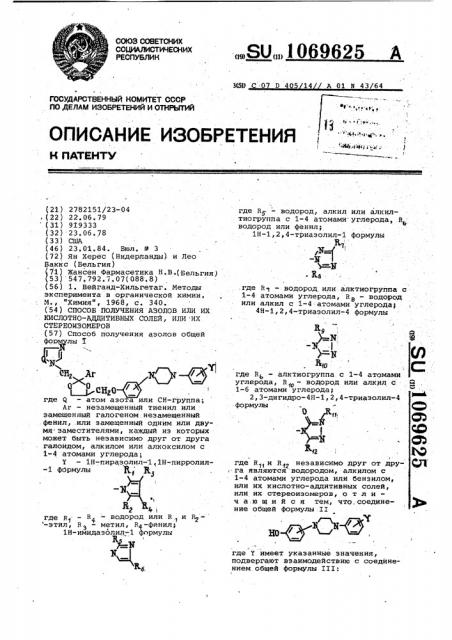
Способ получения азолов общей I г-Д -. где Rf - водород, алкил или алкилтиогруппа с 1-4 атомами-углерода, R. водород или фенил; . . 1Н-1,2,4-триазолил-1 формулы И, : . ; К.8 .где Кг| - водород, или. алктиогруппа с 1-4 атомами углерода, Rg - водород или алкил с 1-4 атомами углерода} 4Н-1,2,4-триазолил-4 формулы R 9 «N: (Л 1Г .
СОЮЗ СОВЕТСКИХ
СОДИАЛИСТИЧЕСНИХ
РЕСПУБЛИК
09) (И) ь . ° t т
;М ° . ° 3: . ° + 446 М4у i i, .° 1 Г
К ПАТЕНТ У 7;
iN=f
Ъ=К
° 8
Е9
,)=я
-З J м формулы 1"
)=м
EQ °
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
llO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 2782151/23-04
° (22) 22 .06.79 (31) 919333 (32) 23 ° 06.78 (33.) США (46) 23.01.84. Бюл. Р 3 (72) Ян Херес (Нидерланды). и Лео
Баккс (Бельгия)
° ° ° ° °
71) Жансен Фармасетика Н.В.(Бельгия)
53) 547.792.7.07(088.8) (56) 1 ° Вейганд-Хильгетаг. Методы эксперимента в органической химии, М., "Химия", 1968, с. 340. (54) СПОСОБ ПОЛУЧЕНИЯ АЗОЛОВ
КИСЛОТНО-АДЦИТИВНЫХ СОЛЕЙ, ИЛИ ИХ
СТЕРЕОИЗОМЕРОВ (57) Способ получения азолов общей фо ры (лы
„
% л мД - 0ан,о где Я вЂ” атом азота или СН-группа;
Ar — незамещенный тиенил илиэамещенный галогеном незамещенный .фенил, .или замещенный одним или двуMR заместителями, каждый из которых может быть независимо друг от друга галоидом, алкилом или алкоксилом с
1-4 атомами углерода;
7 — 1Н-пиразолил- 1.1Н-пирролил-1 формулы ф. Я
-4. й, E),, где Я R — водород или R и В2 -этил, Н3 - метил, R4-фенил;
1Й-имидаэолил-1 формулы
3(59 С 0 D 5 14 A 01 Б 43/64 где R6- — водород, алкил или алкилтиогруппа с 1-4 атомами углерода, R водород или фенил;
1Н-1,2,4-триазолил-1 формулы.где  — водород,или.алктиогруппа с
1-4 атомами углерода, Н - водород или алкил с 1-4 атомами углерода;
4Я-1,2,4-триазолил-4 формулы ЧО где Вь — -алктиогруппа с 1-4 атомами углерода, R р — водород или алкил с
1-6 атомами углерода;
2,3-дигидро-4Н-1,2,4-триазолил-4 где R è В неэависиМо друг от дру: га являются водородом, алкилом с
1-4 атомами углерода или бенэилом, или их кислотно-аддитивных солей, или их стереоизомеров, о т л и ч а:ю шийся тем, что,соединение общей формулы II где Y имеет указанные значения, подвергают взаимодействию с соединением.Общей формулы III:
106.9625
Изобретение относится к способам получения новых производных азолов, обладающих противогрибковой и противобактериальной активностью, которые могут найти применение в меди-, цине.
Известна реакция О-алкилирования фенолов алкилгалогенидами, алкили арилсульфонилоксипроизводными в инертном растворителе при повышенной 0 температуре, предпочтительно в присутствии акцептора — основания 31 ).
Цель изобретения — получение новых производных азолов, обладающих ценными противогрибковыми и противобактериальными свойствами.
Поставленная цель достигается основанным на известной реакции способом получения производных азолов общей формулы
20 где 0 — атом азота или СН группа;
Аг - неэамещенный тиенил или замещенный галогеном незамещенный фенил, или замещенный одним или дву- 30 мя заместителями, каждый из которых ! может быть независимо друг от друга галоидом, алкилом или алкоксилом с
1-4 атомами углерода;
Y - 1Н-пиразолил-1,1Н-пирролил-1 35 формулы
-Qÿ
40 где Y имеет указанные значения, .45 подвергают взаимодействию с соединением общей Формулы
2 где Ar и Я имеют указанные значения;
W - лалонд, алкилсульфонилоксйгруппа с 1-4 атомами углерода
I где R - H< водороды или В и Н атил, .R - метил и R, - фенил;
1Й-имидаэолил-1 Формулы В. или арилсульфонилоксигруппа с 6-10 атомами углерода, при 80-1 0ОС в ийертном органическом растворителе, предпочтительно в присутствии основания, с последующим выделением целевого продукта в виде основания или кислотно-аддитивнай соли, или стереоизомера.
Приоритет по признакам.
23.06.78 при. q-все значения; Aвсе значения; Y - -все значения.
1 где R - водород, алкил или алктиогруппа с 1-4 атомами углерода, R8 водород или фенил;
1Н-1,2,4-триазолил-1 формулы
8 где R — водород или алктиогруппа с
1-4 атомами углерода, H8 — водород или алкил с 1-4 атомами углерода;
4Н-1,2,4-триазолил-4 формулы
R где н8 "ацктиогруппа с 1-4 атомами углерода, H„ водород или алкил с
1-6 атомами углерода;
2,3-дигидро-4Н-1,2-,4-триазолил-4 формулы
О Eg
1 где R è R„ íåýàâèñèìo друг от друга являются водородом, алкилом с 1-4 атомами углерода или бензилом, или их кислотно-аддитивных солей, или их стереоизомеров.
Способ заключается в том, что соединение общей формулы
1069625 г
QHg Ж
:к. где Ar H Q имеют указанные значения;
M - галоид, алкилсульфонилоксигруппа с 1-4 атомами углерода или арилсульфонияоксигруппа с 6-10 атомами, углерода, при 80-13О С в инертном растворителе, предпочтительно в присутствии основания, с последующим выделением целевого продукта в виде основания или кислотно-аддитивной соли, или стереоизомера»
В качестве растворителя обычно используют N,N-диметилформамид, N,N-диметилацетамид, гексаметилфос-фортриамид, диметилсульфоксид, 4-метил-2-пентанон и т.п., которые .могут использоваться и в смеси с другими. инертными растворителями, например ароматическими углеводородами, такими как бензол, толуол, диметилбензолы. В качестве основания обычно используют гидрид или карбонат щелочного металла.
В ряде случаев. является целесообразным вначале перевод замещенного фенола формулы II в его соль . путем обработки гидридом или гидроокисью натрия и последующим взаимот действием с алкилирующим агентом формулы III.
Ряд исходных и промежуточных соединений, используемых по предлагаемому способу, являются известными, другие же могут быть получены аналогичными способами.
Соединения формулы Х сОдержат, по крайней мере, два асимметричных атома углерода и могут существовать в различных стереоизомерных формах.
Диастереоизомерные цис- и трансформы соединений формулы I могут быть выделены обычными способами, такими как селективная кристаллизация и хроматография, в частности колоночная хроматография. . Цис- и транс-диастереоизомерные рацематы могут быть далее разделены на их оптические изомеры: цис(+), цис(-), транс(+) и транс(-)
Соединения формулЫ Х могут быть переведены в их кислотно-аддитнвные соли путем обработки кислотой, такой как хлористоводородная, бромистоводородная или йодистоводородная, серная, азотная,.фосфорная или тиоциановая, уксусная, пропановая, молочная, 2-оксипропановая, 2-оксо. пропановая, этандикислота, пропандикислота, 1,4-бутандикислота, (Z)-2-бутендикислота, (Ж)-2-бутен дикислота, 2-окси-1,4-бутандикислота, 2;З-диокси-1,4-бутандикислота, 2-окси-1,2,3-пропантрикарбоновая, бензойная, З-фенил-2-пропеновая, с -оксибензолуксусная, метансульфоновая, этансульфокислота, 2-оксиэтансульфокислота, 4-метилбензолсульфокислота,.2-оксибензойная, 4-амино-2.-оксибензойная, 2-феноксибензойная или 2-ацетилоксибензойная кислоты.
Соли, в свою очередь, могут быть переведены в соответствующие свободные основания обычным способом, например путем взаимодействия с щелочью, например гидроокисью натрия или калия.
Соединения формулы 1 и их кислотно-адцитивные соли могут использо20 ваться для борьбы с грибками и бактериями. Tare, установлено, что указанные соединения и их кислотноаддитивные соли обладают высокой активностью по отношению,к ряду грибков, таких как Microsporum
canis,Ctenomyces mentagrophytås, Trichophyton rubrum, Phia1ophora ,yerruco sa, Cryptococcus neoi ormans, Candida tropicalis, Candida alhicans
Mucor species, Aspergi11eus Lumiya1
30 tus Sporotricum schenckii и Барго1еgnia species,а также по отношению к: бактериям, таким как Crysipelotrix
insidosa, Staphylococci, например
Staphylococcus bemolyticus H Strepto35 cocci, например Streptococcus руоКепез, Учитывая их значительную локальную и системную антибактериальную активность, соединения, получаемые по
4() предлагаемому способу„могут с успехом использоваться для подавления и предотвращения роста грибков и бактерий. В частности,:они могут эффективно использоваться для обработки объектов, пораженных микроорганизмами.
Получение промежуточных соединений.
Пример 1. Смесь 13,4 вес.ч. о дигидрохлорида 1-(4-метоксифенил)—
-пиперазина, 7,9 вес.ч. 1-хлор-4-нитробензола, 10 вес.ч. карбоната калия и 90 вес.ч. N,N-диметилформамида перемешивают при кипячении
5S с обратным холодильником в течение суток, после чего разбавляют ее водой и экстрагируют продукт дважды хлороформом. Объединенные вытяжки высушивают, фильтруют и упаривают.
60 Остаток растирают в 4-метил-2-петайоне. Продукт отфильтровывают и перекристаллизовывают из 1,4-диок сана. В результате получают 10,5 вес.ч (67%) 1-(4-метоксифенил)-4-(4-питрофенил)пиперазина, т.пл. 195,1 С.
1069625
Смесь из 12 вес.ч. 1-(4-метоксифенил)-(4-нитрофенил)-пинеразина
200 вес.ч. метанола и 225 вес.ч. тетрагидрофурана гидрируют при нормальном давлении и комнатной температуре в присутствии 2 вес.ч. 5 палладиевого катализатора на активированном угле (10%). После поглощения расчетного количества водорода катализатор отфильтровывают и промывают p,N-диметилацетамидом, Фильтрат щ вйлквают в воду. Выпадающий в.осадок продукт отфильтровывают и перекристаллиэовйвают из 1-бутанола. В ре-. зультате .получают 8 вес,ч. (74%)
4- 14-(4-Метоксифенил)-1-пиперазинил1- 5 фениламина, т.пл. 191,8 С.
Пример 2. К перемешиваемой и охлаждаемой льдом смеси 5 вес.ч.
М,Б-метантетрабис-(циклогексиламина), 26,2 вес.ч. сероуглерода и 40 вес.ч. пиридина,цобавляют 6 вес.ч. 4-(4-(4-метоксифенил)-1-пиперазинил|фенил, амина и перемешивают еще в течение
1 ч при охлаждении на ледяной бане, а .затем в течение 2 ч при комнатной 25 температуре, осле этого добавляют 35 вес.ч.
2,2 окси-бис-пропана и перемешивают в течение 30 мин.Выпадающий в осадок продукт отфильтровывают и перекристаллизовывают из 4-метил-2-пентанона.30
Затем продукт еще .раз перекристаллизовывают из 1,4-диоксана. В резуль тате получают 2,45 вес.ч. 1-(4-.изотпоцианатофенил)-4-(4-метоксифенил)пиперазина, т.пл. 180,6 С. 35
Смесь 47,8 вес.ч. 1-(4-изотиоцианатофенил)-4 -(4-метоксифенил)пипера- . зина, 100 вес.ч. гидрата гидразина и 400 вес.ч. 1,4-диоксана перемешивают и кипятят в течение 1 ч с об- 40. ратным холодильником, после чего ее охлаждают и выливают в воду ° .„Выпадающий в осадок продукт отфильт-. ровывают,.промывают водой и метанолом и высушивают. В результате получают,45
46 вес.ч.,(893) И- (4» (4-(4-метоксифенил)-1-пиперазинил)фенил)гидразинкарботиомида.
Пример 3. Смесь 23 вес.ч. 1<- )4(4-(4-метоксифенил)-1-пипераэинил) фенил гидраэинкарботиоамида, 23 вес.ч., ацетата метанимидамида и
80 вес.ч. 1-бутанола перемешивают и кипятят в течение часа с обратным холодильником. Затем реакционную смесь охлаждают, выливают в воду и
I добавляют 2.2 -окси-бис.-пропан. Выпадающий в осадок продукт отфильтро.вывают,промывают водой и метанолом перекристаллизовывают из 1-бутанола. В результате получают 60
17, 7 вес. ч. 4- (4- (4- (4-метоксифенил)-1-пиперазинил)фенил1-4Н-1,2,4-триазол-3-тиола, т.кл. 231,9ОС. .Проводят процесс таким же образом, но используя вместо ацетата 65,метанимидамида эквивалентное. коли;чество гидрохлорида этанимидамида, получают 4-.(4- f4-($-метоксифенил)-1пиперазинил)фенил -5-метил-.,4Н-1,2,4-триаэол-З-тиол, т.пл. 260,3 C. ,Пример 4. Смесь 9 вес,ч.
4- 4-(4-(4-метоксифенил)-1-пиперазиййл)фенил -4И-1,2,4-триаэол-3-тиола, 2. вес.ч. гидроокиси натрия и .
160 вес.ч. метанола перемешивают при нагревании до полного растворения твердых компонентов. Затем к смеси добавляют 3,3 вес.ч. диметилсульфата и продолжают перемешивание в течение 3 ч при комнатной температуре. после чего выливают .реакционную смесь
s воду. Выпадающий в осадок продукт, отфильтровывают и перекристаллизовывают из 1-бутанола. В результате получают 5,3 вес.ч. 1-(4-метоксифенил)-)- j4- (3 (метилтио)-4Н-1,2,4-триазол-4arig@eHHz) rrHrrepa3HHa, т. пл. 180 С.
Таким же способом получают 1-(4-метоксифенил)-4-f4-(3-метил-5-(метилтио}-4Н-1,2,4-триазол-4-ил)фенил)пипераэиндигидрохлорид, т.пл. 210 С.
Пример 5. Смесь 50 вес.ч.
2-(4-нитрофенил)гидразинкарботиоамида и 270 вес.ч. толуола подвергают аэеотропной дистилляции до полного удаления из нее воды". Затем к ней добавляют 26 вес.ч. уксусного ангидрида и перемешивают все при кипячении с обратным холодильником в течение 3 ч.
Реакционную смесь охлаждают, выпавший в осадок продукт отфильтровывают, промывают иэопропанолом и перекристаллизовывают из этанола, высушивают .при 100 С. В результате получают 31,5 вес.ч. 2-(аминотиоксометил)-1-(4-нитрофенил)гидразида уксусной кислоты, т.пл. 241,5 С.
Проводя ацетилирование таким же образом и используя эквивалентные количества соответствующих исходных соединений, получают моногидрат
2-(аминотиоксометил)-1-(4-нитрофенил) гидразида масляной кислоты, т.пл.
197,2оC и 2-(амииотиоксометил)-1"(4-нитрофенил)гидразид пропионовой кислоты, т.пл..216,1 С.
Пример б. 40 вес.ч. 2-(аминотиоксометил)-1-(4-нитрофенил)гид-r. разида уксусной кислоты. растворяют в смеси 10 вес.ч. гидроокиси натрия и 400 вес.ч. воды и перемешивают полученный раствор в течение 30 мин при комнатной температуре. Реакционную смесь подкисляют концентрированной соляной кислотой. Выпадающий в осадок продукт отфильтровывают, промывают водой и 2-пропанолом и перекристаллиэовывают иэ 1,4-диоксана. В результате получают 22,4 вес.ч
5- метил-1-(4-нитрофенил) 1Н-1 2,4-триазол-3-тиола, т.пл. 202,1 С.
Аналогично получают 1-(4"нитрофенил}"5-пропил-1Н-1,2,4-триазол1069625
-З-тиол, т.пл. 190,7ОС и 5-этил-1- (4-нитрофенил) -1H-1, 2, 4-триазол-3-тиол, т.пл. 206 1 С.
° ° ° ° ° ° °
Пример 7. К 80 вес.ч. метаола добавляют 4, 7 вес.ч. 5-метил-1-(4-нитрофенил)-1Н-1,2,4-триаэол-3 5
-тиола и 1,2 вес.ч. гидроокиси нат.рия и все вместе перемешивают до полного растворения твердых компонентов. Затем добавляют 2,66 вес.ч. диметилсульфата и продолжают пере- 10 мешивание в течение еще часа при комнатной температуре. Затем добавляют к реакционной смеси 100 вес.ч. воды. Выпадающий в осадок продукт отфильтровывают, промывают водой, 15 высушивают и перекристаллизовывают из 2.,2 -окси-бис-пропана. В резуль тате получают 3,3 вес.ч. (66Ъ | 5-метил-3-(метилтио)-1-(4-нитрофенил)-1Н-1; 2,4-триазола, т.пл. 121-125"С.
Осуществляя S-метилирование таким же образом и используя эквивалентные количества соответствующих исходных соединений, получают 5-этил-3-(метилтио)-1-(4-нитрофенил)-1Н-1,2,4-триазол, т. пл, 77,8 С и 3-(метилтио)-1-(4-нитрофенил«-1Н-1,2,4-триазол, т. пл. 140 С.
Пример 8. Смесь 2,5 вес.ч.
5-метил-3-(метилтио)-1-(4-нитрофенил)-1Н-1,2,4-триазола и 120 вес.ч. метанола гидрируют при нормальном давлении и комнатной температуре в присутствии 2 вес.ч. платинового катализатора на активированном угле (10%). После поглощения расчет- 35 ного количества водорода катализатор отфильтровывают, а. фильтрат упа ривают. Остаток перекристаллизовывают из смеси 4-метил-2-пентанона и петролейного эфира. Продукт от- 40 фильтровывают и высушивают. В результате получают 1,5 вес.ч. (68%)
4-(5-метил-З-(метилтио)-1Н-1,2,4-трнаэол-1-ил фениламина, т.пл. 13013бîC 4S
Проводят гидрирование таким же образом, получают также 4-(3-(метилтио)-1Н-1,2,4-триазол-1-ил3фениламин.
Пример 9. Смесь 41 вес.ч.
5-метил-3-(метилтио)-1-(4-нитрофенил)-1Н-.1,2,4-триазола и 80 вес.ч. метанола гидрируют при нормальном давлении и комнатной температуре . в 1 вес.ч. палладиевого катализатора на активированном
55угле (10%). После поглощения расчетного количества водорода катализатор отфильтровывают, а фильтрат упаривают. Остаток перекристалI 1 лизовывают из 1,1 -окси-бис-бутана. 60
Продукт отфильтровывают и высуши, вают. В результате получают
33 вес.ч. (913) 4-(.5-этил-З-(метилтио)-1Н- 1,2,4-триазол-1-ил)фенил. амина, т. пл. 131,7 С.
Э
Таким же образом получают 4-(2-метил-1Н-имидаэол-1-ил) фениламин, т. пл. 105 С.
Пример 10. Смесь 20 вес.ч.
4-(5-метил-З-(метилтио)-1Н-1,2,4-триазол-1-ил фениламина, 15 вес.ч. никеля Ренея 400 вес.ч. метанола перемешивают при кипячении с обратным холодильником в течение 2 ч. Никель Ренея отфильтровывают и добавляют 15 вес.ч. свежего катализатора, после чего продолжают перемешивание в тех же условиях в течение еще 4 ч. Реакционную смесь затем фильтруют, проьывают на фильтре метанолом и фильтрат упаривают.
Остаток перекристаллизовывают из смеси 4-метил-2-пентанона, 2,2 -Ькси-бис-пропана и петролейного эфира, В результате получают 7,6 вес.ч. (47%} 4-(5-метил-1Н-1,2,4-триазол-1-ил)фениламина, т. пл. 145 С.
Пример 11..Смесь 35 вес.ч.
1-(4-нитрофенил)-5-пропил-1Н-1,2,4-триаэол-3-тиола; 83 вес.ч. концентрированной азотной кислоты и 150 вес.ч воды перемешивают и нагревают до
60 С". В ходе перемешивания смеси дают охладиться до комнатной. температуры, после чего ее оставляют при перемешивании при комнатной температуре на ночь. Выпадающий в осадок продукт отфильтровывают, промывают водой и добавляют к горячему раствору 20 вес.ч. Карбоната калия в
200 вес.ч. воды при 100 С. Реакцион.ную смесь перемешивают, давая ей остыть до комнатной температуры.
Выпадающий в осадок продукт отфильтровывают, высушивают и перекристаллизовывают из смеси 4-метил-2-пентанона и 2,2 -окси-бис-пропана. Про(.дукт отфильтровывают и перекристаллиэовывают иэ 4-метил-2-пентанона.
В результате получают 19,8 вес.ч;
3,3 -дитио-бис-(1-(4-нитрофенил)-5-.
-пропил-1Н-1,2,4-триазола, т.пл.
171,5 С.
20 вес.ч. 3,3 -дитио-бис- 11-(4-нитрофенил )-5-пропил-iH-1, 2, 4-триаэола растворяют в 100 вес.ч. уксусной кислоты при перемешивании и нагревании, после чего добавляют к раствору по каплям 55 вес.ч. ЗОВ-ного раствора перекиси водорода. В ре- . зультате температура смеси повышается до кипения. После окончания добавления перекиси водорода перемешивание продолжают при кипячении с обратным холодильником в течение
1 ч..Реакционную смесь затем охлаждают и выливают в смесь измельченного льда и 50%-ного раствора гидроокиси натрия. Выпадающий в осадок продукт отфильтровывают и растворяют в хлористом метилене. Раствор промывают раствором сульфата натрия, высушивают, фильтруют и упаривают. Ос1069625 таток подвергают хроматографической очистке на колонке, заполненной силикагелем, используя в качестве элюента хлороформ. Чистые фракции объединяют и упаривают. Остаток переводят в хлористоводородную соль в 5 изопропаноле. Соль отфильтровывают и перекристаллизовывают в этаноле. В результате получают
3,9 вес.ч. (193) 1-(3-нитрофенил)-5-»
-пропил-1Н-1;2, 4-триазола моногидрохлорида, т.пл. 178,7 С.
Смесь 38,3 вес.ч. 1-(4-нитрофенил)
-5;пропил-1Н - 1,2,4-триазола моногидро хлорида и 400 вес.ч. метанола гидрируют при нормальном давлении и ком- 15 натной температуре в присутствии
3нес.ч. палладиевого катализатора на актиниронанном угле (10%).
После поглощения расчетного количества водорода катализатор от- 20 фильтронывают, а фильтрат упаривают. Остаток растворяют в воде и нейтрализуют бикарбонатом натрия. Продукт экстрагируют хлористым метиленом. Экстракт промывают водой, нысу 25 шинают„ фильтруют и упаривают.Остаток переводят н хлористонодородную соль в изопропаноле. Соль отфильтровывают и высушивают. В результате получают 35 вес.ч. (91ъ) 4-(5- 30
-пропил-1Н-1,2,4-триазол-1-ил)фениламина гидрохлорида.
Пример 12. Смесь 4 нес.ч.
N-(4-нитрофенил) гидразинкарбоксамида, 5 нес.ч. этанимидамидгидрохлори- З5 да и 5 нес.ч. ацетата натрия перемешивают при 1400С н течение 4 ч.
Реакционную смесь охлаждают, добавляют к ней воду и продолжают перемешинание до выпадения кристаллов.
Продукт отфильтровывают и перекрис таллизовывают из изопропанола. В результате получают 1,5 вес.ч. (343 )
2,4-дигидро-5-метил-4(4-нитрофенил)-ЗН-1,2,4-триаэол-3-она, т. пл.
226 1ос. 45
К перемешинаемому раствору
13,5 нес.ч. 2,4-дигидро-5-метил-4— {4-нитрофенил)-ЗН-1,2,4-триазол-3-она в 100 вес.ч. диметилсульфоксида добавляют 2 нес.ч. 78%-ной суспенэии гидрида натрия и продолжают перемешинание до прекращения вспенивания, после чего добавляют к смеси по каплям 8,1 вес.ч. диметилсульфата. После окончания добавления диметилсульфата перамешинание продолжают.еще .а течение 3 ч при .комнатной температуре. Реакционную смесь выливают в воду и продукт триж. ды экстрагируют хлороформом. Объеди- 60
° ненные вытяжки промывают водой, высушивают и упаривают. Остаток перекрйсталлиэовынают из смеси изопропилоного спирта и 2,2 -окси-бис-пропана. Продукт отфильтровывают и 65.перекристаллизовывают из 4-метил-2-пентанона. В результате получают
6,3 вес.ч. 2,4-дигидро-2,5-диметил-4-(4-нитрофенил)-ЗН-1,2,4-триазол-З-она, т.пл. 153,2 С.
Смесь 9 вес.ч. 2,4-дигидро-2,5-диметил-4-(4-нитрофенил)-ЗН-1,2,4-триаэол-3-она и 200 вес.ч. метанола гидрируют при нормальном давлении и комнатной температуре в присутствии
3 вес.ч. никеля Ренея. После поглощения расчетного количества водорода катализатор отфильтровывают, а ,фильтрат упаривают. Остаток растирают в 2,2".-окси-бис-пропане. Про,дукт отфильтровывают и высушивают.
В результате получают 7,5 вес.ч; (95%) 4-(4-аминофенил)-3,4-дигидро-!
-2,5-диметил-ЗН-1,2,4-триаэол-3-она, т.пл. 160 С.
П g и м е р 13. Смесь 52 нес.ч.
Н- 4-14-(4-метоксифенил)-1-пипераэинилjфенилjгидраэинкарбоксамида, 53 вес.ч. этанимидамидгидрохлорида и 135 нес.ч. N,N-диметилформамида перемешивают при 1300С в течение
3 ч. Реакционную смесь затем охлаждают и выливают в воду. Выпадающий н осадок продукт отфильтровывают, промывают водой и метанолом и перекристаллизовынают из М,N-диметнлформамида. Продукт отфильтровывают и перекристаллизовывают из 1,4-диоксана.
В результате получают 19,5 вес.ч, .2,4-дигидро-4- 4-(4-{4-метоксифенил)-
-1-пиперазинил)фенил) -5-метил-ЗНо
-1,2,4-триазол-З-она, т.пл. 298,4 С.
Пример 14. 19,2 sec.÷. 2,4-дигидро-4- (4-(4-(4-метоксифенил)-1-пиперазинил1фенил1-3Н-1,2,4-триазол-3-она растворяют в 450 вес.ч. диметилсульфоксида при. температуре 100 C. К полученному раствору добавляют затем 3,1 вес.ч. 50Ъ-ной суспензии гидрида натрия и продолжают перемешинание до тех пор, пока температура смеси не достигнет 50 С, после чего к ней добанляют 8,2 вес.ч. диметилсульфата и оставляют на ночь при комнатной температуре и перемешинании. Реакционную смесь ныливают
B воду и экстрагируют продукт хлороформом. Экстракт высушивают и упаривают. Остаток очищают хроматографией на колонке, заполненной силикагелем, с использованием в качестве элюента смеси хлороформа и метанола (в объемном соотношении,98:2). Чистые фракции объединяют и отгоняют иэ них растворитель. Остаток перекристаллизовывают иэ н-бутанола. В результате получают
5,8 вес.ч. 2,4-дигидро-4- (4-(4-(4-метоксифенил) 1-пиперазинил1фенил -2-метил-3Н-1,2,4-триаэол-3-она, т.пл.
245,7 С.
II р и м е р 15. 10 вес.ч. 2,4-дигидро-4- Я» -(4-(g-метоксифенил)-1-пи1069625 перазинил фенил)-ЗН-1,2,4-триазол-3- Проводя те же операцИи и исполь-она растворяют в 300 вес.ч. диметил- зуя эквивалентные количества соотсульфоксида при 100 С, добавляют ветствующих исходных соединений к полученному раствору 1,6 вес.ч. полУчают 1- 4-(1Н-имидазол-1-ил)50%-ной суспензии гидрида натрия и Фенил3-4-(4-метоксифенил)пиперазин, перемешивают смесь, давая ей охла- 5. те пл. 255-256ОСр 1-(4-метоксифенил)о. диться до 50 С. Затем к .ней добав- -4-(4-(1Н-1,2,4-триазол-1-ил)фенил)ляют 3,9 вес.ч. 1-бромпропана и остав. пипераэин т. пл 230,3 С; 1-(4-метляют при комнатной температуре и пе-, оксифенил -4-(4.-(3-(метилтио)-1Нремешивании на ночь. Реакционную 1 2,4-триазол-1-ил)фенил пиперасмесь выливают затем в воду и экст- . 0 зин; т. пл. 186,5 с; 1-(4-метоксирагируют продукт хлороформом. Экст» фенил)-4-t4 5-метил-3-(метилтио)ракт. промывают водой, высушивают и -1Н-1к,2р 4 тР азол-1-ил3фенил)пипера упаривают. Остат,к подвергают хрома- a+H, т ° пл. 153,fC; 1-(4-метокситографической очистке на колонке, фенил -4- 4"(5-метил-1Н-1,2,4-три-. эаполненной силикагелем с использо- аале< 1-ил)фенил1пипераз н т. пл.
l ванием в качестве элюента смеси хло- 191t1 Ct 2р4-дигидро-4-14-(4-(4-мет..Роформа, с использованием в качестве оксифенил)-1-пипеРазинил)фенил -2,5элюента смеси хлороформа и метанола + T I ЗН- 1i2 ° 4 -триазол-З-он, (при объемном соотношении 98:2). т. пл. 196,7 С; 1-(4-метоксифенил)Чистые Фракции объединяют и упари- 4 f4 вают. Остаток растирают в изопропано.20 -ил)фен л)пипеРазин, т. пл. 196 3 С., ле. Продукт отфильтровыващт и высу-. 1-(4 -j5 ýòèë-з-(метилтио)-1Н-1,2 4 шивают. В результате получают -тРиазол-1-ил)фенил)-4-(4-метокси7 5 вес.ч. (65%) 2,4-.дигидро-4-(4- .Фенил)пипеРазин, т. пл. 142,3 С и
-(4-(4-метоисиеенил).-g-пиперааииил) 1-(4-метоксифеиил)-4-(4-(2-метил-1Н- фенил -2-пропил-ЗН-1,2,4-триаэол- о
ПР„ о„ .а-алкилирование таким же Р м е Р 17.. Смесь.б вес.ч.
П име образом и используя эквивалентные . количества соответствующих исходных
Фениламина, З,б вес.ч. Фенилоксикарсоединений, получают 2-этил-2,4-ди 30 бонилхлорица, 75 вес.ч. пиридина и гидро-4- (4-(4-{4-метоксифенил)-1—
98 вес.ч. хлористого метилена пере-пиперазинил1-фенил)-5-метил-ЗН- мешивают при нагревании до полного
1,2,4-триазол-З-он,т.пл»1 79 8 СРаствоРениЯтвеРдых компонентов
2,4-дигидро-4- f4- (4-(4-ìåòîêcèôåírrrl) после чего перемешивание продолжают
-пиперазинил)фенил )-5-метил-2- 35 в течение еще 30 мин. Реакционную
-пропил-ЗН-1,2,4-триазол-З-он., т.пл. смесь выл ивают затем в 500 вес ч.
144,5 С и 2-этил-2,4-дигидро-4- (4- воды, добавлЯют 210 вес.ч. 2,2 -окси4-(4-метоксифен )-1-пкперазинйл1« -бис-пропана и перемешивают в тече фенил -ЗН-1,2,4-триазол-З-он, т.пл. ие некотоРого вРемени. Выпадаю210,2 С. 40 щий в осадок продукт отфильтровывают
Пример 16. Смесь 12 5 вес ч и пеРекристаллизовывают из н-бУтаноН,Н-бис-(2-хлорэтан)-4-метоксифенил- ла. В РезУльтате полУчают 5,2 вес.ч. амина 8 вес,ч. 4-(1Н-пиразол-1-ил)- (61%) фенил (4- (4-(4-метоксифенил)фениламина, 2 вес.ч. йодистого ка- . -1-пиперазинил)фенил)карбамата, т.пл. лия, 80 вес.ч. ацетона и 100 вес.ч. 45 воды перемешивают при кипячении с 45 CMecr. 3,2 Iree.r. Фе"ил (4 4 (4 обратным холодильником в течение токсифенил)-1-пипеРазинил)фенилЗкаР24 ч и затем охлаждают. Выпадающий . бамата, 50 вес.ч. гидРата гидРазина в осадок продукт отфильтровывают и 100 вес.ч. 1,4-диоксана пеРемеши(фильтрат собирают ), промывают водой вают при кипячении с обратным холо",. и ацетоном. В результате получают 50;дильником в течение 3 ч. РеакционнУю, 6 вес.ч. продукта. смесь затем охлаждав т и выливают в воду. Выпадающий в .осадок продукт отфильтрат нейтрализуют ра твором фильтроВыВают и пере ристаллизовывабикарбоната натрия и экстрагируют ют из N,N-диметилформамида.В резуль хлороформом. экстракт высушивают, 55- тате получают 1,7 вес.ч. (63%) Н, (4фильтруют и упаривают. Остаток рас- -(4-(4-метоксифенил)-1-пиперазинил3тирают в ацетоне. Продукт отфильт- фенил)гидразинкарбоксамида, т. пл. ровывают и промывают метанолом. В реэультауе получают 2 вес.ч. продук" Смесь 3 4 вес.ч. N-(4- (4-(4-метокта. Объединенные фракции (6 и 60 сифенил) -1-пипераэинил фенил) гидра2 вес.ч.) перекристаллиэовывают из зинкарбоксамида, 3 вес.ч. ацетата н-бутанола. В.результате получают,метанимидаяида и 10 вес.ч. диметил7„1 вес.ч. 1-(4-метоксифенил)-4- сульфоксида перемешивают при 100 С
- 4-(1Н-пиразол)-1-ил)фенилпипера- в течение 2 ч. Реакционную смесь за.эина, т. пл. 207,7 С. 65 тем охлаждают и выливают в смесь 41069625
-метил-2-пентанона и 2,2"- окси-бис-пропана. Выпадающий в осадок продукт отфильтровывают и перекристалли- . зовывают из И,N-диметилформамида (с добавкой активированного угля). В результате получают 1 вес.ч. (28%) 5
2,4-дигидро-4- 4-(4-(4-метоксифеяил)-1-пиперазинил1 фенил j-ЗН- 1,2,4-триазол-З-она, т.пл. 300 С.
Пример 18. Смесь 30 вес.ч.
4-(4-(4-метоксифенил)-1-пипераэи- 10 нил1фениламина и 300 вес.ч. 48%-ного раствора бромистоводородной кислоты перемешивают при кипячении с обратным холодильником в течение 10 сут.
Реакционную смесь затем упаривают и остаток подщелачивают гидроокисью натрия. Смесь фильтруют и остатоК подкисляют уксусной кислотой.. Выпадающий в осадок. продукт отфильтровывают и перекристаллизовывают из 1,4.-диоксана. В результате получают .
12 вес.ч. (44Ъ) 4- (4-(4-амкнофенил), -1-пиперазинил|фенола.
Проводя те же операции и используя эквивалентные количества соответствующих исходных соединений, получают:
4-(4- (4-(1Н-пиразол-1-ил)фенил)—
-1-пираэинил фенол;
4- 14- (4-(1Н-имидаэол)- 1-ил)фенил), -1-пипераэинил )фенол, т.пл. 260 С;
4- (4- (4-(1Н-1,2-триазол-1-ил)Фенил)-1-пиперазинилfфенол, -т. пл. 276,6 С;
4- (4- (4- (3-{метилтио)-1Н-1,,4-триазол-1-ил)фаиза -1-пиперазинил)
Фенол, т. пл. 225,5 С;
4- (4- (4-(5-метил-3 -(метилтио)-1Н-1,2,4-триаэол-1-ил)фенил)-1-пиперазинил) фенол, т. пл. 255,8 С;
4- З- 4- (3-метил-5- (метилтио ) -4Н- 40
-1, 2-триазол-4-ил фенил) -1-пиперазийил) Фенол;
4- (4- (4- (5-метил-1Н-1, 2, 4- триаэол-1-ил)фенил) -1-пипераэинил}фенол, т.пл. 281,1оС; 45
4- (4-(4- (3- (метилтио) — 4Н-1, 2, 4- вриазол-4-ил) фенил )-1-пиперазинил)фенол;
2, 4-ди гидро-4- (4- (4- (4-оксифенил )-1-пиперазинил) фенил )-2,5-диметил-ЗН- 50
-1, 2, 4-триазол-Ç-он, т. пл. 260 С", 2, 4-дигидро-4- 4- (4-(4-оксифенил)-1-пиперазинил) фенил -2-пропил-ЗН - 1, 2, 4- три аз ол- 3-он;
4- 14- (4- (2-метил-1Н-имидазол-1-ил)фенил)-1-пиперазинил фенол, 55 т.пл. > 300 С;
4-(4-(4-(5-этил-3-(метилтио)-1Н. -1,2,4-триазол-1-ил)фенил -1-Пиперазинил|фенол, т.пл. 232,У С;
2-этил-2,4-, дигидро-4-(4- (4-(4-ок- 60 сифенил)-1-пиперазинил)фенил -5-метил-ЗЕ-1,2,4-триаэол-Ç-он, т.пл.
Ж7,8ОC;.
2,4-дигидро-4-(4- (4-(4-оксифенил)-1-пипераэинил3фенил 5-метил-2-про- 65 пил-ÇH-1„2,4-триазохГ-З-он, т.пл.
258,2 С;
2,4-дигидро-4-(14- (4-(4-оксифенил)-1-пиперазинил)фенил)-2-.метил-ЗН-1,2,4-триазол-З-он;
2-этил-2,4-дигидро-4-14-(4-(4-оксифенил)-1-пиперазинил)фенил)-ЗН-1,2,4-т иазол-Ç-он, т.пл. 217 С;
О
4-(4-14" (1-пропил-1II-1,2,4-триазол-1-ил)фенил3- 1-пиперазинил)фенол, т. пл. 225,6 С.
Получение целевых продуктов.
Пример 19. К перемешивае» мому раствору 3 вес.ч. 4-(4-(4-аминофенил)-1-пиперазинил)фенола в
50 вес.ч. диметилсульфоксида добавляют 0,5 вес.ч. 50%-ной суспенэии гидрида натрия..Смесь перемешивают при
50 С до прекращения вспенивания, после чего добавляют к ней 4,1 вес.ч. цис-(2-(2,4-дихлорфенил)-2-(1Н-имидазол-2-илметил)-1,3-диоксолан-4-илметил)метансульфоната и продолжают перемешивать при 70ОC в течение еще
2 ч. Реакционную смесь затем охлаждант и выливают s воду. Продукт экстрагируют хлористым метиленом.
Экстракт промывают разбавленным раствором гидроокиси натрия, высушивают и упаривают. Остаток подвергают хроматографической очистке на колонке, заполненной силикагелем, с использованием в качестве элюента смеси хлороформа и метанола в объемном соотношении 98:2. Чистые фракции обьединяют и упаривают. Остаток перекристаллизонывают из изопропанола.
В результате получают 1,3 вес.ч. (22%) цис-4- 14-14-(2-(2,4-дихлорфенил)-2-(1H-имидаэол-1-ил-метил)—
-1,3-диоксолан-4-илметокси3фенил)—
-1-пиперазинил-фениламина, т.пл.
174 4оС, П р. и м е р 20. К раствору
3,2 вес.ч. 4-14- (4-(1H-пиразол-1-ил)фенил1-1-пиперазинил фенола в 100 вес.ч. диметилсульфоксида добавляют 0,32 вес.ч. 78%-ной суспензии гидрида натрия и перемешивают смесь при 50 С до прекращения вспенивания, после чего добавляют к ней 4,1 вес.ч. цис-(2-(2,4-дихлорфенил)-2-(1Н-имидазол-2-илметил)-1,3-диоксолан-4-илметил3метансульфоната и продолжают перемешивание при
100 С в течение 3 ч. Реакционную смесь затем охлаждают, выливают в воду и продукт экстрагируют хлористым метиленом. Экстракт промывают раз" бавленным раствором гидроокиси натрия, высушивают и упаривают. Остаток подвергают хроматографической очистке на колонке, заполненной силикагелем, с использованием в качестве элюента смеси хлороформа и метанола в объемном соотношении 98:2. чистые Фракции объединяют и упаривают.
Остаток подвергают хроматографической очистке на колонке, заполненной силикагел м, с использованием в качестве элюента смеси толуола и этанола в объемном соотношении 95:5.
Чистые фракции объединяют и упарива- 5 ют. Остаток .перекристаллизовывают иэ толуола. В результате получают
2,2 вес.ч. (34%> цис-1- (4-!"2-(2,4-дихлорфенил)-2-(1Н-имидазол- l-ил-метил)-1,3-диоксолан-4-ил-MeTozcag- 10
-фенил)-4-Г4-(1Н-пиразол-1-ил)фенил пипераэина, т.пл. 195,1 С.
Проводя те.же операции и используя эквивалентные количества соответ- д5 ствующих исходных соединений, получают: цис-1- (4-(2-(2,4-дихлорфенил)-2-(1Н-имидазол-. 2-илметил)-1,3-диоксолан-4-илметакси1-фенил - 4-(4-(1Н-ими дазол-1-ил)фенил)пиперазин, т.пл.
166,7 С; цис-1- (4-2-(2,4-дихлорфенил)-2-(1Н-имидазол-1-илметил -1,3-диоксолан-4-илметокси3-фенил)-4-(4-(1H-1,2,4-триазол- 1-ил)фенил)пипераэин, т.пле 175,3оС, цис-1-(4- (2-(2,4-дихлорфенил)-2-(1Н-имидазол-1-илметил)-1,3-диоксо- лан-4-илметокси) -фенил) -4- (4-(3-(метилтио)-1Н-1,2,4-триаэол-1-ил фенил пиперазин, т.пл. 178,3 С; цис-1 †(4-(2-(2 4-дихлорфенил)-2— (1 Н-имидаз ол-1-илме тил )-1, 3-диоксолан-4-илметокси фенил) -4- (4- t 3-метил-5- (метилтио ) -4H-1, 2,М-триазол-4-ил )- 35 фенил пиперазин, т. пл. 127, 8 С; цис- 1-I4-(2-(2,4-дихлорфенил)-2 †(1H-имидазол-2-илметил)-1,3-диоксоL ан-4-илметокси )фенил -4- (4-(5-метил3- (метилтио) -1H-1, 2, 4-триазол-1-ил 3: 4Q фенил)пиперазин, т.пл. 188,9 С; цис-1- (4-(2-(2,4-дихлорфенил)-2-(1Н-имидазол-1-илметил)-1,3-диоксолан-4-илметокси)фенилJ-4-(4-(3-(метилтио)-4Н-1,2,4-триазол-4-ил)фенил)-45 пиперазин,.т.пл. 176,4ОС; цис-4- (4-(4- (4-(2-(2,4-дихлорфенил)-2-(1Н-имидазол-1-илметил)-1,3-диоксолан-4-илметокси)фенилj-1-пи леразии)реиил -2 4-дигидре-2 5-диI 50 метил-ЗН-1,2, -триазол-3-он, т.пл.
149,3 С; цис-4-(4-(4-(4-(2-(2,4-дихлор. фенил)-2-(1H-имидазол-1-ил-метил)—
-1,3-диоксолан-4-иуметокси фенил -1-пиперазинил1фенил - 2,4-дигидро-2- 55
-пропил-ЗН-1,2,4-триазол-3-он, т.пл. 185,7 С; цис-1- (4-(2-(2,4-дихлорфенил)-2-(1Н-имидаэол-1-илметил)-1,3-диокаолан-4-илметокси1-фенил -4"(4-(5-ме- 60 тил-1Н-1,2,4-триазол-1-ил)фенил)пиперазин, т.пл. 154,1ОС; цис-1-(4-(2-(2,4-дихлорфенил)-2-(1Н-имидазол-1-илметил)-1,3-диоксолан-4-илметокси1фенил3-4-(4-(2-метил 65, -1Н-имидазол-1-ил)фенил!пиперазин, т. пл. 18!,1 С;, цис-4- 4-(4- (4-!,2-(2,4-дихлорфенил)-2-{1 -имидазол-1-ил-метил)-1,3-диоксолач-$-илметоксиЗфенилj-1-пипераэинил фенил.3-2,4-дигидро-ЗН-1,2,4-триаэол-3-он, т.пл. 212,8 C-, bee-4-(4-(4-. I4-(2-(2,4-дихлорфенил)-2-(1H-имидаэол-1- ил-метил)-1,3-диоксолан-4-илметокси )фенил)-1-пиперазинил)фенил )-2-этил-2,4-дигидро-ЗН-1,2,4-триазол-З-он, т.пл. 204,7 С . цис-4-(4-(4-(4-(2-(2,4«дихлорфенил)-2-{1Н-имидазол-1-ил-метил)-1,3-диоксолан-4-илметокси!фенил -1-пипе разинил3фенил)-2,4-дигидрогидро-5-метил-2-пропил-ЗН-1,2,4-триазол-.3-он-моногидрат, т.пл. 153,9 -C; цис-1- f4-(2-(2,4-дихлорфенил)-2-(1Н-имидазол-1-илметил)-1,3-диоксолан-4-илметокси !фенил 3-4- (4- f 5-этил-3-(метилтио)-1Н-1,2,4-триазол-1-.ил! фенил1пиперазин, т.пл. 136,3 С; цис-1-(4-!,2-(2,4-дихлорфенил)-2-.
-(1Н-имидазол-1-илметил)-1,3-диоксолан-4-илметокси,:!фенил -4-(.4-(5-пропил-1Н-1,2,4-триазол-1 - ил)фенил)пиперазин, т,пл. 150,4 С; цис-4- (4-(4- (4- (2-(2,4-дихлорфенил)-2-(1Н-имидаэол-1-ил-метил)-1,3-диоксолан-4-илметокси)фенил)-1-пиперазинил)фенил -2-этил-2,4-ди..гидро-5-метил-ЗН-1,2,4-триазол-3-он моногидрат, т ° пл. 135,5 С, !
Пример 21. К перемешиваемому раствору 8 вес.ч. 4- (4-(4-аминофенил )-1-пиперазинил)фенола в
100 вес.ч. диметилсульфоксида добав ляют 1,5 вес.ч. 50%-ной суспенэии гидрида натрия и пррдолжают перемешивание до прекращения вспенивания, после чего добавляют 12,3 вес.ч. цис-f2-(2,4-дихлорфенил)-2-(1Н-1 2,4-триаэол-1-илметил)-1,3-диоксолан-4-илметил!метансульфоната и перемешивают смесь при 50ОC в,течение еще 4 ч. Реакционную смесь затем охлаждают и выливают в воду. Продукт трижды экстрагируют хлористым метиленом. Объединенные вытяжки промывают разбавленным раствором гидроокиси натрия и обрабатывают акти- . вированным углем, который затем отфильтровывают, а фильтрат упаривают. Остаток очищают с помощью хро- матографии на колонке, заполненной силикагелем, с использованием.в качестве элюента смеси хлороформа и метанола в объемном соотношений
98т2. Чистые фракции объединяют и упаривают. Остаток перекристаллизовывают из н-бутанола. В результате получают 5,1 вес.ч. цис-4-(4- (4
-(2-(2,4-дихлорфенил)-2-(1Н-1,2,4-триазол-l-илметил -1,3-диоксолан-4-илметокси!фенил -1-пиперазинил) фениламина, т.пл. 86,8 С.
1069625
50
П р и м е .р 22. К перемешиваемому раствору 3 вес.ч. 4-(4-(4-(1H-1,2,4-триаэол-1-ил )фенил)-1-пиперазинил)фенола в 100 вес.ч. диметилсульфоксида добавляют 0,3 вес.ч.
78%-ной суспенэии гидрида натрия 5 и продолжают перемешивание до прекращения вспенивания. Затем к смеси добавляют 3,7 вес.ч. цис-f2-(2,4-дихлорфенил)-2-(1H-1,2,4-триазол-1-илметил)-1,3-диоксодан-4-илметил)- 10 метансульфоната и продолжают пере- мешивание при 100 С н течение 3 ч .
Реак (ионную смесь затем охлаждают и выливают в воду. Продукт экстрагируют трижды хлористым метиленом.
Объединенные вытяжки промывают разбавленным раствором гидроокиси натрия, высушивают и упаривают.
Остаток перекристаллизовывают из и-бутанола. Продукт отфильтровывают и высушивают. В результате получают 4,3 вес.ч. (75% цис-1- 4-(2-{2,4-дихлорфенил)-2-(1Н-1,2,4-триазол-1-илметил)-1,3-диоксолан-4-илметокси .вменил)-4- (4- 1Н-1 2 4-три
25 азол-1-ил)фенил)йиперазина, т.пл.
219,6 С.
Аналогично, используя эквивалентные количества соответствующих исходных соединений, получают: цис-1-(4-(2-(2,4-дихлорфенил)-2-{1Н-1,2,4-триазол-1-илметил)-1,3 — диоксолан-4-илметокси)фенилj-4— (4-{1Н-пиразол-.1-ил)фенил)пйперазин, т.пл. 183,3 С; цис-1-(4-(2-(2,4-дихлорфенил)-2- 35 †(1Н-1,2,4-триазол-1-илметил:)-1,3-pHoKcoJlaH-4-илметокси фенил)-4-. — (4-(1Н-имидазол-1-ил)фенил)пиперазин, т.пл. 194,3 С; цис-1- 4- L2-(2;4-дихлорфенил)-2- 4()
-(1Н-1,2,4- триазол-1-илметил)-1,3-диоксолан-4-илметокси)фенилj-4-(4†(5-метил-1Н-1,2,4-триаэол-1-ил)— фенил)пиперазин, т.пл. 106 5ОС; .цис-1--(4- (2-(2,4-дихлорфенил)-2- 45 †(1H-1,2,4-триаэол-1-илметил)-1,3-диаксолан-4-илметокси)фенил)-4- (43-(метилтио}-1Н-1,2,4-триазол-1-(-ил)фенил)пиперазин, т.пл. "153,9 С; цис-1-{4-(2-(2,4-дихлорфенил)- 2=(1Н-1,2,4-триазол-1-илметил)-1,3-диоксолан-4-илметокси)фенил«-4-14†-метил-3-(метилтио)-1Н-1,2,4-триазол-1-ил)фенил пиперазин, т.пл.
164,,1 C; цис-4- (4- (4- (4- (2- (2, 4-дихлорфенил) -2- (1Н-1, 2, 4-триазол-1-илметил)
-1,3-диоксолан-4-илметокси)фенил)-1-пиперазинил)фенил)-3-(ме