8-метокси-5-хинолинсульфохлорид как аналитический флуорогенный реагент для хроматографического определения аминов,аминокислот,пептидов и способ его получения
Иллюстрации
Показать всеРеферат
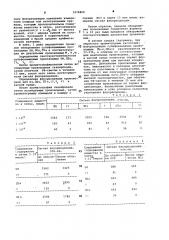
1. 8-Метокси-5-хинолинсульфохлоС1 РИД формулы как аналитический флуорогенный реагент для хроматрграфического определения аминов, аминокислот, пептидов. 2. Способ получения соединения SOaCl формулы . , о т л и N тем, что 8-метоксичающий хинолин подвергают взаимодействию с (Л хлорсульфоновой кислотой при 0-15 С и мольном соотношении хлорсульфоновая кислота:5-метоксихинолин, равном 10:1.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН (19) (И) цШ С 07 Р 215/36 G N 21/76;
С 01 N 31/08
ОПИСАНИЕ ИЗОБРЕТЕНИЯ, >
Н ABTOPCHOMY СВИДЕТЕЛЬСТВУ отлиформулы
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3404186/23-04 (22) 01.03.82 (46) 23.02.84. Бюл.9 7 (72) А.И.Точилкин, Г.A.Äàâûäoâà, И.Н.Грачева, И.P.Êîâåëüìàí и С.И.Ки ° риллова (71) Институт биологической и медицинской химии AMH СССР (53) 547.831(088.8) (56) 1. Ghosh T.N. and A.C.Roy, Quinoline derivatives IX, I.Indian
Chem.Soc,, 1945, 22, 39-40.
2, Uarga I,М., Richards F.F, Quantitative aminoacid composition
at the picomole level using fluores.cence scanning, Anal. Bioch.,1973, 53, 397-406 ° (54) 8-МЕТОКСИ-5-ХИНОЛИНСУЛЬФОХЛОРИД
КАК АНАЛИТИЧЕСКИИ ФЛУОРОГЕННЫЙ РЕАГЕНТ ДЛЯ ХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЛЕНИЯ АМИНОВ, АМИНОКИСЛОТ, ПЕПТИДОВ
И СПОСОБ ЕГО ПОЛУЧЕНИЯ. (57) 1. 8-Метокси-5-хинолинсульфохлорид формулы
Г
СН,0 как аналитический флуорогенный реагент для хроматографического опредепения аминов, аминокислот, пептидов.
2. Способ получения соединения
SOzC1 ч а ю шийся тем, что 8-метокси-(9
Щ
Я хинолин подвергают взаимодействию с хлорсульфоновой кислотой при 0-15 С о и мольном соотношении хлорсульфоновая кислота:5-метоксихинолин, равном
10: 1.
Изобретение относится к новым ngQизводным хинолина, а именно к 8-метокси-5-хинолинсульфохлориду Формулы оф1 (1)
СЦ и к новому способу его получения.
8-Иетокси-5 -хинолинсульфохлорид ; 1Î является Флуорогеиным веществом и может быть использован в органическом анализе, например нри хроматографическом разделении, как реагент для получения соединений, обладающих Флу-15 оресцентными свойствами, например, сульфонамидных производйых аминов, аминокислот, пептидов и т.п.
8-Метокси-5-хинолинсульфохлорид и способы его получения в научной и па-20 тентйой литературе не описаны.
Известен способ получения 8-зтокси-5-хинолинсульфохлорид, который заключается во взаимодействии 8-этоксихинолина с хлорсульфоновой кислотой при 65-70 С и мольном соотношении хлорсульфоновая кислота:8-зтоксихинолин, равном 6,5:1 (1) .
Целевой продукт получается с невысоким выходом.
Известен также 5-диметиламино-1- 30 нафталинсульфохлорид (дансилхлорид), широко используемый для получения флуоресцентных производных в химии аминокислот, пептидов, белков f2) .
Однако дансильные производные ами"35 нов, аминокислот и пептидов неустойчивы на пластинках с силикагелем и в кислой среде полностью теряют флуоресценцию даже при высоких концентрациях . 40
Преимуществами 8-метокси-5-хинолинсульфохлорида, по сравнению с дансилхлоридом, являются устойчивость к свету получаемых из него производных, а также отсутствие гашения флуоресценции кислотами, что может быть полезно при хроматографическом анализе.
Цель изобретения — новый способ получения флуорогенных веществ, обладающих повышенной устойчивостью к свету и способных сохранять флуоресценцию в кислых средах.
Поставленная цель достигается предлагаемым новым соединением формулы
ez,о
60 обладающим Флуорогенными свойствами, а также новым способом его получения, заключающимся во взаимодействии хлорсульфоновой кислоты с 8-метоксихинолином при О-15 C и мольном соотношении хлорсульфоновая кислота: 8-метоксихинолин, равном 10:1.
Проведение реакции при температуре
0-15ОС и мольном соотношении 10:1 позволяет получить целевой продукт с высоким выходом. Повышение температуры и уменьшение мольного соотношения ведет к снижению выхода целевого продукта.
Пример 1, 8-Метокси-5-хинолинсульфохлорид (1). К 23,3 r (0,2 моль) хлорсульфоновой кислоты при (-5)-5 С в течение 15 мин добавляют 3„2 г (0,02 моль) 8-метоксихинолина. Смесь перемешивают 1 ч при
0-15 С, осторожно выливают в смесь
О
120 г,измельченного льда и 65 г
NaHC0, осадок отделяют, еще влажным экстрагируют этилацетатом, этилацетатный раствор быстро сушат безводным углекислым натрием и упаривают в вакууме. Выход сульйохлорида 14,12 г (80%),т.пл.121-122 С (из смеси гексанбензол 1:1)..
Найдено, Ъ : С 47,80, Н 3,,18, .S 12,74,N 5,57, С„НВС1ИОЗ В
Вычислено,Ъ: С 47,42; Н 3,01, $ 12,61, N 5 50.
П р И м е р 2. 8-Метокси-5-хинолинсульфохлорид (1). К 11,7 r (0,1 моль) хлорсульфоновой кислоты при (-5) -5 С в течение 15 мин добавляют 3,2 г (0,02 моль) 8-метоксихинолина. Смесь перемешивают 1 ч при
0-15 С, обрабатывают, как описано в примере 1, и получают 1,23 r (24%) сульфохлорида (1) .
Пример 3. 8-Метокси-5-хинолинсульфохлорид (I). К 15,2 г (0,13 моль) хлорсульфочовой кислоты ,при 8-12 С за 10 мин добавляют 3,2 r
О (0,02 моль) 8-метоксихинолина. Смесь нагревают при 65-70 Ñ в течение 3 ч охлаждают, обрабатываю, как описано в примере 1, и получают 3,4 r (66%) сульфохлорида (1).
II р и м е р 4. 8-Метокси-5 -хиносульфохлорид (1). К 15,2 r (0,13 моль) хлорсульфоновой кислоты ,о при (-5) -5 С в течение 15 мин добавляют 3,2 r (0,02 моль) 8-метоксихиыолина. Смесь перемешивают 1 ч при 0-15 С, осторожно выливают в о смесь 120 г измельченного льда и 65 r NaHCO, осадок отделяют, зкстрагируют этилацетатом, органический слой быстро сушат безводной содой, упаривают в вакууме. Выход 1,22 г
:(23%), т.пл.121-122 С (из смеси гексан-бензол 1:1).
Пример 5. 8-Метокси-5-хинолинсульфонамид (П а). К раствору
260 мг (1 ммоль) 8-метокси-5-хинолинсульфохлорида в 1 мл метанола добав-. ляют 3 мл ?5%-ного водного раствора
NH4OH, через 2 ч при 20 С отделяют
150 мг (63%) производного П а. Спектр
1074869 флуоресценции (c=10"» М): в метаноле" g320 нм,% gcn 385 нм, в 0,5 н.
Н 80 » . % <> ь 380 нм, A qn 480 нм.
Пример б. 8-Метокси-N-метил4-хинолинсульфонамид (И б). К раствору 50 мг (0,2 ммоль) 8-метокси-5хинолинсульфохлорида в 0,5 мл метанола дрбавляют 1 мл 20%-ного раство.ра метиламинав метаноле. Через 15 мин отделяют производное Ild . Выход
56 мг (94%). 10
Пример 7. 8-Метокси-N,N-диметиламино-5-хинолинсульфонамид (Ив).
К раствору 260 мг (1 ммоль) сульфохлорида (1) в метаноле добавляют 2 мл
20%-ного раствора диметиламина в ме- 15 таноле, Через 15 мин отделяют производное Ив . Выход 190 мг (72%).
Пример 8. 8-Метоксн-н-пир.ролидино-5-хинолинсульфонамид (И г).
К раствору 285 мг (4 ммоль) пирролидина в 2 мл метанола добавляют
130 мг (0,5 ммоль) сульфохлорида (Х), через 15 мин отделяют осадок, промывают его метанолом, водой, метанолом и эфиром и получают 110 мг (75%) про-25 ! иэводного il r.
Пример 9. N N-Гексаметиленбис(8-метокси-5-хинолинсульфонамид) (Ид). К раствору 29 мг (0,25 ммоль) гексаметилендиамина в 2 мл хлороформа добавляют 130 мг (0,5 ммоль) суль- З0 фохлорида (Т) в 5 мп хлороформа, чеэе 24 ч при 20 С отделяют 25 мг (18%) производного Ид.
Пример 10. 8-Метокси-N-фенил-5-хинолинсульфонамид (Ilh), 8-мет-35 окси-1-бензил-5-хинолинсульфонамид (Иж), 8-метокси-N-(2-фенилзтил)-5хинолин-сульфонамид (Ид). К 1 ммоль соответствующего амина в 1 мл метанола добавляют 130 мг (0,5 ммоль) суль-40 фохлорида (1), смесь выдерживают
15 мин при 20 С, в случае соединения 0
Ие и 2 дня в случае соединений Пж и
Из. Производное Ие отделяют из раствора, производные Иж и Иэ после кон-45 центрирования раствора. Выход 80,36 и 82% соответственно.
Пример 11. 8-Метокси-N-(5 метокситриптаминил)-5-хинолинсульфонамид. (Ии). К раствору 113 мг (0,5 ммоль) гидрохлорида 5-метокситриптамина в смеси 3 мл 4%-ного раствора МаНСО» добавляют 130 мг (0,5 ммоль) сульфохлорида (1) в 1 мл метанола. Смесь выдерживают 2 дня при 20ОС, отделяют осадок, промывают его водой, метанолом и получают
50 мг (7?%) производного 11и, Пример 12. 8-Метокси-5-хинолинсульфонильные производные аминокислот(1ца-о, табл.5). Раствор 60 (1,5 ммоль аминокислоты в 1 мл 4%-ного раствора НаНСО обрабатывают раствором 190 мг (0,5 смоль) сульфохлорида 1 в 2,5 мл ацетона. Смесь выдерживают 24 ч при 20 С, обрабатыва- 65 ют ее 1 н. соляной кислотой до рН
6-7, отделяют соответствующие производные (IIla-о выходы, табл.5).
Пример 13. 8-Метокси-5-хинолинсульфонамидные производные пептидов (IIIn-с, табл.5). К раствору 0,5 ммоль дипептида в 1:m 4%-ного раствора иаНСО9 добавляют 130 мг ,(0,5 ммоль) сульфохлорида (I) в
2,5 мл ацетона. Смесь выдерживают
24 ч при 200С, обрабатывают ее 1 н. соляной кислотой до рН 6-7 и отделяют соответствуюцие пептидные производныеIIIc (выходы табл.5).
Пример 14. Гидролиэ 8-метокси-5-хинолинсульфонильных производных Ша-с.. Нагревают в запаянной ампуле в течение 24 ч при 105110 С (раствор 2-5 мг производного
П?à-с в 0,5 мл б н. соляной Кислоты. Смесь нейтрализуют 4%-ным раствором NaHC0> и хроматографией в системе A обнаруживают неизменные пятна соответствующих производных IIIa-o.
Пример 15. Гидролиз 8-метокси-5-хинолинсульфонильных производных Ып-с. В запаянной ампуле нагревают при 115-120 С в течение 64 ч смесь 10 мг QI n-с и 0,5 мл б н. соляной кислоты. Нейтрализуют 4%-ным раствором NaHCO и хроматографией в системе A обнаруживают соответствуюцие 8-метокси-S-хинолинсульфонильные производные N-концевыХ аминокислот, в системе Б — свободные аминокислоты, отвечающие С-концевому остатку исходного пептида.
Флуоресцентные характеристики
8-метокси-5-хинолинсульфонамидных производных и соответствуюцих им дансильных производных проиллюстрированы на примерах соединений Пб,IIIa, IIIn (8-метокси-5-хинолинсульфомидные производные, табл.4 и 5) и 5диметиламино-8-нафталинсульфонамида (lV) N-(5-диметиламино-1- нафталинl сульфонил) глицина (Ч), N-(5-диметиламино-1-нафталинсульфонил)глицилглицина (VI) (дансильные производные) (табл.1-3).
Хроматография, При помощи микро- . шприца на хроматографическую пластинку с Silufol наносили по 1 мкл исследуемых соединений в метаноле.
Хроматографирование проводили в системах: н-бутанол-уксусная кислотавода (4:1:5)(Б), хлороформ-ацетон (4:1)(A), дихлорэтан-спирт (1:1).
Сканирование. Хроматограмму после проявления подсушивали на воздухе и помецали на столик спектрофотометра Scan-201,1аусе Lieble, (Англия) .При полностью открытой диафрагме устанавливали сканируемое пятно под щель и пятно сканировали в направлении, свободном от соседних пятен.
Флуоресценцию возбуждали при 340 нм и регистрировали при 430 нм. Вели1074869 чину флуоресценции оценивали измерением площади под интегральными кривыми, которые пропорциональны содержанию вещества в пятне, рассчитывали по уравнению,S h. a>g,rpe h- высота кривой, ah)2 - ширина кривой на полувысоте. Проводили б параллельных измерений и брали среднее арифметическое значение.
В табл. 1 дано определение пределов обнаружения сульфонамидных про- 10 иэводных 11б, Жа,В1 в и соответствующих им дансильных производных й, V,VE ..
Определение светочувствительности сульфонамидных производных йб,lDa, Iv v . vz ° 15
После хроматографирования пятна исследуемых производных сканировали, затем облучали УФ-светом в течение
15 мин, после чего вновь регистрировали сигнал флуоренценции. 2О
Определение флуоресценции произво-, дили для Па, Ща, UI и, IV,V VI в кислой среде.
После хроматографии сканировали пятна исследуемых производных, затем хроматограмму помещали в камеру с
Содержание вещества в пятне, ммоль
Сигнал флуоресценции отн.ед
Пб I V 11!а IlE ï
1 ° 10 )
10 Io
1.10
2500
171
1562
116
3052
183
302
410
60
Та блица 3
Таблица 2.
Соединение
45 (содержа""е вещества в пятн До обработ- После обра1 ° 10 ммоля) ки НСХ ботки НС1 Соединение (содержан е в пятне 1 1б ммоль) 50 Пб
245
188
1425
1562
Пб
171
480
302
Ща
55 895
3052
П1 а
116
410
492
1780 60 V1
111 п
2500
VI
Сигнал флуоренпенции, отн.ед.
До облуче- После облуния . чения парами HCP и через 15 мин вновь измеряли сигнал флуоресценции.
Таким образом, пределы обнаружения производных соединения формулы
1 в 10 раз выше пределов обнаружения соответствующих дансильных производных.
В кислых средах (например, при обработке хроматограмм кислотами) флуоресценция сульфонамидных производных Иа-к,П1а-с увеличивается на
17-37%, в отличие от соответствующих дансильных производных, которые в кислой среде полностью теряют флуоресценцию даже при высоких концентрациях. Дансильные производные аминов, аминокислот и пептидов неустойчивы на пластинках с силикагелем, в отличие от них полученные сульфонамидные производные lla-к, IIIa-с обладают высокой светопрочностью, при облучении УФ-светом в течение 15 мин зти соединения практически не теряют флуоресценции. Аналогичные дансильные производные в этих условиях полностью утрачивают флуоресценцию.
Т а б л и ц а 1
Сигнал флуоресценции, отн.ед.
1074869
Вычислено, И (6
Ф
Шифр
Т.пл. С о
Брутто-формул
Найдено, %
ыход, N Я
11,8 13,3
10 !3 2 3 а ИН
11,1 12,8 с и N 0 Я
И !22 3 б янсн3 в и(сн ) 10,6 12,0
12 14 2 3 ! 1!
4 16 2 3 NMg Q<
9,4 10,9
10,2 11,3 д NH(cH ) ННЯо
С1бн3!!! 14 об ЯУ
8,0 11,3
9,4 11 0
8,0 9,6
NHC6 Н ж ННСН2061! в N< (C H 2 ) g Гб 1; g
1 .пл., С Выход 3
Шифр
Найдено, Ъ Брутто-формула
N S
9,5 10,4 с н н20 Я
12 И 2
8, 9 11, 0 с!бн!Зн2058
8 0 9 3 С Н N20 Я
8,0 9,2 с1бн2 Н2Ъ Я
1б 20 2 5Я а Н б СН в (сн ) сн
r (сн ) снсн
7,8
Д СН2СООН е СН2 СН СООН
9, 2 С!4Н!3!! 20 Я
7,6 7,8 С Н N О Я
15 15 2 ?
9,4 10,8 C H N 06F2
24 б
S0P K Н1 )4 К,
0®<3
1 8, 0 8, 3 . с, н !1N 0 б =
Н2 М С С Н2 С Н2
1!
МН
8,5 10,0 С Н 1! 0 Я
7,7 8, б с н!2Н2 0 Я
1 17 2 5
7,9 8,0 С9Н!8И20б Я
H CH H
K СН2C6H л CHZ Сб 840Н
8, 2 9,6 с1 н„,н,о Я и ®Щ} 100 80
0QH
М! б И 2 "3 !
7 "2 3 !
3 !
ВН!7"-2 03 Я
1! 2 3 4
Т а б л и ц а 4
11,8 13,5 216-218 63
11,2 12,7 108-110 94
10,5 12,0 170 72
9,6 11,0 194-196 15
10,0 11,5 260 18
8,9 10,2 252-253 80
9,6 11,0 134-136 36
8,2 9,4 132-134 82
10,2 7,8 177-176 72
Таблица5
9,5 10,8 )260 60
9,1 10,3 260 72
8,3 9,5 )260 52
8,0 9,1 >260 62
8,0 9,1 )260 58
8,0 9,6 )260 62
9,9 11,2 260 56
18,4 8,4 )260
8,6 9,8 194-196 52
7,3 8,3 )169-170 80
7,3 8,4 229-230 39
8,3 9,5 210-212 93
1074869
Продолжение табл. 5
Т.пл, С о
1---н иФР
Выход.Вычислено,%
Брутто-Формула
Найдено, %
6 8
N я
9,9 7,5 186-188 100
9,7 7,4 с„н „н 0 8
14,9 8,5 184-185 61
14, 3 8, 2 C@H(6N 05 S
Ю .
Н
%+ M
Производные пептидов п сн соннсн соон 11,5
Р СН CHCONHCH СН С00Н о СН СОННСН(СН )СООН 12,0
9 к 6 с15н 6Б 06 н
Составитель Н.Подхалюзина
Редактор Г.Волкова Техред М,Гергель Корректор C,Ы!екмар
Заказ 452/23 Тираж 410 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб.,д.4/5
Филиал ППП "Патент", г.ужгород, ул.Проектная,4
013 2
9 4 с 4 Н 4 Й 06 н
8,1
11,9 9,1 260 67
11,0 8,4 114-.116 65
12,5 9,5 183(разл) 58