Способ получения замещенных изоксазолин- @ -оксидов
Иллюстрации
Показать всеРеферат
СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ИЗОКСЛЗОЛИН-Н-ОКСИДОВ общей формулы Аг Ж- где R - метил, этил или фенил; Аг фенил,2-тиенил или 3-пиридил; Аг - фенил или 2-тиенил взаимодействием нитроуглеводорода с карбонильным соединением с использованием растворителей - хлороформа и этанола и кипячения, отличающийся тем, что, с целью упрощения процесса и расширения ассортимента целевых продуктов, в качестве нитроуглеводорода используют соединение общей формулы , где R имеет указанные значения, а в качестве карбонильного соединения ароматический или гетероциклический альдегид общей формулы П1 АгСНО где Аг имеет указанные значения, и процесс проводят в среде абсолютного этанола при кипячении в присутствии первичного алкиламина, с после дующей обработкой образующегося нитроалкена общей формулы (e)N02t (Л где R и Аг имеют указанные значения , диметилселенониевой солью общей формулы (СН ,,)2Se CH2COAr-Br где Аг имеет указанные значения, в среде хлороформ-вода, в присутствии гидроксида натрия в атмосфере -vl инертного газа, при температуре (-irf -( 5 f С . 00 ч1
СОЮЗ СО8ЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН
ЗСЮ C 07 D 261/04; С 07 D 401/04, С 07 D 409
ctl,.1;
ОПИСАНИЕ ИЗОБРЕТЕНИ
К ABT0PCHGMV СВИДЕТЕЛЬСТВУ
ГОСУДАРСТ8ЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 3530967/23-04 (22) 06.12.82 (46) 23.02.84. Бюл.9 7 (72) Н.Н.Магдесиева, P.А;Кянджециан, A.Â.ßðîâ и T.A.Ñåðãååâà (71) МГУ им. N.Â.Ëîìoíîñoâà (53) 547.786.1.03(088.8) (56) 1. Kohler Е.P. Tsoxazoline йх1—
des,Y.,Benzoyl-diphenyl-isoxazoline
oxide, T.Am.Chem.Soc, ч.47, р.3030, 1925 (прототип). (54)(57) СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ
ИЗОКСЛЗОЛИН-N-ОКСИДОВ общей формулы где R — метил, этил или фенил, Ar — фенил,2-тиенил или 3-пиридил, Ar — фенил или 2-тиенил
1 взаимодействием нитроуглеводорода с карбонильным соединением с использованием растворителей — хлороформа и этанола и кипячения, о т л и ч а ю шийся тем, что, с целью упроще" ния процесса и расширения ассортимента целевых продуктов, в качестве нитроуглеводорода используют соединение общей формулы
Нс 2ИОЯ где R имеет указанные значения, а в качестве карбонильного соединения ароматический или гетеропиклический альдегид общей формулы 1Ц
АгСН01 где Аг имеет указанные значения, и процесс проводят в среде абсолютного этанола при кипячении в присутствии первичного алкиламина, с последующей обработкой образующегося нитроалкена общей формулы
O ф
АгСН Г1 (R)NOgr где R Ar имеют указанные значения, диметилселенониевой солью общей формулы (CH >) г Se СН
-(5) С
Изобретение относится к усовершенствованном способу получения замеценных изоксаэолин -N-оксидов общей формулы
Мх
И
И +
Ará О
I) (П) НСН БО r где 8 имеет указанные значения, а в качестве карбонильного соединения ароматический или гетероциклический ,альдегид общей формулы
Ar CHO, где Ar - имеет укаэанные значения, и процесс проводят в среде абсолютного этанола при кипячении в присутствии первичного алкиламина, с последующим взаимодействием образующегося нитроалкена общей формулы
Ar"H=CH{R)NO, (т"„)
% где Ar имеет указанные значения, с диметилселенониевой солью общей формулы
Ф (СН3) Se CH
Отличие этого способа от известного состоит в том, что в качестве нитроуглеводорода йспользуют соедигде R - метил, этил или фенил; 1Q
Ar -фенил, 2-тиенил или 3-пиридил;
Ar фенил или 2-.тиенил, которые могут найти применение в качестве биологически активных соединений вмедицине,а также в органическом синтезе.
Известен способ получения трифенилизоксазолин-И-оксида присоединением фенилнитрометана к фенилстирилкетону с последующим бромированием продукта 2О в среде хлороформа при кипячении и циклизацией полученного -бром- -нитро. кетона в среде 95%-ного этанола под действием пиридина. условия стадии присоединения не указаны (1) . 25
К недостаткам данного способа следует отнести его многостадийность, а также то, что этим способом можно получить только 3,4,5-трифенилизоксалин-N-оксид.
ЗО
Целью изобретения является упрощение процесса и расширение ассорти мента целевых продуктов.
Эта цель достигается тем, что согласно способу, заключающемуся во взаимодействии нитроуглеводорода общей формулы нение общей формулы (П), а в качестве карбонильного соединения ароматический или гетероциклический альдегид-общей формулы (fU) и процесс проводят в среде абсолютного этанола при кипячении в присутствии первичного алкиламина, с последующей обработкой нитроалкена общей Формулы (IV) диметилселенониевой солью общей формулы (Ч) в среде хлороформ-вода в в присутствии гидроксида натрия в атмосфере инертного газа при температуре (-10) — 5oC.
Выбор растворителя осуществлен с учетом механизма реакции. Фактически с арилнитроалкенами Формулы (IV) реагирует не селенониевая соль (V) а селенониевый илид f{CH> ) Se -CHCOArj„ генерируемый из нее под действием основания.
Генерирование илида иэ соли (Ч) эффективно проводить в гетерогенной среде, которая должна отвечать следующим условиям: наличию двух несмешива лцихся растворителей, в одном из них должны быть хорошо растворимы соль (V) и основание, в другом должны быть хорошо растворимы илид и нитроалкен (IV), второй растворитель должен обладать способностью хорошо сольватировать полярные интермедиаты.
Система вода-хлороформ-N-=OÍ удовлетворяет всем этим требованиям. Хлороформ-один из лучших растворителей для карбонилстабилиэированных илидов, Илид, генерируемый в водной фазе при действии NaOH на соль (V) сразу же экстрагируется (в воде он очень плохо растворим) в хлороформ. Еще не пропрореагировавшая соль (V) остается в воде, что подавляет побочную реакцию илида и соли .(Ч) приводящую к триароилциклопропану. Далее илид и нитроалкен (IV) реагируют в хлороформе, приводя к изоксазолин-N-оксиду (11 .
Температурный интервал процесса ограничен (-10) С так как при более низких температурах смесь водного раствора солей замерзает. Сверху о он ограничен 5 С, так как выше этой температуры снижается выход целевых продуктов (пример 4).
Пример 1. 3-Метил-4-Фенил-5бенэоилизоксазолин-К-оксид (1а).
A. Получение 1-Фенил-2-нитропропена-1. 7,5 г нитроэтана, 10,6 г бенэальдегида, 0,5 мл Н --бутиламина и
10 мл абсолютного этанола кипятят с обратным холодильником 8 ч. Выпавший продукт перекристаллиэовывают из этанола. Выход 13,9 (863), т,пл.65 С.
Б. Получение изоксазолин-N-оксида.
К энергично перемешиваемой суспенэии, содержащей 3,70 г (0,012 моль) бромида диметилфенацилселенония, 1,63 г (0,01 моль) 1-фенил-2-нитропрена-1 и 60 мл хлороформа, при 5 С в атмо1074871
C(gH (yN 0g S
Вычислено,%: С 63,77 Н 5,02;
N 4,65.
Пример 4. 3-Метил-4-фенил 5-бензоилизоксазолин-N-ойсид (1а).
Реакцию бромида диметилфенацилселенония и 1-фенил-2-нитропропена-1 проводят, как в примере 1Б со следующими изменениями: реакцию проводят 2 5 ч при t С; после удаления растворителя из хлороформных экстрактов продукт выделяют хроматографированием на колонке с силикагелем
L40/100 (60 3 см, элюент — хлороформ
Rg 0,30). Изменение выхода N-оксида с температурой приведено в табл.1.
0 Н Н03
Пример 2. 3-Метил-4- (3-пиридил) -5-бензоилизоксазолин-и-оксид
25 (1г) .
A. Получение 1-(3-пиридил)-2-нитропропена-1. 10,7 г пиридин-3-альдегида конденсируют с 7,5 r нитроэтана как в пРимере 1А, выход 11,5 г (70%), Т.пл.67-68ОС.
В. Получение изоксазолин-N-оксида.
Процесс ведут, как в примере 1Б, с использованием 3,70 г (0,012 моль) бромида диметилфенацилселенония и
1;64 г (0,01 моль) 1-(3-пиридил)-2нитро-пропена-1 со следующими изменениями: вместо двойного (по отношению к селенониевой соли) используется 1,5-кратный избыток NaOH (g,72 г) 49 и реакцию проводят при (-10)ОС После обработки реакционной смеси экстракцией (как в примере 1Б) остаток после удаления растворителя хроматографируют на колонке с силикагелем 45
40/100 (60 3 см элюент: 5% метано ла в хлороформе), собирая Фракцию с
R(0,42. Получают 1,820 r чистого
3-метил-4-(3-пиридил)-5-бензоилизоксазолин-И-оксида (64%), вязкое масло.
Найдено, %: С б 8, 20, H 4, 99;
N 9,85, С НцN2 О>
Вычислено,%: С 68,08; Н 5,00
N 9,92.
10 20
55 40
Полученные изоксазолин-N-оксиды бесцветные кристаллические или желтые жидкие вещества, хорошо растворимые в ацетоне, хлороформе, этаноле, хуже — в эфире и плохо в насыщенных углеводородах. Онн устойчивы при
2G C в течение от одного до нескольких месяцев. Свойства полученных изок ;сазолин-N-оксидов приведены в табл.2 (кроме соединения 1ж все получены впервые). сфере аргона быстро приливают охлажденный до О С раствор 0,96 r (0,024 моль) NaOH в 10 мл Н О. Реакционную смесь перемешивают 2,5 ч при 5 С, затем добавляют 20 мл HgO отделяют органический слой, а водный экстрагируют Зк50 мл хлороформа. Объединенные органические экстракты промывают водой (2420 мл ) и сушат сульфатом натрия. Растворитель упаривают и остаток растирают с пентаном(4 20 мл1О каждый раз отделяя Осадок декантацией. Получают 1,76 г (63%) хроматографически почти чистого 3-метил-4фенил-5-бензоилизоксазолин-N-оксида. для элементного анализа и определе- 15 ния констант вещество дополнительно очищают перекристаллизацией из тяжелого петролейного эфира. Т.пл.123124 С.
Найдено, % : С 72,79; Н 5,42
N 4,44.
Вычислено,%: С 72,58; Н 5,37
N 4,98.
Пример 3. 3-Этил-4-фенил.5-(2-тиенил)-изоксазолин-N-оксид (1д).
А. Получение 1-фенил-2-нитробутена-1. 8,9 г 1-Нитропропана и 10,6 r бензалъдегида конденсируют, как в примере 1А. Растворитель удаляют на роторном испарителе и остаток перегоняют в вакууме (т.кип ° 90-94 С/
1 мм рт.ст.). .Выход 12,4 г (70%).
Б. Получение изоксазолин-N-окснда.
Процесс ведут, как в примере 2Б, с использованием 3,80 г (0,012 моль) бромида диметил-2-тиенилметилселенония и 1,77 г 1-фенил-2-нитробутена1 со следующими изменениями: реакцию проводят при ООС, при хроматографическом выделении изоксазолин-N-оксида в качестве элвента используют чистый хлороформ (R4 0,33), Получают
1,64 г чистого 3-этил-4-фенил-5(тиенил-2)-изоксазолин-и-оксида (54%), вязкое масло.
Найдено, % : С 64,00, Н 5,11, N 4,41
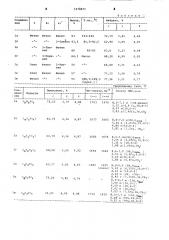
Таблица 1
) ((I
С -10 -5 О 5
Выход (1а ), % 55 58 63 65
1074871
Т а б л и ц B a ь
Т,w. С
Найдено, %
Выход, Ъ
Соединение
I"
С н N
4,44
72,79
5,42
123-124
2-Тиенил 63,5
Фенил
4,95
2-Тиенил
4,94
5 23
60 82-83
64,3 Масло
63,0
3-Пиридил
4,41
64,00 5,11
2-Тие- 54 нил
Этил Фенил
73,33 5,08
77,36 5,51
4,79
188,5-189,5 ((разл„) ) 4,17
Фенил
Продолжение табл, 2
Соедине, ние
Вычислено, В
Формула
С-==О С= — N с
1703 1670
8,2-7,? м (10Н
5,55 д(4,8 Гц, 4,97 м(1Н,Н-4)
1,83 д(1,40Гц,, фенил )
1Н, Н-5 ) 3Н,СН) 1б С„Н,NO S (к (3
1677 1665
8,0-7,0 м(8Н.Н
5,24 д (4,83Гц
4,80 м(1Н,Н-4)
1,81 д (1,5Гц, а рам ,1Н,Н-5} сн ) 1683 1659
1в С H NO S (5 (6 (у Ч 3
1694 1662
1д ", (6H(sNO
63,77
5,02 4,65
1е С Н NO
1ж С Н„ИО3
Метил Фенил Фенил 63
Этил Фенил Фенил 57
1а C H NO 72,53 5,37 4,98
62,70 4,56 4,87
62,70 4 56 4,87
68,08 5,00 9,92
73,20 5,80 4,74
76,95 4,99 4,08
81,5-82,5 62,90 5,09
68,20 4,99 9,85
ИК-спектр,см Спектр ПМР,м.д.
8,5-7,2м(8Н,Нс(ром )
5,55 д (6,65Гц,1Н,Н-5, 5,31 м (1Н,Н-4)
1,88 д(1,64Гц,CH)
8,6-710 (9Н Норам )
5,53 д (5,8ГЦ,Й,Н-5)
5,03 м(1Н,Н-4)
1,80 д (0,9Гц,CH }
1685 1655 8,0-6,9 (8Н, Нарам (плечо) 5,22 д (4,55Гц,1Н,Н-5)
4,63 м (1Н,Н-4)
2,24 м (2Н, -CHq â€, 0,92 т (7,35ГЦ.ЗН,СН }
8,3-6,3 м (10Н,Н )
5,00 м (1Н,Н-5)
4,50 м (1Н,Н-4)
2,02 м (2Н,СН }
1,03 т (7,5Гц,3Н,СН )
1710 1610 8,3-7,5 м (15Н,Н4 и)
6,40 д (9Гц,1Н,Н-5)
5,32 д (9гц,1Н,Н-4) 1074871
Составитель Т.Кашина
Редактор Г.Волкова Техред-Л.Пилипенко, Корректор С.Шекмар
Эакаэ 452/23 Тираж 410 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д.4/5
Филиал ППП "Патент", r.Óâãîðîä,ул.Проектная,4
Таким образом, предлагаемый способ по сравнению с известным, который одновременно является базовым объектом, позволяет упростить процесс, .сократив число стадий получения целевых продуктов с трех до двух и получать ряд не описанных ранее изоксаэолин-я-оксидов, которые содержат гетероциклические заместите-. ли.