Способ определения потенциалов окисления и восстановления веществ,способных к электрохемилюминесценции
Иллюстрации
Показать всеРеферат
СПОСОБ ОПРЕДЕЛЕНИЯ ПОТЕНЦИАЛОВ ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ ВЕЩЕСТВ , СПОСОБНЫХ К ЭЛЕКТРОХЕМИЛЮМИНЕСЦЕНЦИИ , заключающийся в наложении регулируемого по заданной программе напряжения на рабочий и вспомогатехйный электроды электрохимической ячейки , содержащей исследуемое, вещество, отличающийся тем, что, с целью повышения точности определения потенциалов окисления и восстановления , регистрируют потенциал, соответствующий появлению электрохемилюминесценции . (Л
COl03 СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
3(5g G 01 N 27 52
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTOPCHOMY СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
flO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3512027/18-25 (22) 12.11.82 (46) 23.02.84.Бюл. 9 7 (72) A.È.Áûõ, А.В.Кукоба и Н.Н.Рожицкий (71) Харьковский ордена Трудового
Красного Энамени институт радиоэлектроники (53) 531.135 (088.8) (56) 1. Авторское свидетельство СССР
9 787978, кл. 0 01 Н 27/48, 1980, 2. Электрохимия органических соединений. Под ред. A.Ï.Òîìèëoâà, Л.Г.Феоктистова, М., Мир, 1976, с. 19-30 (прототип).
„„SU„„5140 А (54) (57) СПОСОБ ОПРЕДЕЛЕНИЯ ПОТЕНЦИА—
ЛОВ ОКИСЛЕНИЯ И BQCCTAHOBJIEHHH ВЕЩЕСТВ, СПОСОБНЫХ К ЭЛЕКТРОХЕМИЛЮМИНЕСЦЕНЦИИ, заключающийся в наложении регулируемого по заданной программе напряжения на рабочий и вспомогателный электроды электрохимнческой ячейки, содержащей исследуемое вещество, отличающийся тем, что, с целью повышения точности определения потенциалов окисления и восстановления, регистрируют потенциал, соответствующий появлению электрохемилюминесценции.
1075140
Изобретение относится к электрохимии и может найти применение при определении потенциалов окисления (восстановления) веществ, способных к электрохемилюминесценции.
Известен способ определения потенциалов окисления (носстанонления) электрохимически активных веществ, основанный на подаче на электрохимическую ячейку изменяющегося по заданной программе напряжения и регистра- 10 ции фарадеенского тока или определенной гармонической составляющей этого тока (lj.
Недостатками способа являются необходимость отделения фарадеевского тока, вызванного процессами окисления (носстанонления) исследуемого вещества, от тока заряда емкости двойного электрического слоя (емкостного тока) и фонового тока примесей, а также требование обеспечения полной индифферентности растворителя и фонового электролита в исследуемой области потенциалов.
Наиболее близким к изобретению по технической сущности является способ определения потенциалов окисления и восстановления веществ, способных к электрохемилюминесценции, заключающийся в наложении регулируемого по заданной программе напряже- 30 ния на электрохимическую ячейку с рабочим и вспомогательным электрода..ми, содер>кащую исследуемое вещество.
Электрохимически активные вещества .определяют при наложении линейно из- 35 меняющегося во времени напряжения между индикаторным электродом и элек тродом сравнения в трехэлектродной электрохимической ячейке, содержащей исследуемое нещестно, регистрацией тока, протекающего через индикаторный электрод (2).
Недостатком известного способа янляется сии>кение точности определения потенциалов окисления (восста.— новления) веществ за счет протекающих параллельно с исследуемым процессом нефарадеевских процессон заряда емкости двойного электрического слоя и электрохимических процессон разряда ионов фонового электролита и примесей, удаление которых весьма трудоемко и не всегда нозможно.
Целью изобретения является повышение точности определения потенциалон окисления и восстановления.
Поставленная цель достигается тем, что согласно способу определения потенциалов окисления и восстановления веществ, способных к электрохемилюминесценции, заключающемуся 60 в наложении регулируемого по заданной программе напряжения на рабочий и вспомогательный электроды электрохимической ячейки, содержащей исследуемое вещество, регистрируют потец-. циал, соответствующий появлению электрохемилюминесценции.
Сущность способа заключается в том, что для веществ, способных к электрохемилюминесценции, справедливо соотношение (э л- K" "р где I — ин тен сив ность электрохез>л милюминесценции исследуемого соединения; фарадеенский ток окисления (восстанонления) исследуемого соединения;
К вЂ” коэффициент пропорциональности, занисящий от природы исследуемого соединения и условий =.-лектролиза (величина К для конкретных условий может быть определена экспt.риментально из наклона прямой в графике ) з„„ -((q>) т.е. интенсивность электрохемилюминесценции прямо пропорциональна неличине фарадеевской компоненты тока) .
Повышение точности определения потенциалон начала процессов окисления (BoccTBEIGHëåHèÿ) в предлагаемом способе достигается тем„что регистрируемое свечение обусловлено только процессами окисления(восстановления)молекул вещества, способного к электрохемилюминесценции, а электрохимиче"..êèå процессы разряда тонов фонового электролита,. примесей и нефарадеевские гроцессы заряда емкости двойного электрического слоя не привоцят к образованию эмиттеров электрохемилюминесценции. Таким образом, по появлению сигнала электрохемилюминесценции однозначно определяют потенциал начала процессов окислен я (восстановления) даже в условиях, когда токи фарацеевского процесса разряда ионов фонового электролита, примесей и нефарадеевских процессов заряда емкости двойного электрического слоя превышают ток окисления (восстановления) исследуемого вещества.
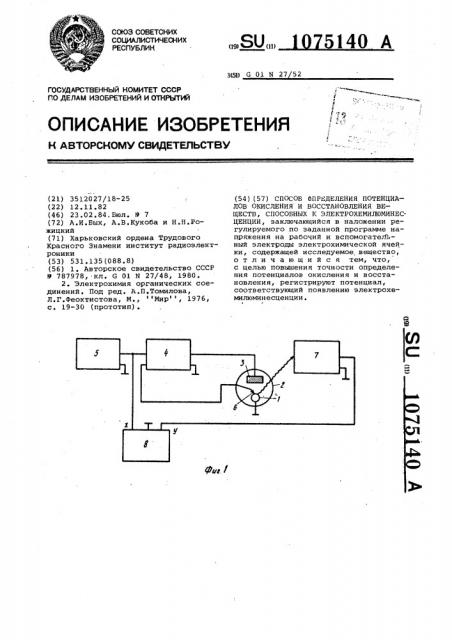
На фиг. 1 представлена структурная схема измерительной установки, реализующей предлагаемый способ; на фиг. 2 — 4 — зависимости интенсивности электрохемилюминесценции и тока через электрохимическую ячейку от потенциала электрода для сг.едующих веществ: 1,5-дифенил-3-стирилпиразолина (фиг. 2-3), рубрена (фиг.4) .
На рабочий электрод 1 электролитической ячейки 2, выполненной из прозрачного z оптическом диапазоне материала и содержащей растворитель, электролит фона и исследуемое вещество, через вспомогательный электрод 3 и потенциостат 4 подают линейно изменяющееся напряжение от генератора 5. Величина линейно изменяющегося напряжения, приложенного к рабочему электроду, контролируется
1075140 относительно электроф 6 сравнения °
Возникающую в ячейке электрохемилюминесценцию регистрируют с помощью фотоэлектронного умножителя 7. Напряжение с нагрузки фотоэлектронного умножителя поступает на регистрирующее устройство (вход у двухкоординатного самописца 8). На вход X самописца поступает линейно изменяющееся напряжение, приложенное к рабочему электроду электрохи- 10 мической ячейки. При достижении линейно изменяющимся напряжением, прикладываемым к рабочему электроду, величины, достаточной для начала протекания реакций окисления 15 (восстановления) исследуемого вещества, вблизи рабочего электрода ячейки возникает электрохемилюминесценция, которую регистрируют фотоэлектронным умножителем и двухкоординатным самописцем. Из полученной графической зависимости интенсивность электрохемилюминесценции — потенциал определяют потенциал начала окисления (восстановления) .
Пример 1 ° Исследовано восстановление 0,005 моль/л 1,5-дифенил-3-стирилпиразолина(ДФСП) в
N „N-диметилформамиде на фоне
0,05 моль/л (С И ) ИС10 . Композиция помещалась в трехэлектродную стеклянную электрохимическую ячейку с платиновым рабочим электродом площадью 0,2 мм и водородным элект-. родом сравнения. Через потенциостат на ячейку подавалось линейно возрастающее (по абсолютной величине) со скоростью 100 MB/с напряжение. Интенсивность электрохемилюминесцен1 ции регистрировалась с помощью фотоэлектронного умножителя ФЭУ-84 (на- 40 пряжение питания 1300 В) . Вольтамперные кривые потенциал рабочего электрода — ток через электрохимическую ячейку были получены при подключении к ячейке универсального полирографа ПУ-1.
Кривая 9 (фиг. 2) соответствует интенсивности электрохемилюминесценции (ток фотоэлектронного умножителя), кривая 10 — току через электро- 50 химическую ячейку. Ток восстановления ДФСП полностью маскируется значительно большим током разряда электролита фона (кривая 10) и определить потенциал начала восстановления
ДФСП не представляется возможным.
Из кривой 9 легко определяется потенциал начала восстановления ДФСП, который для данной системы составляет 2,05 В относительно водородного электрода сравнения °
Пример 2. Исследовано окисление 0,005 моль/л ДФСП N N-диметилформамиде на фоне 0,05 моль/л Ь1С104
Остальные условия эксперимента аналогичны приведенным в примере 1. 65
Кривая 11 (фиг. 3) соответствует интенсивности электрохемилюминесценции, кривая 12 — току, а кривая 13 фоновому току системы N,N-диметилформамид +0,05 моль/л LiC104, не содержащей исследуемого вещества
ДФСП. Анализ кривых показывает, что из кривой 11 потенциал начала окисления ДФСП (1,04 В) определяется более точно, так как он не маскируется, как на кривой 12, зарядным током и фоновым током примесей (кривая 13) .
Пример 3. Исследовано восстановление 0,002 моль/л рубрена в
N,N-диметилформамиде на фоне
0,05 моль/л LiC1 Остальные условия эксперимента аналогичны приведенным в примере 1.
Кривая 14 (фиг. 4) соответствует интенсивности электрохемилюминесценции (фототок ФЭУ-84), кривая 15 току через рабочий электрод. Кривая 16 показывает зависимость фоновой ток
1 потенциал для системы N,N-диметилформамид +0,05 моль/л LiC1. Анализ приведенных зависимостей показывает, что в данной композиции восстановление рубрена протекает параллельно с выделением металлического лития на платиновом рабочем электроде (потенциал начала выделения лития 3,15 В)
Как видно, ток восстановления рубрена (кривая 15) полностью маскируется значительно .большим по величине током разряда электролита фона (кривая 16) и определить потенциал начала восстановления рубрена не представляется возможным. Из кривой 14 легко определяется потенциал начала восстановления рубрена, который для данной системы составляет 3,25 В.
Решающим фактором, определяющим степень точности измерения, является отношение полезного сигнала к мешающему шумовому сигналу. Применительно к известному способу это отношение фарадеевского тока окисления (восстановления) исследуемого вещества i к фоновому току i о„, который состоит из фарадеевского тока примесей, зарядного емкостного.тока и тока разряда электролита фона. Определим это отношение для случая, изображенного на фиг. 3, где ток фона представлен кривой 13, а сумма фонового тоКа и фарадеевского тока изучаемого вещества i> — кривой 12. Для потенциала 1,2. В близи максимума тока имеем ;г -" рон 10,4- 2
2 =42 .! qps срон а для потенциала начала окисления
1,04 В получим 9 2 4 — 1 6
=- -----+-=0,5 <рон 1 „6
1075140
Подобные величины отношений сигнал/шум являются характерными и для других излучаемых аистем.
Применительно к предлагаемому способу отношение сигнал/шум определяется отношением фототока ФЭУ при регистрации электрохемилюминесценции к темноному току, который для используемого ФЭУ-84 при напряжении питания 1300 В и температуре 300 К состанляет около 2 ° 10 %. Таким образом, 10 для случая, изображенного на фиг. 3, это отношение для потенциала 1,2 В составит 4,8 ° 104, а для потенциала начала разряда уменьшится приблизительно до 5i10 ° Следовательно, отношение сигнал/шум в обоих вышеприведенных случаях превосходит до
5 10 раз аналогичное отношение для известного способа.
В случае, если в электрохимической ячейке имеется несколько веществ, способных к электрохемилюмияесценции, то идентификация потенциалов каждого из них может быть осуществлена путем регистрации интенсивности электрохемилюминесценции в максимуме спектра каждого из соединений. Более точные результаты даст регистрация через оп-, тический фильтр, частотная характерис-; тика пропускания которого .близка к . спектру электрохемилюминесценции выделяемого соединения.
Использование предлагаемого способа позволяет определять потенциалы окисления (восстановления) веществ, способных к электрохемилюминесценции 35 н области разряда электролита фона и растворителя (фиг. 2 и 4), что невозможно, применяя известные способы.
Способ определять потепциалы окисления (восстановления) веществ с не- 4() стабильными продуктами электрохимических реакций при больших скоростях ,поляризующего напряжения, когда емкостный ток превосходит фарадеенский ток.
В условиях, когда растноритель и фоновый электролит являются индиф- ферентными при электролизе, предлагаемый способ позволяет повысить точность измерения за счет устранения влияния фонового тока примесей и емкостного зарядного тока (фиг.З).
Кроме того, определение потенциала окисления (восстановления) с помощью оптического. измерения (регистрация интенсивности электрохемилюминесценции) вместо измерения фарадеевского тока позволяет снизить требования к электрическому экранированию электрохимической ячейки и через оптический канал электрически развязать входные и ныходные цепи.
Прибор для электрохимических исследований — универсальный полярограф ПУ-1, принятый за базоный объект, не позволяет определять потенциалы окисления (восстановления) в условиях, когда фононый ток соизмерим или превышает фарадеенский ток окисления (восстановления) исследуемого вещества.
Использование предлагаемого способа в этом приборе дри незначительном
его конструктивном изменении (дополнительном введении в цепь между электрохимической ячейкой и регистрирующим прибором устройства для регистрации света) познолит для веществ, способных к электрохемилюминесценции, увеличить точность измерения эа счет снижения шумоного фактора более чем в 5 ° 10 раз, уменьшить трудоемкость подготовки растноров для исследований эа счет снижения требований к чистоте. исходных компонент и влиянию окружающей среды (0, пары И О), расширить номенклатуру исследуемых соединений, дополнив ее веществами-, потенциалы окисления (восстановления) которых лежат в области разряда растворителя и электролита фона.
1075140
A@ —.3
Составитель Г.Дамешек
Редактор Т.Кугрышева Техред А.Бабинец Коррект орЗ - Тя с к о
Заказ 489/36 Тирам 823 . Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5 .9
Филиал ПЛП Патент, г.Ужгород, ул.Проектная, 4