Способ получения производных цефалоспорина или их солей и его вариант
Иллюстрации
Показать всеРеферат
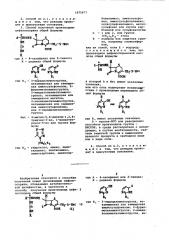
1. Способ получения производных цефалоспорина общей формулы Н -pHCONH 4 А Д-Нх г СНг-Б-Ве со ОООЕ NH где А - 4-оксифенил или 2-тиенил; R - радикал обшей формулы .он Пг а или н-ув Rt RI где R - 3-пиридиламиногруппа, незамещенная или замещенная аминосульфонилом, 2-фурилметиламинОгруппа , 2 имидазолилметиламиногруппа , незамещенная или замещенная метилом, 2-тиенилметиламиногруппа , незамещенная или замещенная аминосульфонилом , или -пиридилметиламиногруппа; Het - 4-метил-5,6-диоксо-1,2,4триазин-3-ил , 1-винилтетразол-5-ил или группа формулы N-X II (I V I )X2 где Rj - гидроксил, амино, диметиламино , ацетиламино, аминокарбонил , аминокарбониламино , аминосульфонгил, аминосульфониламино, оксисульфониламино , метилсульфонил или группа карбоновой или сульфокислоты; п - 1 или 2, или группа СП (CH2)j,R 2 - этил; Е - водород ,или защитная группа например сложноэфирная, или их солей, если Е - водород, отличающийся тем, что производное 7-аминоцефалоспоранрвой кислоты общей формулы ЯоН. I S J Nj CHrS-Het СП О СООЕ ф в которой Het и Е имеют указанные значения, подвергают взаимодействию с уреидоVI карбоновой кислотой общей формулы к-ад-со-йн-сн-соон А где А и R имеют указанные значения, или с ее солью, или реакционноспособным производным в среде растворителя с последующим, в случае необходимости , снятием защитной группы и выделением целевого продукта в. свободном виде или в виде соли.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТY раэол-5-ил или группа формулы М
I (Н2)„К, СООЕ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЬП ИЙ (21) 3361699/23-04 (22) 07.12.81 (31) Р 3047082.7 (32) 13 ° 12.80 (33) ФРГ (46) 23.02.84. Бюл. 9 7 (72) Бернд Ветцель, Эберхард
Войтун, Вольфганг Рейтер, Роланд
Майер, Уве Лехнер и Ганнс Гет (ФРГ) (71) Др.Карл Томэ ГмбХ (ФРГ) (53) 547.869.1.07(088.8) (56) 1. Патент СЧА Р 4088816, кл. 544/27, опублик. 1978. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
ЦЕФАЛОСПОРИНА ИЛИ ИХ СОЛЕЙ И ЕГО
ВАРИАНТ: (57) 1. Способ получения производных цефалоспорина общей формулы
Н
g — eSCOm
ЯН
00 О
N СН вЂ” 5-МеВ
1
МК
k где A — 4-оксифенил или 2-тиенил;
R — - радикал общей формулы к x m
R) K) где R - З-пиридиламиногруппа, 1 незамещенная или эамещенная аминосульфонилом, 2-фурилметиламиньгруппа, 2имидазолилметиламиногруппа, незамещенная или эамещенная метилом, 2-тиенилметиламиногруппа, незамещенная или эамещенная аминосульфонилом, или -пиридилметиламиногруппау
Het — 4-метил-5,6-диоксо -1, 2,4триаэин-3-ил, 1-винилтет.,80„„107 9 А
Ь(51) С 07 0 501/061 С 07 Э 501/36ll
A 61 К 31/545 где Н2 — гидроксил, амина, диметиламино, ацетиламино, аминокарбонил, аминокарбониламино, аминосульфонил, аминосульфониламино, оксисульфониламино, метилсульфонил или группа карбоновой или сульфокислоты
n - 1 или 2, или группа (СН ) „R > — этил;
Š— водород,или защитная группа например сложноэфирная, или их солей, если Š— водород, отличающийся тем, что производное 7-аминоцефалоспорановой кислоты общей формулы к,к
М - СН2 З Het
О сооК в которой Het и Е имеют указанные значения, подвергают взаимодействию с уреидокарбоновой киалотой общей формулы
R -оо- -)н-ооон где A u R имеют укаэанные значения, или. с ее солью, или реакционноспособным производным в среде растворителя с последующим, в случае необходимости, снятием защитной группы и выделением целевого продукта в, свободном виде или в виде соли.
1075977
Q00E
Щ-3-Bet
000Н ан о ю -м вн
Е1 Е1
Изобретение относится.к способам получения навьи< производных цефалоспорина, обладающих антибиотической активностью, в частности к способу, получения производных цефа- 5 лоспорина общей формулы
A-СЫСОЯЕ ! 1 2 где Rz - З-пиридиламиногруппа, не10 эамещенная или замещенная аминосульфонилом, 2-фурилметиламиногруппа, 2-имидазолилметиламиногруппа, неж-s-не
МВ
2. Способ по п.1,.о т л и ч а юшийся тем, что реакцию проводят в присутствии основания.
3. Способ получения производных цефалоспорина общей формулы
А-СНСОЯН 3
КН
1 СИ,-Я Xlt
СО О
Я. где A — 4-оксифенил или 2-тиенил;
R — - радикал общей формулы а, где R - З-пиридиламиногруппа, 1 незамещенная или .замещенная аминосулвфонилом, фурилметиламиногруппа, 2-имидаэолилметиламино-. группа, незамещенная или замещенная метилом, 2-тиенилметиламинагруппа, неэамещенная или эамещенная аминосульфонилом, или 3-пиридилметиламиногруппа;
Het - 4-метил-5,б-диоксин-l,2,4 триазин-3-ил, 1-винилтетраэол-5-ил или группа формулы
К вЂ” М
1 (,QHg)„R t где R - гидроксил, амино, диме2 тиламино, ацетиламино, аминокарбонил, аминокарбониламино, аминосульфонил, аминосульфониламино,: оКсисульфониламино, метилсульфонил или группа карбоновой или сулъфокислоты;
n — 1 или 2, или группа (СН ) R - этил;
Š— водород или защитная группа, например слозноэфирная, или их солей, если Е - водород; отличающийся тем, что производное цефалоспорановой кислоты общей формулы в которой А и Het имеют указанные значения,, или его соль подвергают вэаимод йствию с производным пиримидина общей формулы
В В где R имеет указанные значения;
 — группа-NCO или реакционноспособное производное группыNHCOOH, в среде растворителя с последующим, в случае необходимости, снятием защитной группы и выделением целевого продукта в свободном виде ,или в виде соли.
4. Способ по п.3, о т л и ч а юшийся тем, что реакцию прово- дят в присутствии основания..
3 где A — 4-оксифенил или 2 -тиенил
R — радикал формулы
1075977 замещенная или замещенная метилом, 2-тиенилметиламиногруппа, .незамещенная или замещенная аминосульфонилом, или 3-пиридилметиламиногруппа; 5
Het - 4-метил-5,6-диоксо-1,2,4триаэин-3-ил, 1-винилтетразол-5-ил или группа формулы
15 где R> - гидроксил, амино, диметиламино, ацетиламино, аминокарбонил, аминокарбониламино, .аминосульфонил, 20 аминосульфониламино, оксисульфониламино, метилсульфонил или группа карбоновой или сульфокислоты1
n — 1 или 2, или группа 25 (СН ) „R.2 означает этил;
Š— водород или защитная группа, например сложноэфирная, или их солей, если Š— водород, а также к его варианту. 30
Известен способ получения обладающих активностью антибиотика
7-ациламидопроиэводных цефалоспорина, заключающийся в том, что-соответствующее 7-аминопроиэводное 35 цефалоспорина подвергают соответствующему ацилированию (1 .
Целью изобретения является получение новых производных цефалоспорина, обладающих высокой антибиотичес- 40 кой активностью.
Поставленная цель достигается способом получения производных цефалоспорина общей формулы Х, заклю.чающимся в том, что производное
7-аминоцефалоспорановой кислоты об- 45 щей формулы н
0 ЕВ -З-Не (П), ЯОЕ
50 где Het и Е имеют указанные значения, подвергают взаимодействию с уреидокарбоновой кислотой общей формулы
R-36, С0 ЗН-СВ-ЮООЕ
Q@) где А и R имеют указанные значения, или с ее солью, или реакционноспо- 60 собным производным в среде растворителя с последующим, в случае необходимости, снятием защитной группы и выделением целевого продукта в. свободном виде или в виде соли. 65
Реакцию можно проводить в присутствии основания.
Поставленная цель достигается также вариантом способа получения производных цефалоспорина общей формулы I, заключающимся в том, что производное цефалоспориновой кислоты общей формулы
a-)scmm В й 4 х en -s-не
ОООН (® в которой A u Het имеют указанные значения, или его соль, подвергают взаимодействию с производным пиримидина о6щей формулы
В
0 у Дили
X NH 1 где R имеет указанные значения;
 — группа-NCO или реакционно-. способное производное груп« пы-NHCOOH в среде растворителя с последующим, в случае необходимости, снятием за-. щитной группы и выделением целевого продукта в свободном виде или в виде соли.
Реакцию можно проводить в присут- ствии основания.
Пример 1 ° Натриевая соль
7Д- (D-d.-(3-(2-(5 -аминосульфонилI
2 -тиенилметиламино)-4-окси-5-пиримидил)-уреидо3-и-гндроксифенилацетамидоj-3- ((1-(2 -оксиэтил)-тетразол-5-ил)-тиометил1-цеф-3-ем-4-карбоновой кислоты.
2,72,г (0,005 моль) D-d-(3-(2I (5 -аминосульфонил-2 -тненилметил-амино-4-окси-5-пиримидинил)-уреидо3-й-оксифенилуксусной кислоты растворяют в 30 мл сухого диметилформамида. Добавляют раствор 2,62 r (0,005 моль) дифенилметилового эфира 7-амино-3- ((1-(2 -гидроксиэтил).— тетраэол-5-ил)-тиометил 7-цеф-3-ем4-карбоновой кислоты в 30 мл сухого метиленхлорида. К этому раствору добавляют при охлаждении льдом 1,13 г дициклогексилкарбодинмида и размешивают в течение 2 ч прн 10 С и 6 ч при комнатной температуре. Тонкослойная хроматография показывает, что исходные продукты почти полностью прореагировали. Затем фильтруют, сгущают и сушат фильтрат в вакууме, размешивают тщательно дважды в каждом случае с 50 мл метанола и один раз с 100.мл метиленхлорида. Отсасывают остающийся твердый продукт, тщательно промывают эфиром и еще раэ подвергают тонкослойной
1075977 сасывают, тщательно промывают эфи= ром и сушат в вакууме.
Выход натриевой соли (в пересчете на используемое производное цефалоспорина) 2,71 r (61%).
5 ИК-спектр: 1760, 1655, 1615, 1550 см "
Спект1 ЯИР (ДИСО + CD>OD) сигналы при ч./мин.: 3,55(m,2Н), 3,75 (m,2Н), 4,2-4,,6(ш,2+2+28), 4,90(d, 1() 18), 5,45(в,lH), 5,65(d,18), 6,75 (6,2Н), 7,0(d,lH), 7,25(Й;28), 7,40(6,18), В,15(s,.lH) °
Аналогично примеру 1 синтезируют натриевые соли цефалоспорина общей
15 ФоРмулы .I,» где R - Радикал Форму
93 лы I приведенные в табл. 1.
Я, 20
Таблица 1
М М4
Het
:Пример A
1760
1155
1 760
1640
1660
1760
1655
Пример 6. Натриевая соль
7-(О-Ы-(3-(2-(5«аминосульфонил)-2I
-тненилметиламино)-4-окси-5-пиримидинил)-уреидо1-й-оксифенилацетамидо
3- ((1-(2-аминоэтил)-тетразол-5-ил)-, 60 гнометил)-цеф-3-ем-4-карбоновой кислоты.
Получение проводят аналогично примеру 1;исходя из указанной уреидокарбоновой кислоты и вивимолеку- 65 хроматографии на силикагелевой колонке (метиленхлорид:метанол 4:1).
Выход эфира 3,46 г (65,5%)., Полученный таким образом продукт суспендируют в малом. количестве метиленхлорида и при охлаждении льдом в течение 30 мин размешивают с 2 мл анизола и 10 мл трифторук— сусной кислоты, причем образуется раствор. Затем добавляют дважды
50 мл толуола и сгущают досуха в вакууме. Разбавляют эфиром и отсасывают. для получения натриевой соли продукт растворяют в малом количестве диметилформамида, добавляют рассчитанное количество этилгекса ноата натрия в метаноле и разбавляют эфиром. Осажденный продукт отИК- Спектр ЯИР (QNCO+CDgOD) спектр, сигналы при ч./мпн см""
3 у 55 (Ш, 28), 4, 30 (m, 48), 4,95(d,lH), 5,35-5,90(m, 4Й), 6,65-7,0(m,4Н), 7,25(d,2Н), 7,40(d,lH), 8 15(s 18) °
3, 0 (ш, 2Н), 3 < 55 (m, 2Н), 4, 25 (ш, 4Н), 5, 0 (й, 18)
5 45 (sp 1Í), 5 g 65 (dg 1H)
6g75(dg2H) ю 6g95(йюlH) g
7,25(6,28), 7,40 (6,1Н), 8,10(в,18) у. Зю 55 (mi28) 3,80 (ше 2Н) i ..
4, 2-4,6 (ш,6Н), 4,95 (сЫ,18), 5, 55 (dd, 18), 5, 75 (з,шир., 1Н), 7,0(ш,4Н), 7,3" 7,5. i (ш,2Н), 8, 15 (s, 1Н) °
3, 60 (m, 2Н), 4, 70 (m, 48), 4,95 (d, lH) ° 5, 30-5,90 (ш, 4Н), 6, 75 (d, 2Н), 7, 30 (шу38), 7,7 (m,18) у18,1 (sgl8) 8,5(m,28). лярного количества дифенилметилового эфира 7-аж но-3- I(1-(2 -бу,тоисикарбониламиноэтил)-тетразол -5-ил)-тиометил1-цеф-3-ем-4-карбоновой кислоты. Выход после отщеплення защитных групп и получения натрневой соли 43,5Вр
ИК-спектр: 1760, 1675, 1600 см .
Спектр ЯМР (ДИСО + СО 00) сигна лы при ч./млн: 3,15(m,2Ít, 3,55(m, 1075977
ИКспектр, см
Het
Пример
1660 ев,сн,ш:орла, 2Н), 4,35(т,бН), 4,95(d,lH), 5,55 (в,lН) 5,70(d,lH), 6,75(d,2Н), 7,05 (d,2Н), 7,25 (d,2Í), 7,4 (d, 1Н), 8 15(s 1H) .
Пример 7. Натриевая соль
7-f D-с(-(3- (4-окси-2- (4-метил-2 -имидазолилметиламино)-5-пиримидинил)еидо|-и-оксифенилацетамидо )-3- . (- (1-(2 -ацетиламиноэтил)-тетразол-5-ил)-тиометил)-цеф-3-ем-4-карбоновой кислоты. 10 .В раствор 830 мг (0,002 моль)
D-<Ü-(3-(4-окси-2-(4 -метил-2 -имида( эолилметиламино)-5-пиримидинил)уреидо)-((-оксифенилуксусной кислоты в 20 мл сухого диметилформамида до- 15 бавляют 0,2 г N-метилморфолина. Раст,вор охлаждают до -15 С и при этой о .температуре добавляют по каплям раствор- 0,22 г этилового эфира хлормуравьиной кислоты в 5 мл мети- 20 ленхлорида. Полученную смесь выдерживают при этой температуре
45 мин. Затем при .-15 C добавляют по каплям раствор 1,12 г (0,002 моль) фенилметилового эфира 7-амино-3- (1-(2 -ацетиламиноэтилтетразол-5I
-ил) -тиометил l-цеф-3-ем-4-карбоновой кислоты в 20 мл сухого метиленхлорида. Размешивают в течение одного часа при -10 С и затем медленно доо водят до комнатной температуры. Раст30 вор сгущают досуха в вакууме и затем обрабатывают, как описано в примере 1. Отщепление защитной эфирной группы проводят также аналогично примеру 1. Выход натриевой соли 900 мг (54%) °
ИК-спектр: 1760, 1650, 1610,,3.550 см ".
Спектр AMP (дМСО + CDqOD) сигйа- 40 яю при ч./млн: 1,85(s,ÇH, 2,1(s, ЗН) 3,6 (m,2+2H), 4,2-4,5 (m,2+2+2Н), 5 05(d, lH), 5,45 (s, lH), 5,65 (d, 1H), бу 75 (ш,2+1Н), 7, 25 (d, 2Н), 8, 10 (s, 1Н) ., 1 2 3 НО
/ t
Пример 8. 7-(D-((-(3-(2-(5 аминосульфонил-2 -тиенилметиламино)4-окси-5-пиримидиннл)-уреидо)-((-ок-. ,сифенилацетамидОЯ-3- ((l-Оксисульфо,нилметилтетразол-5-ил)-тиоометил1-цеф-3-ем-4-карбоновая кислота. путем взаимодействия 495 мг (0,001 моль) урендокарбоновой кислотЫ, используемой в примере 1, с
N-метилморфолином и этиловым эфиром хлормуравьиной кислоты аналогично примеру 7 получают ахтивированный ангидрид. K суспензии 410 мг (0,001 моль) 7-амнно-3- ((1 †оксисуль-. фонилметилтетразол-5-ил)-тиометил)цеф-3-ем-4-карбоновой кислоты в
20 мл безводного ацетонитрила добавляют 600 мг N,î -био -триметилсилилацетамида, получая при этом раствор, Этот раствср ОхпаждаЮт дО -15 С и при комнатной температуре добавляют каплями к раствору активйрованного ангидрида. Затем смесь размешивают в течение 1 ч при -10 С и в течение 1 ч при 10 С. Затем добавляют 2 мл метанола и отфильтровывают нерастворимое вещество, после чего растворитель удаляют в вакууме. Остаток вводят в
40 мл воды и добавляют до значения рН 7,0. При этом значении рН два раза встряхивают с уксусным эфиром. При охлаждении льдом водную фазу разбавленной соляной кислотой доводят до рН 2,9. Осажденный продукт ОтсасыВают, промыВают ВОДОЙ и сушат в вакууме. Выход 445 мг (57% ) .
ИК-спектр: 1760, 1660, 1600 см
Спектр ЯМР (ДИСО + С0((00) сигналы при ч./млн: 3,60(m,2Í), 4,254,45 (m,4Н), 5,0 (m, ЗН), 5, 55 (s, 1Н), 5,70(й,1Н), 6,75(6,2Н), 7,0(йф1Н) у, 7,25 (d,2Н), 7,45 (d, lH), 8,15 (s, 1Н) .
Аналогично приведенным примерам синтезируют цефалоспорины общей формУлы I сведенные в табл.2.
1 Таблица 2
Спектр ((ИР (/@NO+CD>OD) сигналы при ч./млн
3, 0 (m, 2Н), 3, б (Ф, 2Н), 4,2-4,5 (m,бН), 4,95 (d, 1Н), 5,4 (s, Ю.Н), 5,65 (d,lH), 6,3(m 2Н), 6,75(й,2Н)r 7 25(dt2Н), 7,45(в,lН), 8,1(s lH) °
1760 3,55(ш,2Н}, 3,8(m,2Н), 4,2-4,5(m,бН), 4,95(d
1Н), 5,40(в(,1Н), 5 6
1610 (d,lН)(6,75(d,2Н), 7,25(m,3H), 7,65(m,lH), 8,1 (s, 1Í), 8,45 (m,2Н) .
1075977
Продолжение табл. 2 Ц
em< es2cosa2
QgH5
3fg
«».
QHg6(фИ
$0g3Hz сн,арин но» - ннон;
3I ИЗ
x (%
12 ео-О. нн,но»у Х
1 4 «ИО -gg 1
ЮФЮ
Пример 15. Натриевая соль
7-(D-о -ГЗ-(2-(5 -аминосульфонил 2—
t t
-тиенилметиламино)-4-окси-5-пиримидинил)-уреидо3-и-оксифенилацетамидо)3- ((1-(2 -диметиламиноэтил)-тетра.зол-5-нл)-тиометил)-цеф-3-ем-4-карбоновой кислоты.
Из 2,72 г (0,005 моль) D-Û-(3- 4р .-(2-(5 -аминосульфонил-2 -тиенилмемиламино)-4-оксн-5-пиримидил)-уреидоJ--п-оксифенилуксусной кислоты и 1,36 г
7-аминоцефалоспорановой кислоты получают аналогично примеру 8 2,08 г 45 (57%) 7-ID-aL- (3-(5 -аминосульфонил 2 -тиенилметиламино)-4-окси-5-пирнмидинил)-уреидо -tl-оксифенилацетамндо -3-ацетоксиметилцеф-3-ем-4-карбоновой кислоты.
500 мг этого цефалоспорина в 5р
20 мл буферного раствора фосфорной кислоты с рН 6,3 совместно с 200 мг
1-(2 -диметиламиноэтил).-5-меркаптоа тетраэола нагревают до 70 С в течение 6 ч в атмосфере азота, при- 55 чем значение рН держат между 6 и 6,5. Эатем реакционную жидкость охлаждают, нерастворимые вещества отфильтровывают и два раза встряхивают с эткловым эфиром уксусной бр кислоты. Эатем при охлаждении до1760 2, 1 (s, ЗН), 2, 5 (а, 2Н), 3,60(а,2Н), 4,3(а,бН), 5,0 (d, 1Н), 5 40 (s, 1Н), 1600; 5, 60 (d, 1Н), 6, 75 (а, ЗН), >
7,25(<,2Н), 8,05(з,lн).
1760 1,0 (tg ЗН), 2,05 (з,ÇH)
1650 3,55(а,2Н), 4,3 (а,бН), 4,90(d,lH), 5,40(s,lH), 5,65(d,.lH), 6,7-6,9(а, 2+1Н), 7,25(dg2H) g
8,10(з,lH) 1760 3, 5 (а, 2Н), 4 3 (l6, 6Н)
1660 4,95(Й,1Н),5,45(зi1Н) i
5,65(6,1Н), бу75(6,2Н), 7,25(6,2Н), 7,4(а,1Н)у
8, 05 (s, lH), 8,2(а,2Н), ю
1760 3,65(m,2Í), 4,3-4,8(ш,4Н), 1655 4 95 (de 1Н), 5,45 (з, 1Н), 5,65 (d ° 1H) б, 75 (6,2Н), 7,25(d,2Н), 7,4(m lH) у
8,05(s,lH) 8,2(m,2Н) н бавляют соляную кислоту до рН 2 8 °
Осажденный продукт отсасывают, промнвают водой и сушат . Остаток переводят в натриевую соль. Выход 64н.
ИК-спектрг 1760, 1660, 1600 см ".
Спектр ЯИР (JQCC0 + С0ЗОН) сигналы при ч. /млн: 2.,35(s,бН), 2,80 (m, 2Н) ., 3,60 (m, 2Н) ., 4, 30 (m, 6Н), 4,95 (d, 1Н)., 5о45 (s 1Í)., 5.,65 (d, 1Í) ф
6,75 (d., 2Н) ., 7., 05 (d 1H), 7, 30 (d,2Н), 7, 45 (d, lH) 8, 15 (s, 1Н) .
Пример. 16. Натриевая соль
7З"(D-н(; (3-(2-(5 -амнносульфонил-2 отиенилметиламино)-4-окси-5-пиримидинил)-уреидо)-и-оксифенилацетамидо)-3- ((1-метил-5,б-диоксо-1,3,4° триазин«2-ил)-тиометил)-цеф-3-ем-4карбоновой кислоты.
Синтез проводят аналогично примеру 15, исходя as указанного производного цефалоспорина и 4-метил2-меркапто-5,6-диоксо-1,3,4-триаэина.
Спектр ЯИР (ДИСО + С0300) сигналы при ч./млн.: 3,55(m,2Н +S,ÇH), 4,35{а,4H), 4,90(d,lÍ), 5,50(s,lН), 5 65(Й,1Н), 6, Э5(6,2Н), 7ф05(йу1Н) g
7,25 (Й,2Н), 7,40 (d, 1Н), 8,15 (з, 1Н) .
Аналогично примеру 15 получают соединения общей формулы Г, указанные в табл.З.
1075977
Та блиц а 3
Пример
Het пектр м
3 — _#_ ьI EO / щ Ql I>l 760
I сз,заж,-а "
З у— 3
18 НО « 35%< (((li > 1760
М
2
K сЦ q(3 1610
3 +3_#_ — М
19 Щ / 1 «@ 1 ) 1760
jf ф 1660
I I
И, СН,СН,З0,СН,"55
К ив
20;ЯО X -Я9!Я X I 1760
1650 .СН СН ИН5О НН г г г
4H), 4,4 (m, 6Н), 5,45 (s, 1Н), р 6i75(dg2H) t
7,65(m 1Н)
8,50(m,2Н) °
3,1-3,7(m, 5,0(d,lH), 5,65(d,lÍ)
7,25(m,ЗН)
8,1(s,lН), дистиллированной водой или соответствующим растворителем.
4п В углубления в микротнтровальных пластинках подают 0,2 мл питательной среды, 0,01 мл раэбавленного соединения и 1 каплю (0,02 мл) суспенэии зародышей и в течение
45 18 до 20 ч подвергают инкубацни при 37 С. Всегда проводят контроль с растворителем.
Тест-организмами являются:
Staphylococcus aureus SG 511, Escherichia cori ATCC 11775, Рзеийо50 monas aeruginosa Hamburgensis, Pseudomonas aeruginosa ВС 19, Serratia marcescens ATCC 13880, KCebsieРОà pneumoniae ATCC 10031, ВС б, Proteus ппгаЬ М i s ВС 1 7, 55 Proteus . re ttger i, En te robac ter
cfoacae АТСС 13047, Е.cali R+TEM (носитель| -лактамаэы).
Натриевая соль 7р-(D-Ы-(3-(4окси-2-(3 -пиридилметиламино) -5«
60 пиримидинил)-уреидо)-и-оксифеннлацетамидо(-3- ((1-(2 -оксиэтил)— тетразол-э-ил)-тиометил7-цеф-3-ем4-карбоновой кислоты (соединение А).
Натриевая соль 7fl-(Р-ВЯЗ-(2-(5
65 мминосульфонил-2 -THeHHJIMeTHJIaMH
Антибиотическая активность новых производных цефалоспорина.
Опыт in vitro.
Исследуеьые соединения применяют в следующих концентрациях: 128; 64;
32; 16; 8; 4; 2; 1; О 5; 0 25; 0,12;
0,06 мкг/мл. Используется питательная среда следующего состава: 10 r пептона, 8 r мясного экстракта-оксоида, 3 г хлорида натрия, 2 r втор.-фосфата натрия и до 100 мл дистиллированной воды (рН среды
7,2-7,4). Возраст первичных культур составляет приблизительно 20 ч.
Установление суспензии зародышей осуществляют с помощью фотометра (диаметр пробирки составляет 14 мм, фильтр 546 нм) по помутнению,сравнительной суспензии сульфата бария, получаемой добавлением 3,0 мл
13-ного раствора хлорида бария к
97 мл 1%-ной серной кислоты. После установления тест-микробы раствором поваренной соли разбавляют дальше в соотношении 1:1500;
l6 мг соответствующего соединения подают в мерную колбу емкостью 10 мл и растворителем дополняют до маркировки. Далее разбавляют
Спектр ЯМР (ДИСО + СП 00) сигналы при ч./млн.
3, 55 (m, 2Н), 4, 35 (m, 4Н), 4,8-5,1(m,2+1Н), 5,4 (s,1H), 5,6(d,lH),6,25 (m,2Н), 6,75(d,2Н), 7, 25(d, 2H), 7, 40 (s,øèð., 1Н), 8,10(s,lН).
2,15(s,ЗН), 3,65(m,2Í), 4,35-4,80(m 6Н), 4,95(d, 1Н), 5,35(s,lН), 5,60(й, 1Н), 6,75(m,ÇH), 7,25(d, 2Н), 8,10(s,lН).
2,15(s,ЗН), 2,85(s,ЗН), 3,5-3,8(m,4Н), 4,3(m,бН), 4, 95(d, 1H), 5,40 (s, 1H), 5,60(d,lH), 6,75(m,ЗН), 7, 25 (6, 2Н), 8, 10 (з, 1Н) °
1075977
13 но)-4-окси-5-пиримидинил)-уреидо -п-оксифенилацетамидо $-3- ((1-(2"-оксиэтил)-тетразол-5-ил)-тиометилЦ-цеф-3-ем-4-карбоновой кислоты (соединение Б).
Натриевая соль 7Р- (О-а -(3-(2-(5 -аминосульфонил-2 -тиенилмвтиламино)-4-окси-5-пиримидинил)-уреидо)-n-оксифенилацетамидо -3-f(l-(2 -аминокарбонилэтил)-тетрйзол-5-ил)
-тиометил)-цеф-3-ем-4-карбоновой ,кислоты (соединение В).
Таблица 4
E.cori
ATCC
11775
Соеди- Staph. нение aureuв
Сс
Pseud. Pseud. Serr. Kt.pneum.
Hbg. ВС 19 marcesc. ATCC
Атсс 1ОО31
13880
ОР12
0,25 0,25
О,об
0,12
0,25
1 0,12
0 5
О;25
0,5 0 25 8
0,25
0,5
Цефуроксим
3128 >128 8
Продолжение табл. 4
Е. cori
R+TEM
Kf.pneum. Prot. Prot. Ent.
ВС 6 virab. rettg. c(oacae
ВС 17 ATCC
13047
Соединение
0,5
0,5
0 12 0,5
0,12 0,25 0,25 4, 0,25
0 25
0,25
0 25 0 5
0 25 1
0,5
0,5
Цефуроксим ния при оральной даче показывают
60 ЭД О выше 4 r/êã, при подкожной даче выше 2 r/êã, т.е, онн практически нетоксичны.
Активность соединений табл.5 также исследуют in vivo с помощью экспериментальных инфекций на мыОструю токсичность определяют пероральным и подкожным применением соединений табл.5 на крысах повышающимися дозами.
ЭД является дозой, после апплнкацйи которой 504 животных в течение 8 дней умирают. Все соедине14
Натриевая соль 7p- fD-К-13- (2- (2 —
-фурилметиламино)-4-окси-5-пиримидинил)-уреидо)-О-оксифенилацетамидо )-3- ((1-(2 -метилсульфонилэтил)— тетразол-5-ил)-тиометил)-цеф-3-ем-4-карбоновой кислоты (соединение Г). и торговый продукт цефуроксим в качестве сравнения.
В табл.4 указаны данные по минимальной концентрации торможения
".оединений (в мкг/мл).
1075977
Таблица 5 шах. В качестве патогенных бактерий используют E.cori ATCC 11775. С помощью 0,2 мл суспензин бактерий (с 5Ф муцина) вызывают внутрибрюшинную инфекцию. Это соответствует приблизительно 1,4 ° 10 бактерий
Е.cori/мышь. Самки штамма NMRI подразделяют на группы иэ 10 животных кал дая, две группы остаются необработанными, самкам остальных групп подкожно дают различные дозы соответствующего соединения для определения ЭД 0 (доза, при которой 50% аивотных выкивают). Терапию осуществляют один pas через
60 мин после иньекции.
Период наблюдения в обоих случаях составляет 7 дней. Результаты этого опыта приведены в табл.5.
ЭД мг/кг
Соединение
0,9
0t4
10
0,7
1-2
Цефуроксим
>100
Заказ 540/54 Тирах 410 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, й-35, Раушская наб., д. 4/5 алкал ППП . Патент, г. Уагород, ул. Проектная, 4
Составитель З.Латыпова
Редактор Н.Егорова Техред В.Далекорей Корректор A.Çèìîêîñîâ