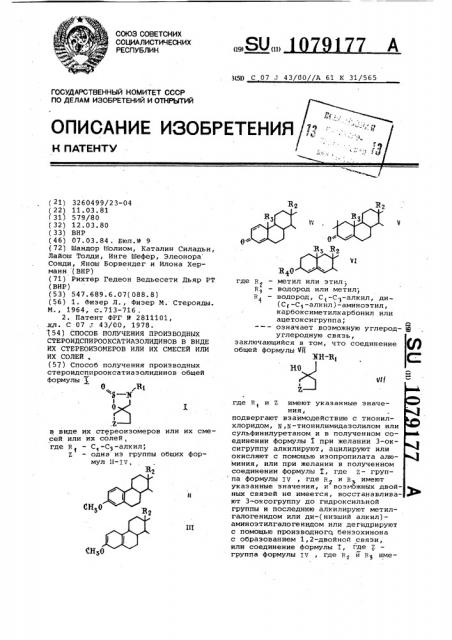
Способ получения производных стероидспирооксатиазолидинов в виде их стереоизомеров или их смесей или их солей
Иллюстрации
Показать всеРеферат
Способ получения производных стероидсппрооксатиазолидинов общей формулы 5 Bi S-If d .z в виде их стереоизомеров или их смесей или их солей , где к, - С,-Сз-алкил, Z - одна из группы общих формул 1I-IV, 2 III СНхО ХП где R - метил или этил EJ - водород или метилу R, - водород, С,-С -алкил, ди (С(-С -алкил)-аминоэтил, карбоксиметилкарбонил или ацетоксигруппа; -- означает возможную углерод- sg углеродную связь, (Л заключающийся в том, что соединение общей формулы VII H-R, НО Vll где R и Z имеют указанные значе 1 ния, подвергают взаимодействию с тионил хлоридом, N,К-тионилимидазолилом или сульфинилуретаном и в полученном соединении формулы I при желании 3-окVI сигруппу алкилируют, ацилируют или окисляют с помощью изопропилата алюминия , или при желании в полученном соединении формулы I, где z- группа формулы IV , где R, и RJ имеют указанные значения, и вoз oжнЫx двойных связей не имеется, восстанавливают 3-оксогруппу до гидроксильной группы и последнюю алкилируют метилгалогенидом или ди-(низший алкил)аминоэтилгалогенидом или дегидрируют с помощью производного бензохинона с образованием 1,2-двойной связи, или соединение формулы Г, где z группа формулы iv , где к и К име
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К IlATEHTY
+5 2
R 0 сн о
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 3260499/23-04
22) 11.03.81
31} 579/80 (32) 12.03.80 (33} BHP (46) 07.03.84 . Бюл.9 9 (72) Шандор Шолиом, Каталин Силадьи, Лайош Толди, Инге Шефер, Элеонора
Сонди, Янош Борвендег и Илона Херманн (ВНР) (71) Рихтер Гедеон Ведьесети Дьяр PT (ВНР) (53) 547. 689. 6 . 07(088. 8) (56) 1. Физер Л., Физер М. Стероиды.
М., 1964, с.713-716 .
2. Патент ФРГ Р 2811101, кл. С 07,т 43/00, 1978. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
СТЕРОИДСПИРООКСАТИАЗОЛИДИНОВ В ВИДЕ
ИХ СТЕРЕОИЗОМЕРОВ ИЛИ ИХ СМЕСЕЙ ИЛИ
ИХ СОЛЕЙ, (57) Способ получения производных стероидспирооксатиазолидинов общей формулы
0,,Я1 ф .2 в виде их стереоизомеров или их смесей или их солей, где R1 — С,-С -àëêèë, Z — одна из группы общих формул li-IV, 2
„„SU„„77 А
3(5П С 07 J 43/00//A 61 К 31/565 где R — метил или этил
R — водород или метил;
R — водород, С l -C>-алкил, ди(C< -С -алкйл)-аминоэтил, карбоксиметилкарбонил или ацетоксигруппа;
Ф вЂ” — — означает возможную углерод- Е углеродную связь, заключающийся в том, что соединение общей формулы Й( жн-в, где R Z имеют указанные значе1 ния, подвергают взаимодействию с тионилхлоридом, N,N-тионилимидазолилом или сульфинилуретаном и в полученном соединении формулы Х при желании 3-оксигруппу алкилируют, ацилируют или окисляют с помощью изопропилата алю миния, или при желании в полученном соединении формулы f, где Z- группа формулы IV где Rg u Rp имеют укаэанные значения, и возможных двойHblx связей не имеется, восстанавливают 3-оксогруппу до гидроксильной группы и последнюю алкилируют метилгалогенидом или ди-(низший алкил)— аминоэтилгалогенидом или дегидрируют с помощью производногц бензохинона с образованием 1,2-двойной связи, или соединение формулы Т, где Z группа формулы IV где р и Rg име1079177
Qi 15
ОФ Ъ 2
З О
0» ют указанные значения, подвергают взаимодействию с метилйодидом в присутствии трет-бутилата калия при
-70 С, после чего целевые продукты
Изобретение относится к способу получения новых производных стероидспирооксатиахолидинов общей формулы .0 „. 31
5 р —.К где R . — С<-Сэ- алкил;
Е Одна иэ группы Общих фор
1 мул
4. где R — метил или этил
R " водород или метил, Р4 - водород, С вЂ” С -алкил, ди-(С4-С -алкил)-аминоэтил, карбоксиметилкарбонил или ацетоксигруппа 35
--- означает возможную углеродуглеродную связь, в виде их стереоизомеров или их смесей или их солей, проявляющих значительную антиминера- 40 локортикоидную активность.
Известно, что альдостерон, гормон коры надпочечника, играет важную роль при регулировании солевого баланса в организме f1) и (27 .
В патологических случаях вырабатывается больше альдостерона, который .вызывает ретенцию ионов натрия, что ведет к образованию отеков вследствие нарушенной деятельности печени и почек, а также отеков сердечного исхо- 5О да.С помощью соединений с антиминерало-кортикоидным действием, например, 17-спиролактона прогестерона (Ц, тормозится вредное действие этовыделяют в виде отдельных стереоиэомеров или смесей или их солей в случае, если Р 4 — ди-(С -C>-алкил)-аминоэтил или карбоксиметилкарбонил.
2 го гормона; они способствуют выводу ионов натрия через клетки канальцев почек и опорожнению отеков. Соединения с альдостерон-антагонистическим действием, таким образом, оказывают диуретическое действие и образуют особенно значительную группу мочегонных средств.
Цель изобретения — получение новых стероидных производных,.обладающих преимуществами в фармакологической активности перед известными структурными аналогами.
Указанная цель достигается тем, что согласно способу, основанному на известном методе получения стероидных спирооксазолидинонпроизводных путем циклизующей конденсации 17/3-окси, 17a(, — Måòèëàìèíoàëêèëïðoèýâoäíûê стероидов с циклиэующим агентом — производными кетонов или алканолятами алюминия или щелочных металлов в.среде органического инертного растворителя и заключающемуся в том, что соединение общей формулы О!
"И где Н> и Z имеют вышеуказанные значения, подвергают взаимодействию с тионилхлоридом, g,g-тионилимидазолом или сульфинилуретаном и в полученном соединении формулы Т при желании 3-оксигруппу алкилируют, ацилируют или окисляют с помощью иэоПропилата алюминия, или йри желании в полученном соединении формулы Т, где Š— группа формулы
IV„ e R < и R> имеют указанные значения, и возможных двойных связей не имеется, восстанавливают Э-оксогрупду до гидроксильной группы и послед нюю алкилируют метилгалогенидом или ди-(низший)-алкиламиноэтилгалогенидом, или дегидрИРУЮТ С ПОМОЩЬЮ ПРОИЗВОДного бенэохинона с образованием
1,2-двойной связи, или соединение формулы Т, где Z — группа формулы Iv, где R< и R имеют указанные значения, подвергают взаимодействию с метилйодидом в присутствии трет-бутилата
S о калия при -70 С, после чего целевые продукты выделяют в виде отдельных стереоизомеров, или их солей, или их смесей, в случае, если R -ди-(С -С
1079177 алкил)-аминоэтил или карбоксиметил- состоит из экзоизомеров примерно на карбонил, известными приемами. 95%.
Пример 1. 3-Метокси-13tI- Пример 3. 3-Оксо-эстр-4-ен/ ( этил-гона-2,5(10)-диен-178-спиро-5 178-спиро-5-(З-метил-1,2,3-оксатиазо(3-метил-1,2,3 -оксатиоазолидин)— лидин)-2-оксид.
2 -оксид. (В качестве исходного вещества ис2 r 3-Метокси-13f3-этил-178-метил- пользуют 2 г 3-оксо-17(-метил-аминоаминометил-17р-гидрокси-гона-2,5(10)- метил-17(-гидрокси-эстр-4-ена и рабодиена растворяют в 100 мл осушенного тают, как в примере 1. Сырой продукт бензола. Добавляют 2 мл триэтиламина перекристаллизовывают из этанола. Пой раствор охлаждают до 5 С. при пере- )0 лучают 0,66 г кристаллического вещесО мешивании прикапывают смесь из 0,46 мл тва. Точка плавления 195-199 С, Я тионилхлорида и 4,6 мл бензола с та- :238 нм (=18100). После сгущения маточкой скоростью, чтобы температура ос- ника получают еще 1 54 r названного о ( тавалась между 5 и 10 С. Затем по- в заглавии соединения (примерно 10: 1 зволяют Реакционной смеси нагреться 1 5 смесь эндо-.эк зо изомеров ) . Точка пладо комнатной температуры и перемеши- вления 130-135 С. вают еще в течение 5 ч. Высадившийся Вышеназванное исходное соединение триэтиламин-гидрохлорид удаляют путем может получаться, например, следующим многократного экстрагирования с водой, образом. органическую фазу сушат над карбона- 8 г 3-метокси-17 -метиламинометилтом калия и упаривают. Остаток упари- 17р-гидрокси-эстра-2,5(10)-диена сус20 вания растирают с изопропиловым эфи- пендируют в 140 мл метанола, и смесь ром, и кристаллический сырой продукт смешивают со смесью из 10 мл конценперекристаллизовывают из этанола. По- трированной соляной кислоты и 5 мл лучают 1,41 г чистого продукта. Точ- воды. реакционную смесь перемешивают ка плавления 145-147 С. . в течение 3 ч при 60 С..,éoëó÷åííûA
2,5 10 -диен-178-спи
П р и м е Р 2. 3-Метокси-экстра- раствор выливают в 500 мл охлажден(-диен-178-спиро-5 -(3-метил- ного льдом 5Ъ-ного водного раствора карбоната калия. Высадившееся вещесМетод А. Работают, как в примере тво экстрагируют метиленхлоридом, 1, исходя из 2 г З-метокси-17K, †мет- 30 затем органическую фазу промывают аминометил-17Р-гидрокси-экстра-2(5 водой, сушат над сульфатом магния и () д . Сырой продукт перекрис- упаривают. Остаток упаривания пере(10) — иена. Сы ой и о таллизовывается из этилацетата о ывается из этилацетата, и IIQ- кристаллизовывают из этилацетата. лучают 1,25 г названного в заглавии Получают 5,67 г 3-оксо-17 -метилам— продукта (2:1 — смесь экзо-эндо изо- 35 нометил-17Л-гидрокси-эстр-4- на.. меров ). Точка плавления 164-167.С. Точка плавления 160-165 С,(oc) = 0
Метод В. В охлажденный до 5 С (с = 0,5, хлороформ). раствор 5,44 r имидазола и 60 мл Пример 4. 3-Метокси-эстра-. тетрагидрофурана в течение 15 мин 1,3,5(10)-триен-178-спиро-5-(3-мепРикапывают РаствоР, полУченный из рр тил-1(,2,3(оксатиазолидин)2-оксид.
1,44 мл тионилхлорида и 15 мл тетрагидрофурана. Возникшую.суспензию перемешивают в течение 2 ч, затем
Метод A. 1,65 г 3-метокси-17(< фильтр т и осадок про вают тетра- метиламинометил-эстра-1,3,5(10)-тригидрбфураном. ен-17р-ола растворяют в 20 мл метик полученному раствору при 5оС 45 ленхлоРида, и к этомУ РаствоРУ пРи в течение 30 мин приь апывают раство Р( комнатной температуре и перемешиваполученный из 2,98 г 3-метокси 17сС- нии в течение 30 мин прикапывают расметил а нометил-17р-гидрокси-экстра- твоР, пРиготовленный из 0,70 г сУль2,5(10)-диена с 50 rm тетрагидрофура . финил-уретана в 7 мл метиленхлорида. на.
Реакционную смесь через последующие
Р л полчаса встряхивают с водой сушат еакционную смесь после 2 ч пере- над сульфатом магния и упаривают. По-
I мешивания упаривают при комнатной тем- лученный сырой продукт (2,2 r) хропературе, остаток поглощают в 200 мл матографируют в силикагелевой колон5%-ного раствора натрийгидрокарбоната не со смесью, приготовленной и р ду т экстрагируют метиленхлори- 55 роформа и этилацетата в соотношении дом. Метиленхлоридный раствор промы- 3:1. Полученный путем упаривания вают водой, сушат и упаривают. Полу- продукт (1,35 r) перекристаллиэовыченный чистый сырой продукт на фрит- вают из метанола. Точка плавления те промывают изопропиловым эфиром. 168-171 С.
Получают 2,91 r изомерной смеси с со-60 Применяемый в этом примере суль,ления 152-154 отношением экзо-эндо 4:1. Точка плав- финил-уретан получают сле дующим о бя — 5 С. 1 г этого продукта разом. Раствор 29 мл тионилхлорида перекристаллизовывают из 10 мл этил- в 200 мл эфира охлаждают до -8 С заГ ацетата. Так получают 0,44 г вещест- тем в течение 1 ч при постоянном пео ва, которое плавится при 167-168 С и 65 ремешивании прикапывают раствор, по1079177 лученный из 35-6 г уретана, 66 мл пиридина и 250 мл эфира. Затем полученную суспензию в течение 30 мин перемешивают на холоде,а дальнейшие 2 ч при комнатной температуре. Осадок отсасынают и промывают эфиром.Прозрачный эфирный раствор затем упаривают, и остаток фракционируют. Получают 39,4 r N-сульфинилуретана в ниде почти бесцветной жидкости. Точка кипения 27-28 С (106 Ра). 10
Метод B. 3,31 г 3-метокси-17gметиламинометил-17J3-гидрокси эстра2,5(10)-диена растворяют в 50 мл метиленхлорида и затем при комнатной температуре в течение 1,5 ч при по- 15 стоянном перемешинании прикапывают раствор, приготовленный из 2,84 r
N-сульфинил уретана и 20 мл метиленхлорида.Реакционную смесь перемешивают в течение 4 ч, затем экстрагиру-70 ют водой, сушат и упаривают. Остаток поглощают этанолом и еще раз упаривают. Оставшееся масло кристаллизуют при растирании. После отсасывания и промывки с изопропилоным эфиром по 25 лучают 1,72 r сырого продукта, который хроматографируют в короткой силикагелевой колонне смесью 3:1 из хлороформа и этилацетата. Продукт перекристаллизовывают из метанола. Выход
1,1 r. Точка плавления 171-173 С.
Продукт идентичен полученному по методу A веществу.
П р и м е.р 5. 3j3-Гидрокси-5-андростен-17s-спиро;5-(3-метил-1,2,3Ф ! t оксатиазолидин)-2-оксид.
К суспензии, приготовленной из
14,0 r 3 ),17Р-дигидрокси-17сС-метиламинометил-5-андростена и 140 мл метиленхлорида, при постоянном перемешивании и комнатной температуре в 40 течение 15 мин прикапывают раствор, полученный из 12,6 г И-сульфинилуретана в 42 мл метиленхлорида. 3атем смесь перемешивают в течение 1 ч при комнатной температуре и еще B 45 течение 1 ч при температуре кипения.
После охлаждения реакционную смесь разбавляют с 100 мл метиленхлорида, затем .экстрагируют дважды по 60 мл
10%-ного водного раствора бикарбоната натрия и трижды по 60 мл воды.
Объединенные органические фазы сушат над сульфатом магния, затем упаривают. Масляный остаток кристаллизуют при растирании с 15 мл изопропилового эфира. Полученный сырой продукт (14,37 г) перекристаллизовывают из
170 мл метанола. Получают 5,55 r смеси, которая содержит экзо-эндо изомеры в примерном соотношении 2:1. этот продукт частично плавится при 60
121"124 С, большей частью вновь кристаллизуется и плавится вновь при
:- 170-174 C
Маточник сгущают до 1/5 своего объема и так после охлаждения полу- 65 чают дальнейшие 7,10 r изомерной смеси (точка плавления 177-179 С). Последняя кристаллическая фракция отличается от предыдущей только соотношением изомеров.
Пример б. 3-Оксо-4-андростен-178-спиро-5 †(З-метил-1,2,3 —
I (6 оксатиазолидин ) -2 -оксид.
11,37 r полученного согласно примеру 5, Зр-гидрокси-5-андростен-17Sспиро-5 †(3 -метил-1,2,3 -оксатиазолидин) -2 -оксида в 150 мл толуола в течение б ч при перемешинании нагревают до кипения с 6,75 r алюминийизопропилата и 93 мл циклогексанона. После охлаждения реакционную смесь разбавляют с 200 мл бензола и смешивают с 180 мл водного 1 н. раствора гидро- ксида натрия. После разделения эмульсию разрушают путем фильтрования и водную Фазу еще дважды экстрагируют по 50 мл бензола. Объединенную органическую фазу промывают дважды по
90 мл 1 н. раствора гидрооксида натрия и четырежды по 100 мл водного
5%-ного раствора поваренной соли.
Осушенный бензол-толуольный раствор упаривают, и остаток освобождают выпариванием от этанола. Оставшееся масло кристаллизуют при растирании с и изопропиловым эфиром. После отсасывания из маточника путем обработки с п-гексаном получюат дальнейшую кристаллическую фракцию. Раствор 8,27 г сырого продукта в этаноле осветляют с активированным углем и после фильтрации сгущают. Получают 5,25 г продукта. Точка планления 174-176ОС, После повторной перекристаллизации из этанола получают смесь экзо-эндо изомеров,(5:1), которая плавится при
189 191о С.
Пример 7. 3-Оксо-андроста1,4-диен-17s-спиро-5 -(З-метил-1,2,31 F оксатиазолидин)-2-оксид.
2,26 r полученного согласно примеру 6 3-оксо-4-андростен-178-спиро5-(3-метил-1,2,3-оксатиазолидин)2-окl \ / сида в 30 мл бензола нагревают до кипения с 2,02 г 2,3-дихлоро-5,6-дициано-1,4 бензохина (ДДБ). Через
8 ч добавляют дальнейшие 50 мл бензола и 0,70 г ДДБ к реакционной смеси. Реакционную смесь нагревают до кипения в течение дальнейших 16 ч, затем охлаждают и раствор декантируют от высадиншегося вещества. Остаток трижды перемешивают с бензолом по
20 мл, и после декантиронания растворы объединяют с предыдущим раствором.
Полученный раствор встряхивают дважды с 13-ным водным раствором гидроксида натрия по 30 мл, который также содержит еще 0,5% дитионита натрия, затем с 10 мл 1 н. раствора гидроксидэ натрия и наконец с раствором поваренной соли, сушат и упаривают. Масляный остаток кристаллизуют при обработ7 ". 079177 8 ке с изопропиловым эфиром. После перекристаллизации сырого продукта из этилацетата получают 0,40 г чистого продукта, который плавится при 189191 С (1:1 смесь экзо-эндо изомеров). ф ОН 242 нм (:14000).
Ct Ч.
Пример 8. 3-Оксо-андроста(((4, Б-диен-17 -спиро-5- (5-метил-1, 2, 3оксатиазолидин)-2-оксид.
6,25 г полученного согласно при10 меру б З-оксо-4-андростен-17."--спиро(((((Г
5- (3-метил-1, 2, 3-оксатиазолидин ) -2— оксида растворяют в смеси иэ 28 мл ,этилового эфира ортомуравьиной кислоты и 62 мл этанола при 50"С.При пере- 15 мешивании добавляют 0,62 г и-толуолсульфокислоты и перемешивают в течение дальнейших 1,5 ч. Затем реакционную смесь охлаждают и после добавления нескльких капель пиридина при 20 постоянном перемешивании выливают в
1 л 10%-ного охлажденного льдом раствора гидрогенкарбоната натрия. Продукт, кристаллизующийся во время нескольких часов при хранении в холо- 25 дильнике, отсасывают и промывают водой. Осушенные 6,43 r енольного эфира растворяют в 180 мл ацетона, содержащего 5Ъ воды и при постоянном перемешивании добавляют 3,95 г хлор-.. 30 анила. Перемешивание продолжают в темноте в течение дальнейших б ч, затем полученный раствор сушат при
35-40 C. .Остаток суспендируют в 200 мл
5%-ного раствора гидрокарбоната натрия и экстрагируют с этилацетатом.
После промывки водой, сушки и упаривания остается темное масло, которое хроматографируют на 100 г нейтрального алюминийоксида со смесью 3:1 из хлороформа и этилацетата. Объединен- 40 ные очищенные фракции после упаривания дают масло, которое растворяют в 4 мл этилацетата. Добавляют 25 мл изопропилового эфира. Выкристаллизовывают желтый критсаллический про- 45 дукт (2,60 r, точка плавления 110111 С ),который оказывается смесью экзо-эндо иэомерами (3:2). После перекристаллизации из иэопропилового эфира точка плавления 114-116 С. hìà к 282 нм (P 21400
Пример 9. 2,2-Диметил-3оксо-4-андростен-17S-спиро-5 †(3-метил-1,2,З-оксатиазолидин)-2-оксид.
5,0 г полученного согласно приме- 55 ру б 3-оксо-4-андростен-17S-спиро((((. (5- (З-метил-1, 2, 3-оксатиазолидин ) 2оксида растворяют в смеси из 40 мл тетрагидрофурана и 20 мл метилйодида о ( и раствор охлаждают до -70 С. При по-60 стоянном перемешивании в течение
10 мин прикалывают суспензию приготовленную из 10 г трет-бутилата калия и 50 мл тетрагидрофурана. Через дальнейшие 25 мин еще раз добавляют 7 r трет-бутилата калия в 30 мл тетра- гидрофурана. Перемешивание продолжается еще 15 мин и реакционную смесь выливают затем в 1200 мл насыщенного водного раствора аммонийхлорида. Затем четырежды экстрагируют с этилацетатом по 100 мл. Органическую фазу экстрагируют со 100 мл 2Ъ-ного раствора натрийтиосульфата и дважды со
100 мл 5%-ного водного раствора поваренной соли. Кристаллический остаток, полученный после сушки и упаривания, отсасывают и промывают с изопропиловым эфиром. Получают 3,52 r сырого продукта (точка плавления 172-174 С), который перекристаллизовывают из этанола. Получают 2,82 r продукта. Точка пгавления 178-179 С.
289 нм (Е: 16500).
Продукт является смесью экзо-эндо изомеров (2:1).
II р и м е р 10. 3 -Ацетокси-5I (/ Г андростен-178-спиро-5- (З-метил-1, 2, 3оксатиазолидин )-2-оксид.
2, 1. г полученного согласно примеру 5 ЗД-гидрокси-5-андростен-178-спиро-5 -(3- метил-1,2,3 -оксатиазолидин)2-оксида растворяют в смеси из 20 мл бензола, 2,6 мл пиридина и 2,8 мл уксусного ангидрида, и раствор нагревают в течение 5 ч до кипения.По,сле охлаждения раствор дважды встряхивают с насыщенным раствором гидрокарбоната натрия по 50 мл, затем с
5%-ным раствором поваренной соли, сушат и упаривают.
Кристаллический остаток промывают петролейным эфиром, полученный продукт, который плавится при 177-179 С, в случае необходимости может перекристаллизовываться из метанола. Полученная путем перекристаллизации кристаллчческая смесь обогащена экзоизомером. Точка плавления 204-205 С.
tI р и м е р 11. Зр-Метокси-5андростен-17S-спиро-5 -(3 -метил-1 2 3( (( окситиазолидин ) 2-оксид.
1,14 r полученного согласно примеру 5 Зр-гидрокси-5-андростен-17S((( спиро-5-(3-метил-1,2,3-оксатиазолйдин)2-оксида растворяют в 12 мл тетрагидрофурана. К раствору при комнатной температуре добавляют 0,27 r гидрида натрия, содержащего 20% парафинового масла. После начала реакции к реакционной смеси добавляют 1,70 г метилиодида и смесь нагревают до
50(С. После периода реакции (5 ч) смесь выливают в 120 мл воды..Высадившееся белое кристаллическое вещество отсасывают и промывают водой до нейтральности. Плавящийся при 124128 С сырой гродукт (1,07 r) после осветления активированным углем, фильтрации и сгущения до объема 5 мл перекристаллиэовывают из 20 мл метанола. Из раствора выкритсаллизовывают 0,62 г бесцветного вещества, ко-
1079177
10 торое плавится при 144-14 7С(С. Продукт является смесью экзо-эндо изомеров (б:4).
Пример 12. ЗЛ-Гидрокси-5((( андростен-17S-спиро-5- (З-метил-1,2,3оксатиазолидин)-2 -оксид-гемисукцинат. 5
1? 67 г полученного согласно примеру 5 Зр-гидрокси-5-андростен-17Sг с (( спиро-5-(З-метил-1,2,3-оксатиазолидин)-2-оксида нагревают в смеси из (70 мл толуола и 33,5 мл пиридина с 10
13,3 г ангидрида янтарной кислоты сначала в течение 1,5 ч на водяной бане затем в течение 4,5 ч до кипения. Затем реакционную смесь отстаивают в течение 12 ч при комнатной температуре. В течение этого времени из раствора высаживают избыточный ангидрид янтарной кислоты. После отсасывания маточиик разбавляют со
170 мл бензола, затем четырежды встряхивают с 2%-ной водной соляной кислотой по 100 мл и дважды с водой по 50 мл.
Осушенный над сульфатом магния раствор упаривают, и оставшееся масло кристаллизуют при растирании с изопропиловым эфиром. Получают
12,48 r сырого продукта, точка плавления 168-170 С . После перекристаллизации из 200 мл этилацетата, причем раствор сгушают до 1/5 свое- 30
ro объема, получают 8г67 г чистого соединения. Точка плавления 171 С. г
Пример 13. ЗД-Гидрокси-4андростен-17Б-спиро-5- (З-метил-1, 2, 3-35 с (с I оксатиазолидин)-2-оксид-3-гемисукцината калиевая соль.
8,60 r полученного согласно примеру 12 Зр-гидрокси-5-андростен-17Sспиро-5-(3- метил-1,2,3-оксатиазоли- 40 дин)-2-оксид-З.-гемисукцината растворяют в смеси из 250 мл метанола и
35,5 мл водного раствора гидроксида калия с концентрацией 2,85 г/100 мл.
Раствор упаривают при 40-45 С, и 45 кристаллический остаток растворяют в этаноле, затем вновь упаривают до сухого остатка. Последнюю процедуру повторяют еще дважды, и остаток на фритте промывают осушенным этилацетатом.
Получают 8,81 г сырого продукта.
Его растворяют в 240 мл горячего эта иола, раствор осветляют активированным углем и после этого сгущают до объема 50 мл. Из раствора кристалли- 55 зуют 6,14 г названного в заглавии соединения. Точка плавления 236-237ОС, продукт хорошо растворяется в воде.
Пример 14. Зр-Гидрокси-4андростен-17S-спиро-5- (3-метил-1,2,3-бО оксатиазолидин)-2 -оксид.
Суспензию 0,75 r полученного согласно примеру б 3-оксо-4-андростен(((I
17S-спиро-5-(З-метил-1, 2, 3-оксатиазолидин)2-оксида в 20 мл метанола охлаждают до 0((C и добавляют 0,09 r нат— рийборогидрида. B течение получаса получают прозрачный раствор, который в течение 2 ч держат при температуре
0-5ОC. Затем раствор выливают в
200 мл воды. Высадившийся продукт отсасывают и промывают водой. Полученные
0,78 г сырого продукта перекристаллизовывают из этилацетата путем сгущения раствора до его 1/5 первоначального объема. Получают 0,50 г названного в заглавии соединения с. точкой плавления 173-175 С. Продукт является стереооднородным чистым изомером.
)ь /z, .-(- 77,3 (с= 0,5; хлороформ).
II р и м е р 15. Разделение экзои эндо-изомеров, ЗЯ-гидрокси-5-андро(г стен-178-спиро-5-(З-метил-1,2, 3-оксатиазолидин ) -2-оксида.
4, б r полученного согласно примеру
10 3 -ацетокси-5-андростен-17S-спиро5-(3 -метил-1,2,3-оксатиазолидин)2-оксида наносят на препаративную тонкослойную пластину с силикагелевым слоем (толщина слоя 0,4 мм). Для элюирования применяют смесь из циклогексана и этилацетата в соотношении 7:3.
Выступившие при В : 0,6 и 0,5 два пятна отделяют и вещества смывают с адсорбента этанолом. Путем упаривания получают 2,42 г сырого продукта, который соответствует пятну с более высоким R значением. Этот сырой продукт растворяют в 170 мл метанола и раствор после добавления 58 r.ìåòèëàòà натрия оставляют стоять в течение 28 ч.
После упаривания получают кристаллический сырой продукт, который при отсасывании промывают водой до нейтральности. Таким образом, получают 1,32 г сырого продукта (точка плавления 126128 С), который перекристаллизовывается из метанола. Получают 1,10 г
З -гидрокси-5-андростен-17S-спиро(!
5-(3"метил-1,2,3-оксатиазолидин)-2эндо-оксида. Точка плавления 128-129ОС, /0 .i -21,28" (c= 20,5, хлороформ).
После смыва и упаривания продукта, соответствующего пятну с более низким
Н значением, получают 2,15 г ацетоксиизомера, гидролиз которого проводится, как прежде. Получают 1,55. г сырого продукта (точка плавления 222225 C), который перекристаллизовывается из метанола. Таким образом, получают 1,45 г 38-гидрокси-5-андрог ( стен-17S-спиро- -(З-метил-1,2,3-оксатиазолидин)-2-экзо-оксида. Точка плавления 224-225ОС, /gt -260,7 (c=0,5; хлороформ).
Пример 16. 3f3-(2-диэтила(инно)-этокси-5-андростен-178-спироФ (l (I
5-(З-метил-1, 2, 3-оксатиазолидин ) -2оксид.
3,79 r полученного согласно примеру 5 Зр-гидрокси-5-андростен-17S(((r спиро-5-(3 метил-1,2,3-оксатиазолидин)2-оксида растворяют в 30 мл ди1079177
Оценивалось зна .ение log
Na 10
Результаты опыта к примеру ЗД-гид-45
° у рокси-5-андростен-17;-спиро-5-(3-мею i I тил-1, 2, 3-оксатиазолидий ) -2-оксида и 3-оксо-андроста-4 6-диен-17S-спиро-5-(3-метил-1,2,3-оксатиазолидин)— ю !
2 -оксида сведены в табл.1 50
Приведенные в табл.1 соединения значительным образом подавляют минерало-кортикоидное действие ДОКА и показывают альдостеронподавляющее действие на порядок величин сравнитель- 55 ного вещества (спиронолактон).
Метод Na-balance. Эксперименты проводились на отобранных крысах мужского пола с весом 230-250 г по методу хольмана. Крысы нагружались 60
0,2Ъ-ной NaC1 инфузией, полученной изоосмотически с помощью глюкозы. Путем наблюдения способности NB выделения почек через 24 ч доказывали, что выделенные с мочой и внесенные в 65 метилформамида. К раствору при перемешинании и охлаждении ледяной водой маленькими порциями добавляют 1,50 r гидрида натрия с содержанием 20Ъ парафинового масла. После начала реакции к смеси добавляют раствор, приготовленный из 6,8 г 2-диэтиламиноэтилхлорида и 3 мл диметилформамида.
Реакционную смесь перемешивают в течение 0,5 ч при комнатной температуре, затем в течение 2 ч при 70оС 1
Смесь в течение 16 ч оставляют стоять при комнатной температуре и затем выливают в 600 мл воды. Высадившийся продукт отсасьвают и промывают водой. 15
Сырой продукт (4,1 r) растворяют в 100 мл изопропилового эфира (подогретого), раствор осветляют активированным углем, фильтруют и сгущают до объема 15 мл. Высаживают 1,9 г названного.в заглавии соединения в форме желтого продукта, который пос— ле отсасывания действует слабоклеюще.
Точка плавления 105-115ОС.
Альдостерон- антагонистическое действие соединений было изучено на
25, крысах с помощью двух различных методов.
Метод С.М.Kagawa. 3a 18 ч перед обработкой уцалялись надпочечники у подопытных крыс. Одновременно с введением тестового вещества животные получали дезоксикортикостеронацетат (ДОКА), который заменяет действие альдостерона. В моче. крыс определя ется пламенной фотометрией содержа- 35 ние Na и К. В качестве .сравнительного вещества применялся спироналактон (17@-карбокси-этил-17Р-гидрокси-17Лацетилтио-андрост-4-ен-3-он-лактон) в количестве 480 мг на каждое живот- 40 ное. организм животных c H s e Na -количества в промежутке времени между
4-м и 13-м ч находятся в равновесии.
Образовались три группы исследования: 1) контрольная; 2)минерало-кортикоидная; 3) минерало-кортикоидная + антагонистическая.
Во 2-й группе одновременно с началом вливания подкожно вводились
6,25 мг ДОКА (животное). С помощью этой. однократной аппликации минералокортиксидного гормона коры надпочечника получались гиперальдостерония.
Крысы 3-е группы получали подкожно наряду с 6,25 мг ДОКА (животное во второй час 5,5 мг) животное спиронолактона. Ретенция натрия выражалась в процентах введенного Na — количества. Результаты эксперимента по
Na+-балансу приведены в табл.2.
Указанные в табл.2 два соединения
+ снижают вызванную.с помощью ДОКА Naретенцию с 66,55Ъ до 13,64 соответственно 8,97Ъ. Конкурентно-подавляющее действие последнего соединения является значительным.
Соединения согласно предлагаемому изобретению не обладают невыгодным эндокринным побочным действием. Особенно выгодным является то, что эти соединения не имеют доказываемого антиандрогенного и гестагенного действия. Напротив, спиронолактан в значительной мере обладает такими нежелательными побочными действиями, которые при продолжительной терапии действуют вредно.
Антиандрогенное действие соединений согласно изобретению исследовалось с помощью модифицированного метода Дорфмана. Инфантильные кастрированные крысы мужского пола с весом
50 r в течение 7 дней ежедневно обрабатывалось с 50 мг (животное тестостеронпропионтата) в дальнейшем
ТП/S.C. Подлежащее изучению вещество вводилось животному:S.с. в дозировке
1 мг одновременно с ТП.
На 8-й день после обработки животные умирали и с помощью крутильных весов определялся вес брюшной простаты и везикуда Seminalis после очистки. Известно, что прибавление веса вторичных половых желез снижается с помощью антиандрогенных веществ. Мера подавления может даваться в процентах, если прибавление веса стимулированных с ТП желез принимается за 100Ъ.
Исследования показали, что спиронолактон, примененный в семидневной обработке в дозировках О, 5 и 1, 0 мг (день ) животному, подавляет увеличение веса vesicula Seminalis на 38Ъ соответственно 54Ъ, увеличение веса брюшной простаты на 35Ъ соответственно 45Ъ.
1079177
Ежедневная доза соединений согласно изобретению для взрослых лежит между 50 мг и 400 мг.
Таким образом, предлагаемый способ пОзволяет получать новые производные стероидов, обладающие преимуществами в фармакологическом отношении перед их структурными аналогами.
Таблица 1
Соединение
Доза (животное р.о.) Число животных Моча
Na с10 ф
1оЦ К+
3Р-Гидрокси-5-андростен(а ч / /
178-спиро-5-(3-метил-1,2,3оксатиаэолидий)2 -оксид
480
1,14
3-Оксо-андроста-4,б-диен;
178-бпиро-5 -(3 -метил-1,2, 3оксатиаэолидин ) 2-оксид
480
1,12
ДОКА
, 0,78
Спиронолактон
480
1-, 14
П р и м е ч а н и е. Каждое животное обрабатывалось подкожно с 12,5 (ЕДОКА.
Указанные в табл.1 соединения в дозировке 1 мг животное) день не показывают антиандрогенное действие.
Гестагенное действие соединений согласно изобретению определялось по методу Глауберга.
Инфантильные новозеландские кролики женского пола S.ñ. в течение 5 дней ежедневно обрабатнвались с 5 мг эстрадиола, в .последующие 5 дней также 8.с ° вводились подлежащие изучению соединения. Пробы, взятые иэ обоих рогов матки на двух различных высотах, оценивались после гистологической обработки согласно NcPhail.
Спиронолактон в дозировке 5 тамг/кг t5 вызывает слабое {McPh индекс :0,3), в дозировке 5к5 мг/кг уже значительное (McPh индекс: 2,0) гестагенное действие.
Напротив 3 -гидрокси-5-андростен- go
178-спиро-5-(3-метил-1,2,3-оксатиаэо/
< Э лидин)-2-оксид, который обладает равным антиальдостеронным действием, в вышеописанных опытах и дозировках оказался неактивным (NcPh индексз0).
Соединения общей формулы Х могут
Формулироваться в терапевтические
1 продукты, которые могут применяться энтерально или парантерально. Эти продукты могут быть твердыми или жидкими, такими как таблетки, покрытые таблетки, капсулы, пилюли, суппозитории, эмульсии, суспензии, растворы для инъекций и т.д., их могут известным образом получать вместе с терапевтическим применяемым неактивным носителем, такими как тальк, лактоза, стеарат магния, крахмал, вода, растительные масла, воски и т.д. н/или с другими добавками, как, например, консерванты, стабилизаторы, вкусовые вещества, поверхностно-активные вещества, соли, влияющие на осмотическое давление и т.д.
10791 /7
Таблица 2
Число животных, 1т
Доза, мг (оелиненил
6,25
6,25+
5,5
5,36
6,25k.
5,5
8,97
6,25+
5,5
13,64
Составитель И.Федосеева
Редактор Ю.Середа ТехредМ.Гергель Корректор В. Еутяга
Контрольная
ДОКА
ДОКА + спиронолактон
ДОКА + 3 -гидрокси-5-андростен-17,":-спиро-5- (31метил/ I Ф
1, 2, 3-оксатиазолидин ) -2-оксид
ДОКА, 3-оксо-андроста-4,6-диенЪ / 7
175 -спиро-5-(3-метил-1,2,3оксатиазолидин 1-2-оксид
Заказ 999/56 Тираж 381 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва,F:-35, Раушская наб., д.4/5
Филиал ППП "Патент",. г.ужгород, ул.Проектная,4
Ретенция Ма (введенного количества), Ъ
22,68
66,55