Способ получения комплекса внеклеточных ферментов
Иллюстрации
Показать всеРеферат
,VCnOCOB ПОЛУЧЕНИЯ КОМПЛЕКСА ;ВНЕКЛЕТОЧНЫХ ФЕРМЕНТОВ, предусматривающий культивирование продуцентовгрибов базидиомицетов на питательной среде, содержащей лигнинсодержащие отходы в качестве источника углерода , минеральные соли и воду с последуннцим отделением грибного мицелря от культуральной жидкости, содержащей внеклеточные ферменты, о т л ичающийся тем, что, с целью повьшения активности комплекса, а также упрощения и удешевления способа , в качестве источника углерода используют агримус - отход производства фурфурола, содержащий целлолигнин и свободный фурфурол в соотношении 42:1, в количестве 0,55 ,0%. 2.Способ по п. 1, отлича ющ и и с я тем, что, с целью получения преимущественно фермента пероксидазы , культивирование проводят путем образования поверхностной пленки при использовании агримуса в концентрации 1,0-2,5%. 3.Способ по пп. 1 и 2, о т л ичающийся тем, что, с целью (Л получения преимущественно фермента t монофенол-монооксигеназы, культивирование проводят путем образования поверхностной пленки при использовании агримуса в концентрации 4,05 ,0%.
СОЮЗ СО8ЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (19) (11) ГОСУДАРСТ8ЕННЫЙ КОМИТЕТ СССР (21) 3520061/28-13 (22) 08.12.82 (46) 07.04.84. Бюл, к- 13 (72) В.Д.Семичаевский, Н.И.Даниляк и И.А.Трутнева (71-) Институт ботаники им.Н.Г.Холодного (53) 579.6.15(088.8) (56) 1. Авторское свидетельство СССР .
h> 654679, кл. С 12 N 1/16, 1979.
2. Авторское свидетельство СССР
Р 747886, кл. С 12 Н 1/00. 1980. (54)(57) } СПОСОБ ПОЛУЧЕНИЯ КОКШЕКСА ,ВНЕКЛЕТОЧНЫХ ФЕРИЕНТОВ, предусматривающий культивирование продуцентовгрибов базидиомицетов на питательной среде, содержащей лигнинсодержащие отходы в качестве источника углерода, минеральные соли и воду с последующим отделением грибного мицелия от культуральной жидкости, содержащей внеклеточные ферменты, о т л ич а ю шийся тем, что, с целью дц С 12 N 9/02, С 12 N 1/14,: повышения активности комплекса, а также упрощения и удешевления способа, в качестве источника углерода используют агримус — отход производства фурфурола, содержащий целлолигнин и свободный фурфурол в соотношении 42: 1, в количестве 0 55,0%.
2. Способ по и. 1, о т л и ч а ю- шийся тем, что, с целью получения преимущественно фермента пероксидазы, культивирование проводят путем образования поверхностной пленки при использовании агримуса в концентрации 1,0-2,5Х.
3. Способ по пп. 1 и 2, о т л ич а ю шийся тем, что, с целью получения преимущественно фермента монофенол-монооксигеназы, культивирование проводят путем образования поверхностной пленки при использовании агримуса в концентрации 4,05,07.
1084299 2 соотношении 42:1, в количестве 0 55,0Х.
Кроме того, с целью получения преимущественно фермента пероксидазы культивирование проводят путем образования поверхностной пленки при использовании агримуса в концентрации 1,0-2,5Х.
С целью получения преимущественно фермента монофенол-монооксигеназы, культивирование проводят путем образования поверхностной пленки при использовании агримуса в концентрации 4,0-5,0 .
Агримус представляет собой многотоннажный отход, полученный при производстве фурфурола из стержней початков кукурузы, который частично используют как лигноцеллюлозное удобрение в сельском хозяйстве.
Пример 1. Готовят питательную среду следующего состава
И Н4НгР04 2,0
КН Р04 0,6
К 2НР04 0,4 м яо4 0,5
Агримус 5,0
Водопроводная вода 1 л.
Приготовленную таким образом среду автоклавируют, охлаждают и засевают чистыми культурами базидиомицетов
Pfeurotus ostreatus (Fr.) Kumm. HNBF1300.или Coriogus versicolor (Fr.)
Quet.087. Культивирование проводят в глубинных условиях на качалке ,в колбах Эрленмейера в течение 7 сут. п ри 28 С.
Изобретение относится к микробиологической промышленности, в частности к способам получения ферментов, продуцируемых базидиомицетами. 5
Известен способ культивирования базидиомицетов на питательной среде, содержащей источник углерода и минеральные соли, а также отходы производства j1) .
1О
Однако данный способ не позволяет получить широкий спектр продуцируемых ферментов.
Наиболее близким по технической сущности и достигаемому эффекту 15 к предлагаемому является способ получения комплекса внеклеточных ферментов, предусматривающий культи вирование продуцентов-грибов базидиомицетов на питательной среде, 20 содержащей лигнинсодержащие отходы в качестве источника углерода, минеральные соли и воду с последующим отделением грибного мицелия от культуральной жидкости, содержащего вне" 25 клеточные ферменты (2) .
К недостаткам этого способа относятся сложность технологии его. осуществления и значительные затраты времени и средств. Кроме того, способЗО ограничивается использованием единственного штамма дереворазрушающего гриба. В нем использован недостаточно широкий ассортимент лигнинсодержащих отходов и получаемых при этом продуктов биосинтеза микроорганизмов, в частности внеклеточных ферментов, обладающих недостаточно высокой активностью.
Цель изобретения — повышение 4
О активности комплекса ферментов, а также упрощение и удешевление способа.
Поставленная цель достигается тем, что согласно способу получения 45 комплекса внеклеточных ферментов, предусматривающему культивирование продуцентов-грибов базидиомицетов на питательной среде, содержащей лигнинсодержащие отходы в качестве 5О источника углерода, минеральные соли и воду с последующим отделением грибного мицелия от культуральной жидкости, содержащей внеклеточные фер/ менты, в качестве источника угле" 55 рода используют агримус-отход производства фурфурола, содержащий целлолигнин и свободный фурфурол в
Для сравнения в качестве контроля выращивание указанных базидиомицетов проводят также в аналогичных условиях на питательной среде, содержащей вместо агримуса целлюлозу (фильтровальную.бумагу) в количестве
15 0 г/л.
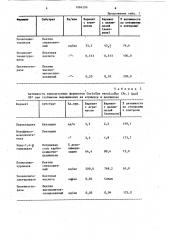
В табл. 1 и 2 приведены результаты измерений активностей внеклеточных пероксидазы (КФ 1.11.1.7), монофенол-монооксигеназы (КФ 1. 14.
18. 1), Эндо-1,4-P-глюканаэы (КФ.3.2.
1.4), полигалактуроназы (КФ 3.1.1.15), экзополигалактуроназы (КФ 3.2.1.67) и пектинэстеразы (КФ 3.1111) в культуральных фильтратах указанных продуцентов, полученных после отделения мицелия и остатков твердого субстрата. По сравнению с контролем среда с агримусом более эффективна для получения большинства з 1.084299 исследуемых ферментов. Так, при выращивании Р2еигойиз ostreatus на среде с агримусом достигнуто увеличение активности пероксидаэы и монофенол-монооксигеназы, более чем в
12 раз по сравнению с контролем.
П р и.м е р 2. Готовят питательную среду по примеру 1, которую засевают чистыми культурами базидиомицетов PPeurotus ostreatus (Гг.) 10
Kumm. HMBF-1300, FunaIia trogii (Berk.) Bond et. Sing БИН-2 или
0xyporus obducens (Fr.) Donk.ÈÁÊ-85.
В отличие от примера 1 культивирование проводят в стационарных условиях методом поверхностной пленки в течение 10 сут при 28 С. о
Для сравнения в качестве контроля выращивание указанных базидиомицетов проводят также в аналогичных 2р условиях на питательных средах, содержащих вместо агримуса целлюлозу (фильтровальную бумагу) в количестве.
15 0 г/л или экстракт из свекловичного жома в количестве 100 мл/л. 2
В табл. 3 приведены результаты измерений активностей внеклеточных пероксидазы и монофенол-моноксигена-зы в культуральных фильтратах укаэанных продуцентов, полученных после ЗО отделения -мицелия и остатков твердого субстрата. На среде с агрнмусом активность обоих ферментов згачительио вышее, чем в контрольном варианте.
Так, для культуры Pfeurotus ostrea35
tus активность пероксидазы на среде с агримусом составляет 18,6 ед/л, тогда как в контроле с целлюлозой обнаружены следы активности этого фермента, на среде с экстрактом из свекловичного жома активность пероксидазы составляет 14,2 ед/л.
П р и м е .р 3. Готовят питательную среду по примеру 1, в которую в качестве единственного источника углерода вводят агримус в количествах 5,0-50,0 г/л. Указанные среды засевают чистой культурой базидиомицета PIeurotus ostreatus (Fr.) Kumm.
HMBF-1300. Культивирование проводят в стационарных условиях методом поверхностной пленки в течение
10 сут при 28 С. В табл. 4 приведены результаты измерений активностей внеклеточной пероксидазы и монофенолмонооксигеназы- в культуральных фильтратах, полученных после отделения мицелия и остатков твердого субстрата.
Из табл, 4 видно, что наибольшая активность пероксидазы культуры гриба Pleurotus ostreatus — 56,2 ед/л при концентрации агримуса 1 0Х а наибольшая активность монофенол-монооксигеназы — 56,0 ед/л при концентрации агримуса в среде 4,0Х.
Таким образом, предлагаемый способ по сравнению с известным позволяет повысить активность ферментов получаемого комплекса в 12 раз, а также упростить и удешевить способ за счет использования отхбдов производства.
Ед/изм
Вариант . X активности с целлю- по отношению лозой к контролю) (контроль}
Субстрат
Вариант с агримусом
Фермент
1244 ед/л
0,9
Бензидин
Пероксидаза
Монофенолмонооксигенаэа
1285
0,7
9,0
Бензидин
Эндо-1,4-Рглюканаза
7 деполимеризации
Натриевая соль карбоксиметилцеллюлозы
203,5
19,9
40,5
Таблица 1
Активность внеклеточных ферментов Pleurotus ostreatus (Fr.) Kumm
ИМВР-1300 при глубинном выращивании на агримусе и целлюлозе
1084299
Продолжение табл. 1
Пектин
Полигалактуроназа свекловичный ед/мл 33, 3
43 5
76,6
ЭкзополиПектовая кислота
0,513
0,513
100,0 галак туро" наза
Пектинэстераэа
Пектин высокометоксилированный
0,10
200,0
0,20
Таблица 2 !
Активность внеклеточных Ферментов Coriolus versicoPor (Fr.) puef
087 при глубинном выращивании на агримусе и целлюлозе
Вариант Ж активности с целлю- по отношению лозой к контролю (контроль
Субстрат
Фермент ед/л
2,2
159, 1
3,5
Пероксидаза
Монофенолмонооксиге173,7 l,9
3,3 наза
Эндо-1,4-Р глюканаза
72,0
89,4
Нолигалактуроназа ед/мл 500,0
65,0
769,2
Пектовая кислота
Экзополигалактуроназа еду(мл О, 82
Следы
Пектин.
Пектинэстераза ед/мл 0,05 высокометоксилированный
125,0
0,04
Бензидин
Бенэидин
Натриевая соль карбоксиметилцеллюлозы
Пектин свекловичный
Ед/изм Вариант с агримусом
Ед.изм. Вариант с агримусом
Ж деполимериэации 64,4
Вариант с целлюлозой (контроль) Х активности по отноиюнюв к контролю) 10 34299
Таблица 3
Активность внеклеточных ферментов базидиомицетов при выращивании методом поверхностной пленки на агримусе, целлюлозе и экстракте и з жома
Фермент
Субстрат
Ед.изм.
P7eurotus ostreatus (Fr.) Kumm
Перексидаза Бенэидин ед!л 18,6
HMBP-1 300
Следы
14,2
Монофенолмонооксиге18,0 Следы
13,0 наэа
FunaIia trogii (Berk) Bond. et. Sing БИН- 2
14,0
Следы
8,0
Пероксидаза
3,9
10,0
Следы
0xyporus olducens (Pr.) Donk ИБК-85
6,0
14,6
Пероксидаза
Следы
5 0
Следы
Следы
Таблица 4
Активность внеклеточных ферментов Pleurotus ostreatus (Fr) Kumm
HMBF-1300 при выращивании методом поверхностной пленки в зависимости от содержания агримуса в питательной среде
Ед.изм. Содержание агримуса (вес.7) Субстрат
Фермент
0,5 1,0 2,5 4,0 5,0 ед/л 18,6 56,2 42,2 46,4 28,0 ю
Пероксидаза Бензидин
Монофенолмонооксиге17s5 20,0 40,0 56 0 31 0 каза
ВЯИИПИ Заказ 1926/19 Тираж 522 Подписное
1® 1иал ППП "Пэтеат", г. Ужгород,ул.Проектная, 4
Монофенолмонооксигеназа
Монофенолмонооксигеназа
Вариант с агримусом
Вариант с целлюлозой (контроль) Вариант экстракт из, свекловичного жома