Способ получения производных цефалоспорина
Иллюстрации
Показать всеРеферат
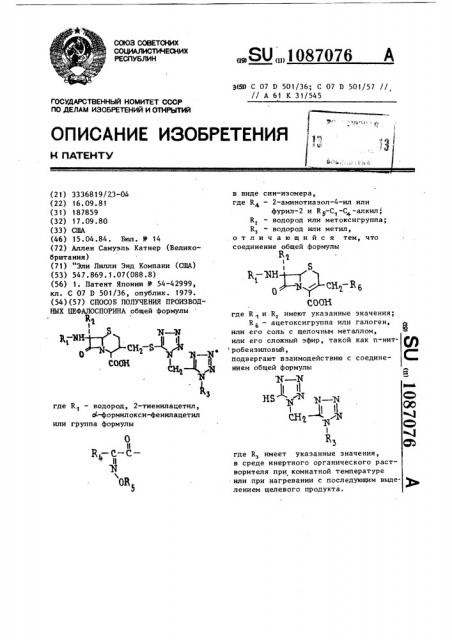
СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦЕФАЛОСПОРИНА общей формулы к, R.-««-i-/1 . ;д снг8д1 . Ан,Д1 -н . где R - водород, 2-тиенилацетил, сС-формилокси-фенилацетил или группа формулы к.-с-ётт OR, э в виде син-изомера, где Кл - 2-аминотиазол-4-ил или фурил-2 и Rg-C -C -алкил; RJ - водород или метоксигруппа; Rj - водород или метил, отличающийся тем, что соединение общей формулы S к.-ш. 1J/ V. о соон где R и RJ имеют указанные значения; R, - ацетоксигруппа или галоген, или его соль с щелочным металлом, СО или его сложный эфир, такой как п-нитробензиловьй , подвергают взаимодействию с соединением общей формулы -N--N II II нв кг СНг ОС ЛЛ тч о Ч О5 где RJ имеет указанные значения, в среде инертного органического растворителя при комнатной температуре или при нагревании с последующим выделением целевого продукта.
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ПАТЕНТУ
1 ! 2
Ь;ЗН вЂ” 1
cH. -В6
cow Щ
k, 0
R — С вЂ” С— }}
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
fl0 ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3336819/23-04 (22) 16.09.81 (3 1) 187859 (32) 17.09.80 (33) США (46) 15. 04.84. Бюл. Ир 14 (72) Аллен Самуэль Катнер (Великобритания) (71) "Эли Лилли Энд Компани (США) (53) 547.869. 1.07(088.8) ($6) 1. Патент Японии У 54-42999, кл. С 07 D 501/36, опублик. 1979. (54)(57) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПЕФАЛОСПОРИНА общей формулы
R2 в,-вк В
0 где К1 — водород, 2-тиенилацетил, о -формилокси-фенилацетил или группа формулы
„„SU „„1087076 А
3(51) С 07 0 501/36; С 07 D 501/57 //
// А 61 К 31/545 в виде син-изомера, где R — 2-аминотиазол-4-ил или
4. фурил-2 и R -С -С -алкил °
t
R — водород или метоксигруппа;
R — водород ипи метил, отличающийся тем, что соединение общей формулы
СО0Н где R и R имеют указанные значения;
R — ацетоксигруппа или галоген, или его соль с щелочным металлом, или аго сложный эфир, такой как п-нит. Q) робензиловый, подвергают взаимодействию с соединением общей формулы
N Ж
) 1( с" в2
О
3 Cb где R имеет указанные значения, в среде инертного органического растворителя при комнатной температуре или при нагревании с последующим выде- р лением целевого продукта.
1087076
Изобретение относится к способу получения новых производных цефалоспорииа, а именно 7-ациламиноцефалоспоринов, замещенных в положении 3 бис-тетразолилметил-тиометильным 5 радикалом, которые обладают свойствами антибиотиков и могут найти применение в медицине.
Известен способ получения антибиотиков цефалоспоринового ряда, содержащих в положении 3 моно-тетраэолилметил-тиометильный радикал.
Например извес1 ен способ получения
76-ацилаиино-7сФ-метокси-3-(1"метилтетразол-5-иптиометил)-3-цефем-4-карбоновых кислот взаимодействием
76-аципамино-7о метокси-3-ацетоксиметил (или 3-карбамоилоксиметил)-3-цефем-4-карбоновой кислоты или ее соли с 1-метил-5-меркаптотетразолом или с его щелочнометаллической солью в среде растворителя (11.
Цель изобретения - получение новых антибиотиков цефалоспориново25 .го ряда, расширяющих арсенал средств воздействия на живой организм.
Цель достигается основанным на известной реакции получения эфиров тиолов способом получения производных цефалоспорина формулы
1О
g;llKg
$
55 (н) м сН;36
С00Н где R водород, 2-тиенилацетил, 3
0-формилоксифенилацетил или группа формулы О
И
К вЂ” С вЂ” С—
11
° д 45
os в виде син-изомера, где R4 — 2-аминотиазол-4-ил или фуРил-2 и R<-С -С4-алкил; 5О
Rg — водород или метоксигруппа;
R — водород или метил, . заключающийся в том, что соединение формулы р
К вЂ .й ! где R„ R имеют укаэанные значения;
R — ацетоксигруппа или атом галогена, или его соль с щелочным металлом или его сложный эфир, такой как п-нитробензиловый, подвергают взаимодействию с соединением формулы
Н$ где R имеет указанные значения, в среде инертного органического растворителя при комнатной температуре, или при нагревании с последующим вьщелением целевого продукта.
Соединения, получаемые с помощью предлагаемого способа, имеют нормальную стереохимию цефалоспориновых антибиотиков с боковой цепью в 7-положении, имеющей 8-конфигурацию, и если R -7-метоксигруппа, R имеет альфа-конфигурацию.
Реакция может быть проведена в безводных условиях, когда используют свободную кислоту формулы (Н) или ее сложный эфир, или в водных условиях, когда используют свободную кислоту, когда используют сложный эфир соединения формулы (Н), деэтерификацию пара-нитробензил сложного эфира проводят с помощью методов восстановительно расщепления, например путем каталитического гидрогенолиза с использованием 57.-ного палладия на угле в инертном растворителе, таком как тетрагидрофуран или ацетонитрил, либо с помощью элект ролитического восстановительного расщепления на катоде в ртутной ванне.
Цистетразолилметил-тиометилэамещенные цефалоспорины являются антибиотиками широкого спектра, ингибирующими рост как грамположительных, так и грамотрицательных микроорганиз" мов, которые являются патогенными по отношению к людям и животным.
Антибактериальная активность этих соединений изучена в опытах, проведенных в пробирке, с использованием метода, использующего раствор агара.
В приводимой ниже табл. 1 указана минимальная ингибирующая концентрация для испытуемых соединений.
1087076
Микроорганизм
Штам
1 4 4 2 . 4.staphylococcus aureus
0,5 XI. I 2
8 16 8
У41 2 2
Х400 16 32
S13E 8 4
4 8
)128 )128 )128 ) 128 )128
16 32 16. 8 32
Staphylococcus epidermidis
EP II 16 4
ЕР12 8 4
16 8
64 32
32
32
Streptococcus Group А
0,5
С203
0,06 О, 03 0,03
0,5 1
4 2
0 5
0,25 0,25 0,03 0,015 0,03
Streptococcus pneumoniae
Streptococcus Group D
PAPK
128 )128 )128 )128
Х66 64 128
) 128
)1 28 64
)1 28
9960
128 64
16 16
Haemopbilus inf luenzae Brun2
0,015 О, 125 О, 125 0,06
0,015 О, 125 О, 12) 0,06
СL 025 1
76 0,25 0,5
0,25 О, 125 О, 125 2
Shigella Sonnei
Escherichia coli
8 - 4
N10 8 4
ЕС14 4 2
ТЕМ 4 8
Х26 1 О 5
KAE 4 ) 128
0,25 0,25 0,25
0,25 0,125 0,06 0,06 0,125
0,125 0,125 0,125
О 06 006 0125
Klebsiella sp. и II
)128 )128 16 4
Entегоbacter aегоgenes Х68
0,25 0,25 0,06 О, 125 0,06
4 0,5
128 32
0,25 0,125 0,25
0,25 0,25 0,25
С32
0 5
ЕВ17 128 16
ЕВ5 128 )128
265А 128 )128.
Х514 1 О 5
1335 2 1
128 2
cloaca
)128 128 64 32 Salmonella sp.
0,125 0,25 0,125
0,5
0,25 0,5
)128 8
128 )1 28
128 )128
128 )128
16 )128
Pseudomonas aeruginosa
Х528
16 32
)128
Х239
)128
32
PS18
Serratia marcescens
0,25 0,125 0,25
Х93
0,5
128 4
SE3 64 ) 1?8
PR15 64 64
Proteus morganii
0,06 О, 12 > г
3 4
Лнтибактериальиая активность в пробирке бис-тетразолметил цефалоспорипов
Таблица 1
1087076
Продолжение табл. 1
Испытуемое соединение "
Минимальная ингибирующая активность, мкг/мл
А В С О 1 е F С
Штамм
Микроорганизм
4 64 2 2 0 125 0 5 1
4 4 4 4 0 125
1 8 05 8 0125 28 )128 )128 32 32
0,03 0,03
0,25 2
16 64
Bordetella bronchoseptica 16 >1 28 8
128 64
32 32
Сноски к таблице 1.
1. Испытуемое соединение:
А. 7В-(2-тиенилацетамидо)-7-альфа20
-мет окс и-3- $1- (1 Н -т етр а зол-5-илметил)-1Н-тетразол-5-илтиометил 3. -цефем-4-карбоновая кислота;
В. 78-(2-тиенилацетамидо)-3- (1-(1-метил-1Н-тетразол-5-илметил)-1Н25
-тетразол-5-илтиометил)-3-цефем-4-карбоновая кислота;
С. 7В-(D-орто-формилминдалоамидо)—
-3-j1-(1Í-тетраэол-5-илметил)-1Н-тетразол-5-илтиометил)-3-цефем-430
-карбоновая кислота;
D. 7В-jD-альфа-(4-этилпиперазил-2,3-дион-1-илкарбониламино)-альфа-(4-оксифенил)ацетамидо)-3-(1Н-тетразол-5-илметил-1Н-тетразол-5-илтиометил—
-3-цефем-4-карбоновая кислота;
Е. син-7В- альфа-метоксимино-альфа-(2-амино-1,3-тиазол-4-ил)-ацетамидо-3-(-1-(1Н-тетразол-5-илметил )-1Н
-тетразол-5-ил-тилметил)-3-цефем-4-карбоновая кислота;
F. син-7В- альфа-метоксимино-альфа"
-(2-амино-1,3-тиазол-4-ил)-ацетамидо)-3- (1-(1-метил-1Н-тетразол-5-илметил)-.
-1Н-тетраэол-5-илтиометил)3-цефем-4-карбоновая кислота.
С. син-7В-(альфа-метоксимино-альфа"
-(2-амино-1,3-тиазол-4-ил)-ацетамидо)-3-(2-(1Н-тетразол-5-илметил)-2Н-тетразол-5-ил-тиометил) -3-цефем-4-карбоновая кислота.
2. Н. штамм, чувствительный к гриппу.
3. Н. штамм, устойчивый к гриппу.
Данные, представленные в таблице, получены с помощью метода испытаний
Мюллера-Хинтона с использованием раствора агара, содержащего 27
Supp7emat С (Difco). Серийные двуЕД (мг/кг х 2)*
Staphylococcus
aureus (30SS) 7,6
Proteus inconstans PR33
rettgeri PR7
II 11
С24
Citrobacter freundii CF17 кратные разбавления использованы в опытах с максимальными концентрациями, равными 128 мгк/мл.
Соединение Е (табл. 1), являющееся предпочитаемым соединением в соответствии с изобретением, введено мышам, зараженным различными патогенами с целью определения эффективной дозы соединения (ЕД ). В указанной табл. 2 значения ЕД определены для
50 указанных инфекций.
Таблица 2
Активность соединения Е для мышей в живом организме
Escherichia coli (Е .С. 14 ) О, 16
Proteus vu1garis (PV2S) 0,12
Serratia marcesceus (SE3) 1,0
Streptococcus pyogenes (С203) 0,21
* подкожные дозы спустя 1 ч и 5 ч после инфекции.
Соединение Е оказалось также эффективным при лечении устойчивого к ампициллину менингита вида Hacmophilus influenzae у детенышей крыс.
Соединение, как оказалось, присутствует в эффективных количествах в спинномозговой жидкости крыс, которым вводят это соединение подкожно в количестве 20 мг/кг живого веса.
Предлагаемые соединения оказываются
1087076 эффективными при лечении инфекционных заболеваний у людей и животных в тех случаях, когда они вводятся парентерально при эффективной дозе в диапазоне примерно от 50 мг/кг живого. веса до пр арно 500 мг/кг живого веса. Соединения также могут быть введены внутримьппечно или внутривенно в пригодных приготовлениях.
Для внутримышечного введения можно получить стерильные растворы солевой формы соединения, в фармацевтическом растворителе, таком как вода, предназначенная для инъекций, физиологический соляный раствор либо в виде 15 суспензии в соответствующем фармацевтически пригодном масляном основании, таком как сложный эфир длинноцепной кислоты жипного ряда, такой как этилолеат. При внутривенном. 20 вводе фармацевтически пригодная солевая форма соединения приготавливается в физиологической жидкости, такой как раствор Рингера, 5Х-ная декстроза или другая пригодная 25 физиологическая жидкость. В общем случае при антибиотической терапии количество вводимого антибиотика зависит от тяжести заболевания, восприимчивости отдельного пациента, типа 30 микроорганизма или микроорганизмов, вызвавших заболевание. Обычно эти соединения вводятся от 2 до 4 раз в день до тех пор, пока инфекция не будет уничтожена.
Приводимые ниже примеры иллюстрируют изобретение. В этих примерах сокращение HPC означает жидкостную хроматографию с высокой разрешающей способностью, и, если нет другого 40
l указания,то используется силикагелевая колонка типа Waters ad Associates
Mode2 500.
Спектр ядерно-магнитного резонан45 са определен с помощью спектрометра типа Varian Associates Model Т-60, спектрометр типа Jeol Model FX 90 использован для спектра при частоте
90 Игц и спектрометр типа Jeol
Model PFT-100 использован при частоте 100 МГц. Триметилсилан использован в качестве стандарта при определении спектра ядерно-магнитного резонанса.
Обозначения, использованные при идентификации спектра ядерно-магнит55 ного резонанса, означают S-синглет, q-квартет, m-мультиплет, d-дублет, t-триплет.
В этих примерах для обозначения определенных типов растворителей использованы следующие обозначения:
THF-тетрагидрофуран, ДМР-диметилформамид, ДИАС-диметилацетамид, MA-триметилсилилацетамид, ВА-бис-триметилсилилацетамид.
Пример 1. 7-амино-3-(1-(1-метил-1Н-тетразол-5-илметил)-1Н-тетразол-5/илтиометил/-3-цефем-4-карбоновая кислота.
Раствор 1,54. r 7-аминоцефалоспорановой кислоты и 1 r (5 ммоль)-1-/1-метил-1Н-тетразол-5-илметил-/1Н-тетразол-5-тиола в 7 мп ледяной уксусной кислоты нагревают в масляной ванне до 65-70 С. К полученной таким образом горячей реакционной смеси добавляют 3,6 мл эфирата трифторида бора. Полученную таким образом реакционную смесь нагревают при 65-70 С в течение 1 ч при пере0 мешивании. Эту реакционную смесь далее охлаждают до комнатной температуры и добавляют I0 мя воды. После добавления воды реакционную смесь перемешивают в течение 15 мин, затем фильтруют и охлаждают в ледяной ванне. Величину водородного показателя холодной смеси доводят до
4,5 ед. рН с помощью концентрированной гидроокиси аммония. Образовавшийся осадок отфильтровывают, промывают повторно водой, затем ацетоном и в заключение диэтиловым простым эфиром. Полученный твердый продукт белого цвета сушат в вакууме в течение 1 ч при 40 С. Получают 1,5 r (80Z от теоретического) соединения, указанного в заголовке.
Элементный анализ, рассчитанный для С Н И О Б
Вычислено, Х:С-35,12; Н-3,44;
121410 3 2
N-34,13; S-15,62.
Найдено, Ж: С-35,62; Н-3,53;
М-31,; S-14, 52, ИК спектр (KBr) карбонильное поглощение при 1800 см
Пример 2.7-амино-3-(IH-тетразол-5-илметип)-1Н-тетразол- 5-илтиометил/-3-цефем-4-карбоновая кислота.
В соответствии с этим примером суспензию, состоящую из 5,3 г (29 ммоль) 1-(1Н-тетразол-5-илметил)-1Н-тетразол-5-тиола и 6,8 r (25 ммоль) 7-аминоцефалоспорановой кислоты, суспендируют в 38 мл ледяной уксусной кислоты и полученную о суспензию нагревают от 62 до 65 С
108
7076
9 в масляной ванне. К горячей суспензии добавляют 16,6 мл эфирата трифторида бора (дистиллированного); причем достигается практически полное растворение. Полученную таким образом смесь нагревают в течение
1 ч при температуре примерно от 60 до примерно 65 С при перемешивании.
О
Реакционную смесь охлаждают и перемешивают в течение 1 ч при комнатной температуре и затем добавляют
45 мл воды. Разбавленную реакционную смесь охлаждают до 0 С и величину о водородного показателя доводят до
4 с помощью концентрированной гидроокиси аммония. Полученный продукт осаждают, промывают водой, ацетоном, простым дизтиловым эфиром и затем сушат в вакуумной печи 2 ч при
50 С. Получают 8 г продукта (88 . от теоретического) в виде порошка светло-бежевого цвета. . Спектр ядерно-магнитного резонанса (Т-60, бикарбонат натрия/D,О)р.рм:
4,3 (тп, 2Н,С-З метилен) и 5,9 (S, 2Н, метиленовые, имеющие мостиковую связь, тетразольного кольца), дельта.
Пример 3. 78- альфа-метокс ..:ино-альфа-(2-амино-1,3-тиазол-4-ил)-ацетамидо)-3- (2- (1Н-тетразол-5-илметил)-2Н-тетразол-5-илтиометил)-3-цефем-4-карбоновая кислота.
К раствору, состоящему иэ 202 мг (1,2 ммоль) 2-/1Н-тетразол-5-илметил-2Н-тетразол-5-тиола в 6 мл буферного раствора, имеющего величину водородного показателя, равную
7 (полученную с помощью 176 мг, 2, 1 ммоля, бикарбоната натрия), добавляют 460 мг (1 ммоль) 78-/альфа-о
-метокси-имино-альфа-(2-амико-1,3-тиазол-4-ил)ацетамидо/цефалоспорановой кислоты и полученный таким образом раствор нагревают в масляной ванне в течение 22 ч при 55—
60 С. Спустя этот период времени с помощью хроматографирования реакционной смеси в тонких слоях установлено, что реакция завершена на 50 .
Дополнительно 100 мг тиола и эквивалентное количество бикарбоната натрия добавляют к реакционной смеси.
Полученную таким образом реакционную смесь нагревают в течение. примерно
12 ч при 55-60 С, охлаждают до комнатной температуры и промывают 2 раза порциями по 50 мл этилацетата.
Водную фазу отфильтровывают и фильтрат охлаждают в я дяной ванне до
55 температуры примерно 0 С. Величину рН при интенсивном перемешивании и продукт осаждают в виде осадка желтооранжевого цвета. Продукт отфильтровывают, промывают водой и сушат при комнатной температуре в вакууме.
В результате получают 153 мг смеси сини анти-форм продукта, Эти изомеры разделяют с помощью силикагеля с обратимой фазой, используя для этого смесь, состоящую из 15Х ацетонитрила, 2Х уксусной кислоты и 83 воды (об.Х).
ЯМР син-изомера: (360 МГц, ДАРБО-dp:
;d" 3,65 (m, 2Н,С-2,метилен), 3,85 (S, ЗН, оксим метил), 4,27 (m, 2Н, С-З-метилен), 5, 13 (d, 1H, С-6Н), 5,82 (g, 1Н,С-7Н), 6,42 ($1 2Н, метиленовые, с мостиковыми связями, тетразольного кольца), 6,78 (S, 1Н, теазол, Н), 7,29 (широкий S, 2Н, тиазоламино), и 9,61 {d, 1Н, 7-амид H) ррм.
ЯМР анти-изомера: (Зо0 МГц,ДМБО-.d):
3,60 (о 2Н, С-2 метилен), 3,95 (S, ЗН, оксим метил), 4,27 (m, 2Н, С-З, метилен), 4,97 (d, 1Н, С-6 Н), 5,76 (g, 1Н, С-7 Н), 6,33 (S 2Н, метиленовые, с мостиковыми связями, тетразольного кольца), 7,14 (широкий
S, 2Н, тиазол-амино Н), 7,46 (S, (.Н, тиазол Н), и 9,43 (а 2Н, 7-амид
Н) ррм.
Пример 4. 7-(2-тиенилацетамидо)-3-/1-(1Н-тетразол-5-илметил)-1H-тетразол-5-илтиометип-/- 3-цефем-4-карбоновая кислота.
Раствор 808 мг (2 ммоля) 7-/2-тиенилацетамидо/-3-ацетоксиметил-3"
-цефем-4-карбоксилата натрия (цефалотина натрия); 368 мг (2 ммоля)
1-/1FI-тетразол-5-илметил/-1Н-тетра зол-5-тиола и 168 мг (2 ммоля) бикарбоната натрия и 16 мп воды нагревают в масляной ванне в течение 7 ч при .55-60 С. Эту реакционную смесь концентрируют под вакуумом до объема примерно равного 8 мл и вводят в силикагель с обратимой фазой препаративного жидкостного хроматографа с высокой разрешающей способностью.
Разделение достигают в начале с использованием смеси, состоящей из
15 o6. ацетонитрила, 2 об.Х уксусной кислоты и 83 об.Х воды. Собирают множество фракций объемом 20 мп и после примерно 90 фракций их собирают и в качестве элюента используют смесь, состоящую из 20 ацето108707е
12 нитрила и 80 води. Фракции 133-153, содержащие продукт, соединяют и выпаривают. Получают 350 мг кристалли. ческого продукта, представляющего собой паранитробензиловый сложный эфир. Фракции 1<;i-193 содержат исходный материал — цефалотин натрия.
Следующие данные получают для кристаллического продукта.
ЯМР (100 МГц,ДМБО-а ): 3,63 (m, 2Н, С-2 метилен) 3,73 (S, 2Н, тиофенацетил метилен), 4,32 (ш, 2Н, С-3 метилен), 5,04 (с1 1Н, С-б), 5,63 (g, 1Н, CjH), 7.,97 (S, 2Н, тетразолметипен), 6,8-7,4 (m, ЗН, тиофен Н), и 9 08 (d, 1Н, 7 амид Н) ррм.
ИК спектр KBr) 8-лактам карбонильное поглощение при 17,75 cM ".
Масс-спектр: М.в. = 521.
Пример 5. 7-(2-тиенилацет-. амидо)-7-метокси-3/1-(1Н-тетразол-5-илметил)-iH-тетразол-5-илтиометил/-3-цефем-4-карбоновая кислота.
Раствор 3,1 r(6,,3 ммоля) пара-нитробензил 7-(2-тиенил-ацетамидо-7-метокси-3-бромметил-3-цефем-4-карбоксилата и 1,38 г (7,5 ммоля)
1-(1Н-тетразол-5-илметил)-1Н-тетразол-5-тиола в 20 мл диметилформами30 да перемешивают при комнатной температуре в течение примерно 16 ч.
Реакционную смесь выпивают в 150 мл смеси, состоящей из равных объемов однонормальной хлористоводородной кислоты и этилацетата. Органический слой отделяют, промывают два раза однонормальной хлористоводородной кислотой, один раз рассолом, далее сушат с помощью сульфата натрия, фильтруют и выпаривают до получения
40 сухого продукта, в результате чего получают 3 r нечистого продукта в виде пенообразного материала светло-. коричневого цвета. Этот продукт хроматографируют с использованием
75 г силикагеля и одного литра метиленхлорида, а затем обрабатывают
2 л метилен хлорида, содержащего
2Х метилового спирта, с целью элюирования. Хроматографическая колонка находится под давлением азота во время операции элюирования. Фракции, содержащие продукт, соединяют и выпаривают до получения сухого продукта. Оставшееся масло растворяют в этилацетате и раствор отфильтровывают. Полученный фильтрат далее концентрируют в вакууме до получения сухого продукта. В результате получают 0,84 г продукта.
Полученный выше продукт деэтерифицируют с помощью электролитического восстановления следующим образом. Раствор, состоящий из 700 мг (1 ммоль) пара-нитробензилового сложного эфира s 300 мп однонормальной серной кислоты в диметилформамиде, помещают в электролитическую ячейку, содержащую катод ртутной ванны и платиновый проволочный анод. Эти электроды разделены с помощью спекшейся стекломассы. Реакцию восстановления проводят при потенциале равном 0,64 В в течение периода времени свыше 3 ч, Восстановленный раствор выводят из ячейки и выпивают в 100 мл смеси, состоящей из равных объемов этилацетата и однонормальной хлористоводородной кислоты. Органический слой отделяют и промывают два раза однонормальной хлористоводородной кислотой. Этот продукт далее экстрагируют из органического слоя с помощью
50 мл водного раствора гидроокиси натрия, величина рН равна 7,5, а затем водный экстракт промывают этилацетатом. Водную фазу отслаивают с помощью свежего этилацетата, подкисляют до величины рН равной
2,2 хлористоводородной кислотой.
Органический слой отделяют, промывают 2 раза однонормальной хлористоводородной кислотой, рассолом, сушат сульфатом натрия и выпаривают до получения сухого продукта. В результате получают 290 мг продукта в форме свободной кислоты в виде пены желтого цвета.
Этот продукт очищают следующим образом. Продукт в количестве 270 мг растворяют в 0,05 M ацетата аммония путем добавления 2 капель rîíöåíòðèрованной гидроокиси аммония к суспензии продукта и полученный таким образом раствор фильтруют и вводят на силикагель с обратимой фазой, которым заполнена препаративная колонка жидкостного хроматографа с высокой разрешающей способностью. Колонку первоначально элюируют.смесью, . состоящей из 12Х ацетонитрила, 2Х уксусной кислоты и 86Х воды, а затем смесью, состоящей из 15Х ацетонитрила, 2 уксусной кислоты и 83 воды. Множество фракций объемом
1087076 l4
Составитель 3. Латыпова
Техред Л,Коцюбняк Корректор С. Шекмар
Редактор А. Долинич
Заказ 2287/54 Тираж 410 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4
20 мп собирают и фракции 72-89 соединяют и лиофилиэируют. В результате получают 75 мг продукта в виде сухого порошка.
ИК спектр: (КВг)8-лактам карбо- 5 нил поглощение при 1775 см 1.
Масс-спектр: М.в, = 55 1.
ЯМР (100 МГц, ДМБО-d6):ä 3,34 (Б, ЗН, 7-метокси), 3,51 (m, 2Н, С-2 метилен), 3,80 (S, 2Н, тиофенацетил метилен), 4 29 (m, 2Н, С-З,метилен), 5,06 (S, 1Н, С-6Н), 5,97 (2Н, тетразол .метилен), 6,9-7,4 (m, ÇH, тиофеновое кольцо Н), и 9,42 (S, 1Н, 7-амид Н) ррм.
Пример 6. 7-(О-формилминдальамидо)-3-/1-(1Н-тетразол-5-илметил)-1Н-тетразол-5-тиол/-3-цефем-4-карбоновая кислота.
К раствору, состоящему из 1,01 г (5,5 ммоль) 1-/1Н-тетразол-5-илметил/-1Н-тетразол-5-тиола в 15 мл буферного раствора, характеризуемого величиной рН равной 7 и содержащего 0,88 г бикарбоната натрия, добавляют 2,28 r (5 ммолей) натрий7-(О-формилминдальамидь)-3-ацетоксиметил-3-цефем-4-карбоксилат и полученный раствор нагревают с перемешиванием при температуре от 60 до 65 С ЗО о в течение 16 ч. Полученную реакционную смесь охлаждают до комнатной температуры и концентрируют до объема 6,5 мл путем выпаривания в вакууме. Полученный концентрат хроматогра-35 фируют на силикагеле с обратимой фа- зой с помощью жидкостного хроматографирования с высокой разрешающей способностью с использованием в качестве элюента смеси, состоящей иэ 127 ацетонитрила, 27 уксусной кислоты и 867. воды. Множество фракций объемом 20 мп собирают и исследуют с помощью анализа спектра ультрафиолетового поглощения на содержание цефема. Фракции 94-107 соединяют и лиофилизируют. В результате получают 120 мл соединения, указанного в заголовке.
ЯМР (90 МГц, ДМБО-dg): сигналы при о 3,84 (m, С-2 метилен), 4,54 (m, С-З метилен), 5 26 (d С-6Н), К,. 32 (S метин Н миндальамидо боковая цепь), 5,94 (g, С-7 Н), 6,24 (S тетраэол метилен), 7,4-7,8 (m, фенил Н), и 9,04 (d, 7-амин Н) ррм.
Пример 7. Син 78-/альфавЂ(метоксиимино)-альфа-(2-фурил)ацетамидо/-3-/1-(iH-тетразол-5-илметил)-1Н-тетразол-5-илтиометил-/-3-цефем-4-карбоновая кислота.
К раствору содержащему натрий
76-/альфа-(метокснимино) -альфа-(2-фурил)ацетамидо/-3-ацетоксиметил-3-цефем-4-карбоксилат и эквимолярное количество 1-(1Н-тетраэол-5-илметил)-1Н-тетразол-5-тиола, добавляют эквимолярное количество бикарбоната натрия в воде и этот раствор нагревают в течение примерно 24 ч о при температуре около 55 С. Реакционную смесь концентрируют при пони- . женном давлении и продукт отделяют из концентрата с помощью силикагеля с обратимой фазой при использовании жидксстного хроматографа с высокой разрешающей способностью.