Этиловый эфир 2-аминоэтилфосфоновой кислоты в качестве комплексообразователя для определения микроколичеств циркония
Иллюстрации
Показать всеРеферат
Этиловьй эфир 2-аминоэтилфосфоновой кислоты формулы рсн-гР г Нз о в качестве комплексообразователя для определения микроколичеств циркоQ ния. (Л 00 со со ел 4
СОЮЗ СО8ЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
„„SU„„1089954
)51) 4 С 07 7 9/38. 9/40е
G 01 N 21/78
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ABTOPGHOMV СВИДЕТЕЛЬСТВУ
Сабо PCHqCHgNHg — 0
ГОСУДАРСТ8ЕККЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3497389/23-04 (22) 01.10.82 (43) 30.11.85. Бюл. ¹ 44 (71) Институт органической химии
AH УССР (72) E.Ñ. Губницкая, В.С. Пархоменко, З.Т. Семашко, 1).И. Штокало и Е.Е. Костенко (53) 547.341.261)18(088.8) (56) Кабачник M.È. и др. Фосфорорганические кбмплексоны. Успехи химии, 1968, 37, № 7, с. 1161-1191, Петров К.A. и др. Аминоалкильные фосфорорганические соединения, Успехи химии, )974, 43, ¹ 11, с. 2045-,.
2087.
Конунова Ц,Б. и др. Изучение комплексообразования циркония с некоторыми аминокислотами металл-индикаторным методом. ЖНХ, 1976, 21, № 1, с. 100-105.
Губницкая Е.С. и др. Новый метод получения 2-аминоэтилфосфоновых кислот, BOX, 1980, 50, № 2, с. 456-, 457.
Губницкая E.Ñ. и др. Фосфорилирование 1-замещенных азаридинов хлорангидридами кислот фосфора, ЖОХ, 1980, 50, № 10, с, 2171-2184.
Краткая химическая энциклопедия, Изд. Советская энциклопедия, M.
1967, т. 5, с. 230.
Бабко А.К. и др. Металл-индикаторный метод изучения комплексов в растворе. Киев, Наукова думка, 1969, с, 71. (54 ) ЭТИЛОВЬЫ ЭФИР 2-АМИНОЭТИЛФОСФОНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ KONIIJIEKСООБРАЗОВАТЕЛЯ. ДЛЯ ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ ЦИРКОНИЯ (57) Этиловый эфир 2-аминоэтилфосфоновой кислоты формулы в качестве комплексообразователя для определения микроколичеств циркония.
Изобретение относится к химии фосфорорганических соединений, конкретно к этиловому эфиру 2-аминоэтилфосфоновой кислоты, обладающему комплексообразующим свойством, что .предполагает возможность его применения в аналитической химии в качестве комплексообразователя ast on" ределения микроколичеств циркония.
Этиловый эфир .2-аминоэтилфосфоновой кислоты формулы: ! с н о
РСН СН Н вЂ” О !!
0 в литературе не описан и является новым, Известно, что большинство производных 2-аминоэтилфосфоновой кислоты являются биологически активными веществами и обладают комплексообразующими свойствами.
Известно, что аминокислоты общей формулы
Г н Nc+ — с — он
В
0 где R и R .- алкил, образуют комплексы с цирконием.
Ближайшими структурными аналогами описываемого .вещества являются этиловые эфиры N-алкил-2-аминоэтилфосфоновой кислоты формулы
,н,о. +
РСИ СН 1 Н АВ
О II
О где 41K= NCCH CH, С }{ С}{ С}{
Однако комплексообразуюцие свойства указанных соединений не изучались.
В качестве эталона может служить комплексообразователь -бензо- 2 -ар/
„I соновая кислота — (-азо-1)-2-оксинафтапин-3,6-дисульфокислота, тринатриевая соль (торон) формулы
АвО НЫа
ОН ВОРа
Я()фд
89954 2. который способен образовывать комплексы с цирконием.
Ряд веществ, которые дают устой"" чивые комплексы с цирконием, ограничен. Поэтому важно получить вещество из доступного сырья простым синтезом, обладающим комплексообразующим свойством.
Целью изобретения является повы10 шение эффективности комплексообразователя для определения циркония, Поставленная цель достигается но" вым соединением, этиловым эфиром
2-аминоэтилфосфоновой кислоты. Ус-!
5 тойчивость комплекса этого вещества с цирконием на 4-5 порядков выше ус" тойчивости комплекса циркония с тароном и аминокислотами.
Способ получения нового соедине20 ния заключается в том, что при гидролизе 1-диэтоксифосфино-2-этокси-1,2-азафосфетидина получают этиловый эфир 2-аминоэтилфосфоновой кислоты по схеме
0 и о (С2Н О) РИ POC2Н5 — з
Н С-СН
С2Н О + Рсн,снуи, — O
35 0
Пример 1. К 0,01 моль (2,55 г) 1-диэтоксифосфино-2-этокси-1,2-азафосфетидина.прибавляют 10 мл а
40 воды при 20 С и оставляют на 5 ч, избыток воды упаривают. Выпавшие кристаллы отфильтровывают, промывают смесью спирта и эфира в со*отношении 1:1 (2 раза ло 15 мл) и сушат. Получают бесцветное кристал45 лическое вещество,,пегко растворимое в воде, труднее в спирте, нитрометане, не растворимое в эфире и петролейном эфире. Выход 657 (1 г), т ° пл. 234-236 С.
Вычислено, Ж: С 31,37; Н 7,90;
N 9,15; P 20,23.
NO3 °
Найдено, 7.: С 31,4 }{ 7,89;
N 8,71; P !9,92.
Структура нового соединения подтверждена ИК-спектром. ИК-спектр (KBr,, см ): 3100-2600 (I{y,, !
200.-1190. 960 (О=.Р.-{} ), I070- !050
)089954 да) .
Название реагента
Формула реагента
ОсгН5
) +
2С 2 3
Q—
2,03 10 (P-О-A)K). ИК-спектр снят на приборе "UR-20".
Пример 2. Изучение комплексообразующих свойств полученного вещества.
B работе использовали 10 M раствор ZrC1 приготовленный разбавлением исходного 0 1 М раствора ZrC1
-з
1N соляной кислотой; 10 M раствор эриохромцианина (ЭХЦ) фирмы "Chemano1", приготовленный по точной навеске и 0,032 Yi раствор описываемого соединения (P), который получают растворением навески препарата в воде ° Оптическую плотность измеряют на СФ-16 и ФЭК-5б с Я = 550 нм после достижения равновесия в системе. О комплексообразовании циркония с заявляемым веществом судят но изменению окраски индикаторной системы под действием вещества. В качестве последней бып избран комплекс циркония с ЭХЦ, так как в литературе имеются надежные сведения о его составе и условиях. образования. Основными характеристиками этого окрашенного комплексного соединения являются: E = 3,7. 10 Я,„ = — 550 нм, соотношение компонентов в комплексе составляет 2r : ЭХЦ
1:2, рН = ),8.
Опыт проводят следующим образом.
К 0,25 мл 10 М ZrC1<, прибавляют 0,1"
1,5 мл 0,032 М раствора заявляемого вещества и 0,5 мл 10 . М ЭХЦ. Раствор доводят до метки соляной кислотой, создавая в объеме 25 .мл рН " 2.
Кислотность среды контролируют с помощью рН-метра ЛПУ-О1. После установления равновесия в системе измеряют оптическую плотность в кювете с 1 = 1 см (раствор сравнения — воЭтиловый эфир 2-аминоэтилфосфоновой кислоты
Полученные экспериментальные дан ные используют для определения соотношения компонентов в изучаемом комплексе и для последующего расчета константы равновесия его образования в соответствии с положениями металл-индикаторного метода изуче- . ния комплексов в растворе. С помощью металл-индикаторного метода изучено !
О комплексообразование в системе ЕгP-ЭХЦ. Методом сдвига равнове"ия установлено соотношение компонентов в комплексе,. равное Zr : P = 1:1.
Рассчитана константа равновесия образования комплекса Ег с P. Среднее значение ее, полученное в результате обработки данных методом математиС ческой статистики, равно К = (2,03+
+0,4?) )0 ". Эта величина наглядносвидетельствует, что Zr с заявляемым веществом образует достаточно прочное комплексное соединение, которое вполне пригодно для использования его в разработке экстракционно-фото25 метрического или фотометрического метода количественного определения микроколичеств Zr в различных объектах.
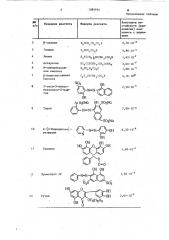
При сравнении величины константы равновесия комплекса циркония с заявляемым веществом — комплексообразователями, описанными в литературе, видно, что устойчивость комплекса циркония с P на 1-5 порядков вь ше.В таблицеприведены данные:конс35 тант равновесия комплекса с цирконием.
Таким образом, в результате проведенных исследований установлено, что описываемое соединение является эф40 фективным комплексообразователем и может служить в качестве комплексообразователя для определения микроколичеств циркония.
1089954
Н NCH СН СО Н
6, 30 .10" б г зсО Н
Н И(СН ) Сн(ИЬ )СО N
3,60 10
1,00.10 5
НО. ССН(ИН )CH CONH
Н И с Н С О Н
Аспарагин
N-аминдбензойная кислота
3,16 10
С Н СН,НН )СО Н -Аминомаслянная кислота
2,50 ° 10
2-окси-5-нитробензолазо-2-.нафтон
= N
0Н
А ОзНИа ОН SOLANO
7,90 10 6
Торон
S03Na
10 4 {2-Пиридилазо 1 — / 1, резарцин /
6,30-10
ОН
oH oH
О OH
1,60 -10
Галлеин
1,58.10
Хромотрол 2Р
Q(N=N
03$
S0-3
0Н
ОН
2, 65 ° 10
13 Рутин
@ g 0 дН2109
-алании
Р
Глицин
Лизин
С с=о
0Н 0Н
Продолжение таблицы !
9,80 10
l,62" 10