Способ получения производных карбостирила или их фармакологически приемлемых кислотно-аддитивных или четвертичных солей
Иллюстрации
Показать всеРеферат
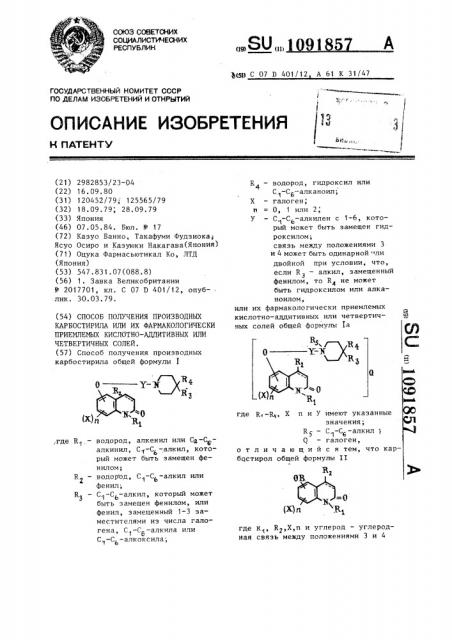
Способ получения производных карбостирила общей формулы I К - водород, гидроксил или 4 С -С2--алканоил; Xгалоген; 0, 1 или 2, «1 -С,.-алкилен с 1-6, котоУI о рый может быть замещен гидроксилом; связь между положениями 3 и 4 может быть одинарной ли двойной при условии, что, если RI алкил, замещенный фенилом, то R не может быть гидроксилом или алканоилом , или их фармакологически приемлемых кислотно-аддитивных или четвертичных солей общей формулы 1а /где R-,.- водород, алкенил или Cg-Cg.алкиншт , C-f-C -алкил, который может быть замещен фенилом; RJ - водород, С -С -алкил или фенил; R, - С -С -алкил, который может быть замещен фенилом, или фенил, замещенный 1-3 заместителями из числа галогена , C -Cg-алкила или ,-алкоксила; О ;о сх ел значения; С -Cg-алкил 5Q - галоген, чающийся тем, что каро т л и брстирол общей формулы II И ож (п где К, R2,X,n и углерод - углеродная связь между положениями 3 и 4
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (191 (111
1 5 А
1
1м
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К flATEHTY
1«««
Y — N
К
0 йЙ (xj X- 0
kt1
1 (Х) л,где К„,— 2
0Е
3
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 2982853/23-04 (22) 16.09.80 (31) 120452/79 125565/79 (32) 18.09.79; 28.09.79 (33) Япония (46) 07.05.84. Бюл. ¹ 17 (72) Казуо Банно, Такафуми Фудзиока;
Ясуо Осиро и Казуюки Накагава(Япония) (71) Оцука Фармасьютикал Ко, ЛТД (Япония) (53) 547.831.07(088.8) (56) 1. Завка Великобритании № 2017701, кл. С 07 D 401/12, опублик. 30.03.79. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
КАРБОСТИРИЛА ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ
ПРИЕМЛЕМЫХ КИСЛОТНО-АДДИТИВНЫХ ИЛИ
ЧЕТВЕРТИЧНЫХ СОЛЕЙ. (57) Способ получения производных карбостирила общей формулы I водород, алкенил или Са-С алкинил, С-(-Сь -алкил, который может быть замещен фенилом водород, С1-СЬ -алкил или фенил;
С„-С -алкил, который может быть замещен фенилом, или фенил, замещенный 1-3 заместителями из числа галогена С -С -алкила или 1 б
С -С -алкоксила; ф(51) С 07 D 401/12 А 61 К 31/47
R — водород гидроксил или
С„-С -алканоил;
Х вЂ” галоген, О, 1 или 2;
У вЂ” С -С -алкилен с 1-6 котоь
% рый может быть замещен гидроксилом; связь между положениями 3 и 4 может быть одинарной «ли двойной при условии, что, если Rэ — алкил, замещенный фенилом, то R не может быть гидроксилом или алканоилом, или их фармакологически приемлемых кислотно-аддитивных или четвертичных солей общей формулы Ia где R -K„ X п и У имеют указанные значения;
R — С -С -алкил 1
6 галоген, отличающийся тем, что карбс1стирол общей формулы II где 1(, R2,Õ,ï и углерод — углерод1 « ная связь между положениями 3 и 4
1091857 имеют укаэанные значения,  — водо1 род или групга Х -У-, где У имеет указанные значения, а Х вЂ” галоген, подвергают взаимодействию с производным пиперидина общей формулы III где R u R имеют указанные значения, Z — водород или группа Х -У-, где У
2 имеет указанные значения, а Х - галоген, при условии, что, если  — водород, то — группа Х У-, а если В группа X -У-, то Z — водород, 1 с последующим выделением целевого продукта в виде основания или кислотно-аддитивной соли или обра1, Изобретение относится к способу получения производных карбостирила и их солей, обладающих антигибтаминной активностью и которые могут найти применение в медицине.
Известна реакция 0-алкилирования производных карбостирила 5 1 3.
Цель изобретения — способ получения производных карбостирила, обладающих ценными фармакологическими свойствами.
Поставленная цель достигается о „; нованным на известной реакции способом получения производных карбостиРила общей формулы Е где R — водород, алкенил или С2-СЬалкинил, С„-С -алкил, который может быть замещен фенилом
Rÿ водород С.„С алкил ипи фенил, R — С -С -алкил, который может
3 1 Ь быть эамещен фенилом, или фенил, замещенный 1-3 эаботкой соединением общей формулы ЕV где Rg 0 имеют указанные значения,и выделением четвертичной соли формулы Ia
Приоритет по признакам:
18.09.79 при К вЂ” все = -íà÷åíèÿ,,R2 — все значения, R — С,, — СЬ-алкил, который может быть замещен фенилом,фенил; R -водород, 0 — гапоген.
28.09.79 при R> — фенил, замещенный 1-3 заместителями из числа галогена, С„-С алкила или С1-С -алкоксила, R <—
С -С,-алкил .
2 местителями из числа галогена, С1-Сб-алкила или С„-СЬалкоксила, R — водород, гидроксил или
5 С -С -алканоил.
Ь
Х вЂ” галоген; и - О, 1 или 2, У вЂ” С -С -алкилен который может
1 б
9 быть замещен гидроксилом; связь между положениями 3 и 4 можеч быть одинарной или двойной при условии, если R, — алкил, замещенный
/ фенилом, то К„: не может быть гидроксилом или алканоилом, или их фармаск.
15 кологически приемлемых кислотно-аддитивных или четвертичных солей общей формулы Ia где R R< Х, и и У имеют указанные значения;
R < — С,-С -алкил, галоген, заключается в том, что карбостирил общей формулы II
1П91857
Отношение количества соединения об; щей формулы II к количеству соединения общей формулы 1 желательно иметь таким, чтобы второе соединение использовалось от эквимолярного до избыточного количества по отно"де Н1, R2, Х, и и углерод — углеродная связь между положениями 3 и 4 1р имеют указанные значения,  — водород или группа Х1-Ó-, где У имеет указанные значения, а Х вЂ” галоген, подвергают взаимодействию с произ-водным пиперидина общей формулы III
-,д (3
Bq где R3 и R+ имеют указанные значения, 20
2 — водород или группа Х -У-, где
У имеет указанные значения, а Х галоген при условии, если  — водород, то Z — группа ХЗ-У-, а если В
1 группа формулы Х -У-, то 2 — водород, с последующим вьделением целевого продукта в виде основания или кислотно-аддитивной соли или обработкой соединением общей формулы IV цептрона галогеноводорода, например, карбонат калия, карбонат натрия, гидроокись натрия, бикарбонат натрия, амид натрия, гидрид натрия, третичный амин, такой как триэтиламин, пиридин, хинолин и другие. На реакцию может также оказать влияние иодид щелочного металла, например иодистого натрия или иодистого калия, в качестве ускорителя реакции.
5Р
5
30 где R 5 и Я имеют указанные значения, и выделением четвертичной соли формулы Ia.
Взаимодействие соединения II с соединением Ш проводят в инертном растворителе или в отсутствие растворителя при температуре от комнатной до 200 С, обычно 60-120 С.
В качестве растворителя может быть использован, например, простой эфир, такой как диоксан, тетрагидрофуран, диметиловый эфир этиленгликоля и другие, низший спирт, такой как метанол, этанол, изопропанол и другие, полярный растворитель, такой как диметилформамид, диметилсульфоксид. На реакцию может благотворно влиять основание в качестве акшению к первому, предпочтительно от эквимолярного до 5-кратного молярного количества и наиболее предпочтительно от 1 до 1,2 моль второго соединения на 1 моль первого соединения.
Соединения общей формулы II, используемые в качестве исходных материалов, включают новые соединения, которые можно получить по известным схемам.
Производные карбостирила формулы I могут быть легко превращены в их кислотно-аддитивные соли взаимодействием с фармакологически приемлемыми кислотами. Примеры таких кислот включают минеральные кислоты, такие как соляная кислота, серная кислота, фосфорная кислота, бромистоводородная кислота и тому подобные, органические кислоты, такие как уксусная кислота, щавелевая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, малоновая кислота, метансульфоновая кислота, бензойная кислота и т.п.
Превращения производных карбостирила общей формулы I в их четвертичные соли Ia проводят в инертном растворителе.
Фармакологический тест 1.
Антигистаминная активность. Антигистаминную активность соединений I
in vitro определяют с использованием энуклеированной подвздошной кишки морской свинки.
Самцов морских свинок весом 300500 г умерщвляют обескровливанием.
Подвздошную кишку длиной 15 см вьделяют из илеоцекальной области и погружают в раствор Тирода (приготовленный из 8,0 г NaCK; 0,2 r КСг., 0,2 г СаС 12, 1,0 r гrл юкKоoз3bы,, 11,0 г
NaHC0>, 0,065 r NaHP0< 2Н20 и
0,2135 г NgC 2 2 6Н20 и доведенный до
1000 мл общего объема добавкой воды).
Затем ткань подвздошной кишки разрезают на полоски длиной 2,5-3,0 см и суспендируют в ванне для органов, saполненной 30 мл раствора Тирода. Тем \ 4
1091857 пературу ванны поддерживают 36 С и в нее пропускаюг газовую смесь, состоящую из 57 00 и 57 02. После 10-минутного пропускания в ванну добавля-й ют 10 М гистамина, исследуют чувст- 5 вительность ткани и получают кривую зависимости от дозы гистамина (контрольная). По достижении постоянного значения кривой для реакции от дозы гистамина (контроль) в ванну добав-6 ляют 10 г/мл испытываемого соединения и через 5 мин еще гистамин для получения кривой зависимости от дозы.
Сморщивание подвздошной кишки регистрируют самописцем через изотонический преобразователь сигнала. Противогистаминная активность испытываемо-го соединения определяется как значение рА> по методу Ван Россама при.
1 условии, что максимальная ретракция, показанная на контрольной кривой, равна 1007. Результаты представлены ниже.
Испытываемые соединения (соединения, получаемые по изобретению, примеры 1 — 15):
1 5- 3-(4-бензил-1-пиперидил)пропокси 1-3,4-дигидрокарбостирил( монооксалат 1-метил-7-(3-(4-бен зил-1-пиперидил)пропокси(-3,4-дигидрокарбостирила;
3 моногидрохлорид 1-пропаргил-5-(3(4-бензил-1-пиперидил)-пропокси )
3,4-дигидрокарбостирила;
4 моногидрохлорид 4-метил-5- 3-(4бензил-1-пиперидил)-пропокси (-3,435 дигидрокарбостирила;
5 4-метил-7- 3-(4-бензил-1-пиперидил)пропокси)карбостирил;
6 монооксалат-1-аллил-4-(2-окси-(440 бензил-1-пиперидил)-пропокси(-3,С4дигидрокарбостирила
7 монооксалат 1-этил-5-Li2-окси-3(4-бензил-1-пиперидил)-пропокси)3,4-дигидрокарбостирила;
8 8-бром-5- 2-окси-. 3-(4-бензил-il— о пиперидил)пропокси)-3,4-дигицрокарбостирил;
9 7- 2-окси-3-(4-фенил-1-пиперидил) пропокси )-3,4-дигидрокарбостирил, 10 монооксалат 1-метил-5-(2-окси-350 (4-бензил-1-пиперидил)пропокси )3,4-дигидрокарбостирила;
11 иодистый 4-фенил-1- 2-окси-3-(2оксо-1 2 3 4-тетрагидрохинолин-5У Э У
55 илокси)пропил)-1-метилпиперидиний
12 монооксалат 1-бензил-4-(2-окси(4-бензил-1-пиперидил)-пропокси(3,4-дигидрокарбостирила;
13 моногидрохлорид 4-фенил-7- 3-(4фенил-1-пиперидил) пронокси)карбо( стирила, i4 5- (3-(4- (4-окси-4-фенил)(-l-пиперидил )-3,4-дигидрокарбостирил
15 7- (3-Г4-(4-ац тил-4-фенилЦ -1пиперидил -3,4-дигидрокарбостирил.
Известные соединения:
А дифенилгидрамин гидрохлорид;
В малеат хлорфенирамина.
pA2
9,52
10,70
9,73
1i,00
9,59
9,54
9,65
8,39
9,62
8,23
10,70
9,73
9,30
9,92
8,15
В 9,00 фармакологический тест 2.
Определение острой токсичности.
Проводят на самцах крыс, которым соединения вводят перорально. РЕзультаты приведены ниже.
Острая токсичность
ЛД,О, мг/кг
1 у1,000
>1,000
71,000
1091857
>1,000
>1,000
>1,000
>1,000
>1,000
>1,000
>1,000
>1,000
>1,000
12
13 >1,000
14 )1,000
15 >1,0О0
Пример 1 (ссылочный). 20,5 r
5-ацетилокси-3,4-дигидрокарбостирила растворяют в 200 мл уксусной кислоты и в этот раствор по каплям при охлаждении водой и перемешивании в течение 30 мин добавляют раствор 16 г брома в 60 мл уксусной кислоты, затем перемешивание продолжают 2 ч при той же температуре. К реакционной смеси добавляют 300 мл воды и оставляют на 3 ч. Образующиеся кристаллы отделяют фильтрацией и перекристаллизовывают из метанола. Получают 21 г
8-бром-5-ацетилокси-3,4-дигидрокарбостирола в виде бесцветных игловидных кристаллов, т.пл. 237-239 С. е 21 г полученного 8-бром-5-ацетил-. окси-3,4-дигидрокарбостирила диспергируют в 150 мл 8 н. соляной кисло- ты и кипятят с обратным холодильником 3 ч. После охлаждения реакционной смеси выпавшее вещество отделяют фильтрацией, промывают водой, сушат и перекристаллизовывают из смеси метанола и воды. Получают 14 г
8-бром-5-окси-3,4-дигидрокарбостирила в форме бесцветных игловидных кристаллов, т.пл. 212-213 С.
Пример 2 (ссылочный). 35 4 r
7-метокси- 3,4-дигидрокарбостирила растворяют в 300 мл уксусной кислоты и при охлаждении в ледяной бане и при перемешивании к этому раствору добавляют по каплям 27 r хлористого сульфурила, растворенного в
1О 15, смеси метанола с хлороформом. Получают 25 г 6-хлор-7-окси-3,4-дигидрокарбостирила в виде бесцветных игловидных кристаллов с т.пл. 264-266 С;
Пример 3 (ссылочный) . 16,4 г
5-окси-3,4-дигидрокарбостирила раст25 воряют в 300 мл уксусной кислоты и к этому раствору по каплям добавля30
100 мл уксусной кислоты, затем реакционную смесь оставляют на ночь.
Реакционную смесь выливают в 1 л воды со льдом, образовавшийся осадок отфильтровывают, промывают водой, сушат и перекристаллизовывают из метанола. Получают 30 г 6-хлор7-метокси-3,4-дигидрокарбостирила в виде бесцветных игловидных кристаллов с т.пл. 212 С.
30 г полученного 6-хлор-7-метокси-3,4-дигидрокарбостирила диспергируют в 300 мл 472-ной бромистоводородной кислоты и кипятят с обратным холодильником 4 ч. После охлаждения реакционной смеси из нее выделяют фильтрацией образовавшееся вещество,,промывают водой и кристаллизуют из ют при перемешивании при комнатной температуре 80 мл уксусной кислоты, содержащей 14 г хлора, затем продолжают перемешивать еще 3 ч. Реакционную, смесь выливают в 500 мл воды и оставляют на 1 ч. Образовавшийся осадок отделяют фильтрацией, промывают водой, сушат и перекристаллиэовывают из метанола. Получают 16 г
6,8-дихлор-5-окси-3,4-дигидрокарбостирила в виде бесцветных кристаллов с т.пл. 259-260 С.
Hp и м е р 4. 20,0 и 8-бром-5окси-3,4-дигидрокарбостирила и 18 r карбоната калия диспергируют в 160 мл изопропанола, затем добавляют 40 мл эпихлоргидрина и нагревают при 80 С о в течение 6 ч. Реакционную смесь концентрируют при пониженном давлении, к полученному остатку добавляют
100 мл 2 н. гидроокиси натрия и тщательно перемешивают. Образовавшееся вещество отделяют фильтрацией, промывают водой, сушат, перекристаллизовывают из метанола, получают
18,5 г 8-бром-5-(2,3- эпоксипропокси)3,4-дигидрокарбостирила в виде бесцветных игловидньтх кристаллов с т.пл. 220-222 С.
Пример 5 (ссылочный). 16,4 r
5-окси-3,4-дигидрокарбостирила и
3,7 r гидроокиси натрия вносят в
i 0c!1857
100 мл метанола и перви пинают при
40-50 C 3 v, затем к смеси доба!зляют
150 мл эпихлоргидрина и кипятят с обратным холодильником 5 ч. Реакционную смесь концентрируют при пони- 5 женном давлении досуха и получе!(ный остаток перекристаллизовывают из смеси метанола с водой в отношении 1:1.
Получают 18,5 г 5-(2,3-эпоксипропокси)-3,4-дигидрокарбостирила з виде бесцветных кристаллов с т.пл. 172173 С.
Пример 6 (ссылочный) . 16,3 г
5-окси-3,4-дигидрокарбостирила и 9 г гидроокиси калия смешивают со 150 мл изопропанола и перемешивают при 7080 С 30 мин. Затем к смеси добавляо ют 25 r 1,3-бромхлорпропана и кипятят с обратным холодильником б ч.
После завершения реакции реакционную смесь выливают в 200 мл 2 н. водного раствора гидроокиси натрия и образовавшееся твердое вещество отделяют фильтрацией, промывают водой, сушат,,ag перекристаллизовывают из этанола и получают 18,5 r 5-(3 — хлорпропокси)-.
3,4-дигидрокарбостирила в !зиде бесцветных игловидных кристаллов с т.лл. 176-178 С.
Пример 7 (ссылочный). 24 г
4-фенилниперидина, 24 г 1-хлор-3бромпропана и 15 г триэтиламина смешивают со 100 мл диметилформамида. и перемешивают при 50-60 С " ч. Реакционную смесь выливают в 200 мл на-сыщенного водного раствора хлористо-го натрия и органический слой экстрагируют хлороформом. Затем хлороформный слой промывают водой, сушат и хлороформ удаляют дистилляцией. По.;<<- 0 ченный остаток очюцают хроматографией на колонке с силикагелем. Получают 15,3 г 1-хлор-3-(4-фенилпиперидил)пропана в виде бесцветного маслянистого вещества,. которое г.ерегоЫяют и получают 11 г с т. кип. 112О
115 С!0,1 мм рт.ст. Часть этого дис-тиллята превращают в гидрохлорид и перекристаллизовывают из этанола.
Получают 1-хлор-3-(4-фенил-1-пипе-.
15идил)пропан моногидрохлорид с т.пл. 167-169 С в ниде бесцветных
Ю
ИГловидных KpHCTGJIJIOB °
Пример 8 (ссылочный) . Анало-гично примеру 7 получают 1-хлор-2- 5 > метил 3-(4-фенил-1-пиперидил)пропан в виде бесцветного маслянистого вещества т.кип.114-116 С/0,1 мм рт,с!-, Пример 9 (ссылочный) . 16,0 г
4-окси-4-фенилпиперидина, 24 г 1— хлор-3-бромпрспана и 15 г триэтиламина смешивают со 100 мл диметилформао мида и перемешивают при 50-60 С 1 ч.
Реакциоп!- ую смесь выливают в 200 мл насыщенного водного раствора хлористого натрия и органический слой экстрагируют хлсроформом, промывают водой, сушат и хлороформ удаляют дистилляцией. Полученный остаток очищают хроматографией на колонке с силикагелем. Получают 14,3 г 1-хлор3-(4-окси-4-фенил-1-пиперидил)пропана в виде бесцветного маслянистого вешества. Это масло перегоняют при пониженном давлении. Дистиллят пере в дят в гидрохлорид, перекристаллизовывают из этанола и получают моногидрохлорид 1-хлор-3-(4-окси-4-фенил-1-пиперицил)пропана с т.пл.1920
195 С в виде бесцветных игловидных кристаллов.
Пример 1, 4,8 г 5-(3-хлорпропокси)-3,4-дигидрокарбостирила и
4,2 г 4-бензилпиперидина смешивают с 40 мл толуола и кипятят с обратным холоцильником 24 ч. Поспе охлаждения реакционной смеси образовавшийся осацок отделяют фильтрацией, промывают водой, перекристаллизовывают из этанола и получают 6,3 г (76K) 5-ГЗ(4--бензил- 1-пиперидил)пропокси)-3,4дигидрокарбостирила в форме бесцвет— !
ых иглозидных кристаллов с т.пл.143.45 С.
П р и и е р 2. 4 9 г 1-метил-7) (З-хлорпропокси)-3,4-дигидрокарбостирила,, 4,,2 г 4-бензилпиперидина и 3 г триэтиламина смешивают с 60 мл диметилформамида. Смесь нагревают при
70-80"С 8 ч. После завершения реакпии реакционную смесь концентриру— ют при пониженном давлении досуха.
Полу-<енный остаток растворяют в
57.-ном водном бикарбонате натрия и экстрагируют хлороформом. Хлороформный слой промывают водой, сушат, зате!. хлороформ удаляют дистилляцией.
Полученный остаток растворяют в
30 мл ацетона и добавляют к нему при перемешивании 57-ный раствор щавелевой кислоты в ацетоне до рН 4,5., затем выдерживают реакционную смесь.
Образовавшийся при этом осадок отделяют фильтрацией, промывают ацетоном, перекристаллизовывают из смеси этанола и простого эфира и полу12
1091857 м чают 7,9 г (выход 867.) 1-метил-7-1.3(4-бензил-1-пиперидил)пропокси)-3,4- дигидрокарбостирила монооксалата в виде бесцветного порошка, т.пл. 175177 С. 5
Аналогичным способом, описанным в примере 2, получают соединения примеров 3-16.
Пример 3. 1-Пропаргил-5-(3(4-бензил-1-пиперидил)пропокси )-3,4дигидрокарбостирил гидрохлорид моногидрат.
Бесцветные игловидные кристаллы (из смеси метанола и простого эфира) .
Т.пл. 172 С (с разл.). 15
Пример 4. 1-Метил-5-(3 †(4бензил-1-пиперидил)пропокси)-3,4-дигидрокарбостирил.моногидрохлорид.
Бесцветные игловидные кристаллы (из смеси метанола и простого эфира). 20
Т.пл. 130-133 С.
Пример 5. 1-Гексил-7-(3-(4фенил-1-пиперидил)пропокси)-3,4-дигидрокарбостирил монооксалат.
Бесцветные игловидные кристаллы (из изопропанола). Т. пл. 168-170 С.
Пример 6. 1-(3-Фенилпропил)— 7 — (3-(4-фенил-1 — пиперидил)пропокси)3,4-дигидрокарбостирил монооксалат.
Бесцветные игловидные кристаллы ЗО (из смеси метанола с водой. Т.пл.210213 С.
Пример 7. 6,8-Дихлор-5-(2метил-3-(4-фенил-1-пиперидил)пропок си)-3,4-дигидрокарбостирил.
Бесцветные игловидные кристаллы (из лигроина). Т.пл. 125-126 С.
Пример 8.5-(3-(4-Бензил-1пиперидил)пропокси)-3,4-дигидрокар40 бостирил-моногидрохлорид.
Бесцветные игловидные кристаллы (из метанола). Т. пл. 213-215 C.
Пример 9. 5-(3-(4-Бензил-1пиперидил)пропокси)-3,4-дигидрокарбо4S стирил.
Бесцветные игловидные кристаллы (из смеси лигроина и бензола) .
T пл. 143-145 С.
П р и м е у 10. Монооксалат 7-(3(4-бензил-1-пиперидил)пропокси)-3,450 дигидрокарбостирила
Бесцветные призмы (из этанола).
Т.пл. 175-177 С.
Пример 11. Моногидрохлорид
7-(3-(4-феяил-1-пиперидил)пропокси155
3,4-дигидрокарбостирила.
Желтоватые игловидные кристаллы (иэ этанола). Т.пл. 252-254 С.
Пример 12. Моногидрохлорид
4-метил-7-(3-(4-бензил-1-пиперидил) пропокси)карбостирила дигидрат.
Бесцветные игловидные кристаллы
О (из этанола) . Т. пл. 241-242 С.
Пример 13. Моногидрохлорид
5-(3-(4-фенил-1-пиперидил)пропокси )3,4-дигидрокарбостирила.
Бесцветные игловидные кристаллы (из метанола). Т,пл. 200 С.
Пример 14. Моногидрохлорид
4-метил-6-j3-(4-(4-метилфенил)-1пиперидил)1пропокси карбостирила.
Бесцветные игловидные кристаллы (из метанола). Т.пл. 256-259 С (с разл.).
Пример 15. Моногидрохлорид
4-метил-6-13-(4-(4-хлорфенил)-1-пиверидил)пропоксиЗкарбостирила.
Бесцветные игловидные кристаллы о (из метанола). Т.пл. 263-265 С.
Пример 16. Монооксалат 1-изопентил-2-окси-3-(4-(3,4,5-триметоксифенил)-1-пиперидил)пропокси-3,4-дигидрокарбостирила.
Бесцветные хлопьевидные кри таллы (из этанола). Т.пл. 199-201 С.
Пример 17. 2,7 г 7-(5-бромэтокси)-3,4-дигидрокарбостирила, 2,0 г 4-бенэилпиперидина и 1,5 г триэтиламина смешивают с 30 мл диметилформамида и смесь нагревают при 6070 С 6 ч. Затем реакционную смесь концентрируют при пониженном давлении досуха и к полученному остатку добавляют 57.-ный водный раствор бикарбоната натрия и перемешивают. Образовавшееся твердое вещество отделяют фильтрацией, промывают водой и сушат. Перекристаллизацией из лигроина получают 3,6 r (выход 88 ) 7(5-(4-бензил-1-пиперицил)пентокси)3,4-дигидрокарбостирила в виде бесцветных пластинчатых крис аллов.
Т.пл. 100-102 С.
Пример 18. 2,5 г 4-метил-6(З-хлорпропокси)карбостирила, 1,8 г иодистого натрия смешивают с 50 мл ацетона и перемешивают при 50 С 1 ч, о затем добавляют 50 мл диметилформамида и ацетон удаляют дистилляцией при пониженном давлении.
К полученному остатку добавляют
1,5 r триэтиламина и 1,6 r 4-бензилпиперидина и смесь нагревают при перемешивании в течение 7 ч при 7080 С. Затем реакционную смесь концентрируют при пониженном давлении
1091857 досуха и к остатку добавляют 60 мл
57.-ного водного раствора бикарбоната натрия. Образующееся вещество отделяют фильтрацией, промывают водой, затем перекристаллизовывают из метанола и получают 3,2 г (выход
82%) 4-метил-б-(3-(4-бе..зил-1-липеридил)пропокси)карбостирила в виде желтоватых призматических кристаллов.
Т.пл. 177 †1 С.
Методом, аналогичным описанному в примере 18, получают следующие соединения примеров l9-24.
Пример 19. 4-Метил-7-(3-(4бензил-1-пиперидил)пропокси)карбости- 15 рил.
Бесцветные игловидные кристаллы (из метанола). Т.пл. 183- 184 С. о
Пример 20. Моногидрохлорид
4-,фенил-7-(З-(4-фенил-1-пиперидил) пропокси)карбостирила.
Бесцветные игловидные кристаллы (из смеси метанола и простого эфира). Т.пл. 238-241 С.
Пример 21. 4-Метил-6-f3 (4бензил-1-пиперидил)пропокси)карбостирил.
Желто-бурые призмовидные кристаллы (из метанола). Т.пл. 177-178 С.
Пример 22. Моногидрохлорид ЗО
4-метил-6-(3-(4-бензил-1-пиперидил) пропокси)карбостирила.
Бесцветный кристаллический порошок (из смеси этанола, ацетона и, простого эфира). Т. пл. 217 С.
Пример 23. Моногидрохлорид
4-метил-б-(3- ((4-метилфенил)-1-пицеридил)-пропокси)карбостирила.
Бесцветные игловидные кристаллы из метанола. Т.пл. 256-259 С 40 (с разлож. ) .
Пример 24. Моногидрохлорид
4-метил-6- f3-((4-хлорфенил)-1-пиперидил)-пропокси карбостирила.
Бесцветные игловидные кристаллы (из метанола). Т.пл. 263-265 С.
О
Пример 25. 2,6 r 1-Лллил5-(2-окси-З-хлорпропокси)-3,4-дигидрокарбостирила, 1,5 r триэтиламина и 2,0 r 4-бензилпиперидина
56 смешивают с 30 мл диметилформамида и смесь перемешивают при 80-90 С 5 ч.
Реакционную смесь выливают в 80 мл
5%-ного водного раствора бикарбоната натрия и экстрагируют хлороформом, 55 промывают водой, сушат. Затем хлороформ удаляют дистилляцией и полу ченный остаток растворяют в 30 мл ацетона и добавляют 57-ный раствор щавелевой кислоты в ацетоне до рН
4,5. Образующиеся кристаллы отделяют фильтрацией и промывают ацетоном. Перекристаллизацией из этанола получают 4,3 г (выход 827.) монооксалата
1-аллил-5-(2-окси-3-(4-бензил-1-пиперидил)пропокси1-3,4-дигидрокарбостирола в виде бесцветных игольчатых о кристаллов. Т.пл. 178-180 С.
Способам, аналогичным описанному в примере 25, получают соединения примеров 26-36.
Пример 26. Монооксалат 1-бензил-4-(2-окси-3-(4-бензил-1-пиперидил)пропокси )-3,4 — дигидрокарбости— рила.
Бесцветный кристаллический порошок (из этанола-эфира). Т.пл. 213214 С (с разл.).
П р и и е р 27. Монооксалат-1этил-5-(2-окси-3-(4-бензил-1-пиперидил)-пропок и )-3,4-дигидрокарбостирила.
Бесцветные игловидные кристаллы (из этанола). Т.пл. 164-169 C.
Пример 28. 8-Бром-5-(2-окси3-(4-бензил-1-пиперидил)пропокси-3,4дигидрокарбостирил.
Бесцветные игловидные кристаллы
C (из этанола) . Т. пл. 165-166 С.
Пример 29. 5-(2-Окси-3-(4фенил-1-пиперидил)пропокси)-3,4-дигидрокарбостирил.
Бесцветные игловидные кристаллы (из этанола). Т.пл. 207-208 С.
Пример 30. 6 †-Окси-3-(4-фенил-1-пиперидил)пропокси)-3,4-дигидрокарбостирил.
Бесцветные пластинчатые кристаллы (из этанола). Т.пл. 170-171 С.
Пример 31. 7 — (2-Окси-3-(4 †фенил-1-пиперидил)пропокси-3,4-дигидрокарбостирил.
Бесцветные игловидные кристаллы (из изопропанола). Т.пл. 149-150 С.
Пример 32. 1-Аллил — 5-(2-окси3-(4-фенил-1-пиперидил)пропокси)-3,4дигидрокарбостирил.
Бесцветные игловидные кристаллы ,(из лигроина). Т.пл. 92 С.
Пример 33. Монооксалат 1-аллил-5-(2-окси-3-(4-фенил-1-пиперидил)-пропокси)3,4-дигидрокарбостирила „
Желтоватые игловидные кристаллы (из метанола). Т.пл. 208 С(с разл.) о
1091857
Пример 34. Монооксалат 1-метил-5-(2-окси-3-(4-бензил-1-пиперидил)пропокси)-3,4-дигидрокарбостирила.
Бесцветный порошок (из смеси эта- 5 иола и простого эфира).Т.пл. 150152 С.
Пример 35. 1-Бензил-5-(2-окси-3-(4-бензил-1-пиперидил)пропокси)-3,4-дигидрокарбостирил.
Бесцветные игловидные кристаллы (из этанола . Т.пл. 141 †1 С.
Пример 36. Монооксалат 1-изопентил-6-12-окси-3-(4-(3,4,5-триметоксифенил)-1-пиперидил1пропокси )3,4-дигидрокарбостирила.
Бесцветные хлопьевидные кристаллы (из этанола). Т.пл. 199-201 С.
Пример 37. 2,4 г 7-окси-4фенилкарбостирила и 0,8 г гидроокиси калия смешивают с 60 мл метанола и концентрируют досуха при пониженном давлении. К полученному остатку добавляют 60 мл диметилформамида и тщательно перемешивают, затем к смеси добавляют 5 r 1-(3-хлорпропил)-4фенилпиперидина и смесь нагревают при 70-80 С при перемешивании в тео чение 8 ч. Реакционную смесь концентрируют при пониженном давлении до- 30 суха и к полученному остатку добавляют 60 мл 57-ного водного раствора бикарбоната натрия и экстрагируют хлороформом. Хлороформный слой промывают водой, сушат и удаляют хлороформ дистилляцией. Полученный остаток добавляют к 30 мл метанола и
5 мл концентрированной соляной кислоты и концентрируют при пониженном давлении. Остаток кристаллизуют из 40 этанола и перекристаллизовывают из метанола, получают 2,8 г (587. выход) 4-фенил-7-(3-(4-фенил-1-пиперидил)пропокси)карбостирила моногидрохлорида в форме бесцветных иг- 4 о ловидных кристаллов. Т. пл. 238-241 С.
Способом, аналогичным описанному в примере 55, получают соединения примеров 49-69.
Пример 38. Монооксалат 1-ме- gp тил-7-(3-(4-бензил-1-пиперидил)пропокси1-3,4-дигидрокарбостирила.
Бесцветное порошкообразное вещество (из смеси этанола и простого эфира). Т. пл. 175-177 С.
Пример 39. Моногидрохлорид
1-пропаргил-5-(3-(4-бензил-1-пиперидил)пропокси )-3,4-дигидрокарбостирила моногидрат
Бесцветные игловидные кристаллы (из смеси метанола и простого эфира). Т.пл. 172 С (с разл.).
Пример 40. Моногидрохлорид
1-метил-5-(3-(4-бензил-1-пиперидил) пропокси)-3,4-дигидрокарбостирила.
Бесцветные игловидные кристаллы (из смеси этанола и простого эфира).
Т.пл. 130-133 С.
Пример 41. Монооксалат 1-гексил-7-(3-(4-фенил-1-пиперидил)пропокси)-3,4-дигидрокарбостирила.
Бесцветные игловидные кристаллы о (из изопропанола). Т.пл.,168-170 С.
Пример 42. Монооксалат 1-(3фенилпропил) -7-(3-(4-фенил-1-пиперидил)пропокси)-3,4-дигидрокарбостирила.
Бесцветные игловидные кристаллы (из смеси метанола и воды).Т.пл.210213 С.
Пример 43. Монооксалат 1-аллил-5-(2-окси-(4-бензил-1-пиперидил) пропокси)-3,4-дигидрокарбостирила.
Бесцветные игловидные кристаллы (из этанола). Т.пл. 178-180 С.
Пример 44. Монооксалат 1-метил-4-(2-окси-3-(4-бензил-1-пиперидил)пропокси)-3,4-дигидрокарбостирила.
Бесцветные кристаллы (из этанола и эфира). Т.пл. 150-152 С.
Пример 45. 1-Бензил-5-(2окси-3-(4-бензил-1-пиперидил)пропокси)3,4-дигидрокарбостирил.
Бесцветные игловидные кристаллы (из этанола). Т.пл. 141-143 С.
Пример 46. Моногидрохлорид
5-(3-(4-бензил-1-пиперидил)пропокси)3,4-дигидрокарбостирила.
Бесцветные игловидные кристаллы (из метанола). Т.пл. 213 †2 С.
Пример 47. Монооксалат 5-(3(4-бензил-1-пиперидил)пропокси)-3,4дигидрокарбостирила.
Бесцветные игловидные кристаллы (из смеси лигроина и бензола).
Т. пл. 143-145 С (с разл.).
Пример 48. Монооксалат 7-(3(4-бензил-i-пиперидил)пропокси)-3,4дигидрокарбостирила.
Бесцветные призмовидные кристаллы (из этанола). Т.пл..175-177 С.
Пример 49. 1-Аллил-5-(2-окси3-(4-фенил-1-пиперидил) пропокси)-3,4дигидрокарбостирил.
18
1091857
Бесцветные игловидные кристаллы (из лигроина). Т.пл. 92 С.
Пример 50. Монооксалат 1аллил-4-(2-окси-3-(4-фенил-1-пиперидил)пропокси 3-3,4-дигидрокарбости- 5 рила.
Желтоватые игловидные кристаллы о,, (из метанола).Т.пл.208 С;с раэл.).
Пример 51. 4Метил 6 — (3-(4 — )0 бензил-1-пиперидил)пропокси)карбостирил.
Желто-бурые призмовидные кристаллы (из метанола). Т.пл. 177-178 С.
Пример 52. Моногидрохлорид
4-метил-6 †-(4-бензил-1-пиперидил) пропокси1карбостирила.
Бесцветный кристаллический порошок (из смеси этанола, ацетона и простого эфира). Т.пл. 217 С.
Пример 53. Моногидрохлорид
7-(3-(4-фенил-1-пиперидил)пропокси 3,4-дигидрокарбостирила.
Желтоватые игловидные кристаллы (из этанола). Т.пл. 252-254 С.
Пример 54. Моногидрохлорид
4-метид-7-f-3-(4-бенэил-1-пиперидил) пропокси3 карбостирила дигидрат.
Бесцветные игловидные кристаллы (из этанола). Т.пл. 241-242 С.
Пример 55. Моногидрохлорид
5-(3-(4-фенил-1-пиперидил)пропокси ) карбостирила.
Бесцветные игловидные кристаллы (из метанола). Т.пл. 200 С.
Пример 56. Моногидрохлорид
4-метил-6-(3- (4-(4-метилфенил)-1-пиперидил)пропокси карбостирила.
Бесцветные игловидные кристаллы а (из метанола) . Т. пл. 256-259 (с разл.) ..
Пример 57. Моногидрохлорид
4-метил-6-f3- 4-(4-хлорфенил)-1-пиперидил)пропокси карбостирила.
Бесцветные игловидные кристаллы (из метанола). Т.пл. 263-265 С.
О
Пример 58. Монооксалат 1изопентил-6-(2-окси-3-(4-(3,4,5-триметоксифенил)-1-пиперидил)пропокси—
3,4-дигидрокарбостирила.
Бесцветные хлопьевидные кристаллы (из этанола). Т.пл. 199-201 С.
Пример 59. 2,4 г 6,8-дихлор5-.окси-3,4-дигидрокарбостирила и
0,8 r гранулированного гидрата окиси
55 калия смешивают с 60 мл метанола и концентрируют при пониженном давле нии досуха. Полученный остаток добавляют к 60 мл диметилформамида и тщательно перемешивают, затем добавляют 5 г 1-хлор-2-метил-3-(4-фенилпиперидил)пропана и нагревают
o., при 70-80 С в течение 8 ч при перемешивании. Реакционную смесь концен— трируют при пониженном давлении досуха, затем добавляют 60 мл 5X — наго водного раствора бикарбоната натрия и экстрагируют хлороформом. Хлороформный слой промывают водой и сушат, затем хлороформ удаляют дистилляцией и полученный при этом остаток очищают хроматографией на колонке силикагеля, перекристаллизовывают из лигроина и получают 1,6 г (выход 352) 6,8-дихлор-5-(2-метил-3(4-фенил — 1-пиперидил)пропокси) — 3,4— дигидрокарбостирила в виде игловидных бесцветных кристаллов. Т.пл,125126 С.
Методом, аналогичным описанному в примере 7, получают следующие соединения примеров 60-64, Пример 60. 5-(3-(4-Бензил1-пиперидил)пропокси )-3,4-дигидрокарбостирил.
Бесцветные игловидные кристаллы (из этанола). Т.пл. 143-145 С. о
Пример 61. 7-(5-(4-Бензил1-пиперидил)пентокси)-3,4-дигидрокарбостирил.
Бесцветные пластинчатые кристало лы (из лигроина) . Т. пл. 100-102 С.
Пример 62. 4-Метил-6-(3-(4бензил-1-пиперидил)пропокси)карбостирил.
Желтоватые призмовидные кристаллы (из метанола). Т.пл. 177-178 С.
Пример 63. 4-Метил-7- (3-(4бензил-1-пиперидил)пропокси)карбостирил.
Бесцветные игловидные кристаллы о (из метанола). Т.пл. 183-184 С.
Пример 64. 8-Бром-5-f2-окси3-(4-бензил-1-пиперидил)пропокси)3,4;дигидрокарбостирил.
Бесцветные игольчатые кристаллы о (из этанола) . Т.пл. 165-166 С.
Пример 65. 2,0 г 5-(2-окси3-(4-фенил-i-пиперидил)пропокси)3,4-дигидрокарбостирила и 3 r иодистого метила смешивают с 30 мл диметилформамида и перемешивают при 5060 С 5 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток добавляют к 50 мл ацетона и перемешивают. Образовавшийся осадок собирают фильтрацией, 1091857
19
20 промывают ацетоном и перекристаллизовывают из смеси метанола и этанола.
Получают 1,7 r иодистого 4-фенил1-(2-окси-3-(2-оксо-1,2,3,4-тетрагидрохинолин-5-илокси)пропил) — 1-ме- 5 тилпиперидиния в виде бесцветного порошка. Т.пл. 242-43 С.
Методом, аналогичным описанному в примере 65, получают следующие соединения примеров 66 и 67.
1О
Пример 66. Иодистый 4-фенил1-(2-окси-3-(1-аллил-2-оксо-1,2,3,4тетрагидрохинолин-5-илокси)пропил)1-метилпиперидиний.
Бесцветные игловидные кристаллы (из смеси изопропанола и ацетона).
Т.пл. 179-180 С.
Пример 67. Иодистый 4-бензил1- 2-окси-3-(1-бензил-2-оксо-1 2 3 430 тетрагидрохинолин-6-илокси)пропил)1-метилпиперидиний.
Желтоватые кристаллы в виде иголок (из смеси этанола и простого эфира).
Т.пл. 135 †1 С.
Пример 68. 2,0 г иодистого
4-фенил-1-(2-оксо-1,2,3,4-тетрагидрохинолин-7-илокси)пропил)-1-метилпиперидиния полугидрата растворяют в 1п
150 мл метанола и 100 мл воды, затем
3, 0 г хлористого серебра добавляют в раствор и перемешивают в темноте в холодильнике 24 ч.Реакционную смесь фильчруют и полученный таким образом маточ35 ный раствор концентрируют при пониженном давлении досуха. Остаток перекристаллизовывают из смеси изопропанола, ацетона и простого эфира и получают 1,0 г хлористого 4-фенил-1- 40 (3-(2-оксо-1,2,3,4-тетрагидрохинолин-7-илокси)пропил)-1-метилпиперидиния полугидрата в виде бесцветного кристаллического порошка. Т.пл.211213 С. Пример 69. 2,4 г 7-(3-хлорпропокси)-3,4 дигидрокарбостирила и
4,0 г 4-окси-4-фенилпиперидина смешивают со 15Q мл толуола и кипятят в течение 24 ч с обратным холодильни50 ком. После охлаждения реакционной смеси образовавшийся осадок собирают фильтрацией и промывают водой, затем перекристаллизовывают из этанола. Получают 2,8. г 7-(3-(4-окси-4-фенилпи5S перидил) пропокси)-3, 4-гидрокарбостирила в форме бесцветных хлопьевидных о кристаллов. Т.пл. 215 С.
Способом, аналогичным описанному в примере 69, получают соединения примеров 70-77.
Пример 70. 5-(3-(4-Окси-4фенил-1-пиперидил)пропокси1-3,4-дигидрокарбостирил.
Бесцветные игловиднце кристаллы (из метанола). Т.пл. 265-266 С.
Пример 71. 7- (3-(4-Окси-4-(4хлорфенил)-1-пиперидил)пропокси)-3,4дигидрокарбостирил.
Бесцветные игловидные кристаллы (из этанола). Т.пл. 189-190 С.
Пример 72. 5-(3-(4-Ацетил-4фенил-1-пиперидил)пропокси)-3,4-дигидрокарбостирил.
Светло-желтоватые призмовидные кристаллы (из этанола). Т.пл. 165 С.
Пример 73. 7-(3-(4-Ацетил-4фенил-1-пиперидил)пропокси)-3,4-дигидрокарбостирил.
Бесцветные игловидные кристаллы (из изопропанола) . Т.пл. 159-160 С.
Пример 74. 6-(2-(4-Ацетил-4фенил-1-пиперидил)этокси)карбостирил.
Бесцветные игловидные криста. лы (из этанола). Т.пл. 158-160 С.
П р и м e p 75. 7-13-(4-Окси-4-(4метилфенил)-1-пиперидил)пропокси)-3,4дигидрокарбостирил.
Бесцветные хлопьевидные кристаллы (из этанола). Т. пл. 188-189 С.
Пример 76. Моногидрохлорид
7-(3-(4-Окси-4-(2-метоксифенил)-1пиперидил-пропокси -3,4-дигидрокарбостирила.
Бесцветный кристаллический порошок (из смеси метанола и воды).
Т.пл. 239-241 С.
Пример 77. 4-Метил-(3-Г4-(4ацетил-4-фенил)-1-пиперидил)пропокси)юарбостирил.
Светло-желтоватые игловидные кристаллы (из метанола). Т.пл. 212-213 С. о
Пример 78. 1,43 r 1-метил6-(2-бромэтокси)-3,4-дигидрокарбостирила, 1,3 r 4-ацетил-4-фенилпиперидина и 1,0 г триэтиламина смешивают с 30 мл диметилформамида и о смесь нагревают при 60-70 С 6 ч. Полученную реакционную смесь концентрируют при пониженном давлении досуха и к остатку добавляют 57-ный водный раствор бикарбоната натрия и перемешивают. Твердое вещество собирают фильтрацией, промывают водой, сушат и перекристаллизовывают из смеси этанола с водой. Получают 1,3 r 11091857
22 дигидрокарбостирил.
ВНИКНИ, Заказ 3108/56 Тираж 410 Подписное
Филиал ППП "Патеит", r, Ужгород, уп.Проектная,4 метил-6-(2-(4-ацетил-»-фенил-1-пиперидил)этокси)-3,4-дигидрокарбостирила в форме бесцветных призмовидных кристаллов. Т.пл. 101-103оС.
Методом, аналогичным описанному в примере 78, получают соединения примеров 79-81.
H p и м е р 79. 1-Метил †-(3-(4ацетил-4-фенил-1-пиперидил)пропокси—
3,4-дигидрокарбостирил.
Бесцветные игловидные кристаллы (из лигроина). Т.пл. 103-105 С..
Пример 80. 1-Метил-6-