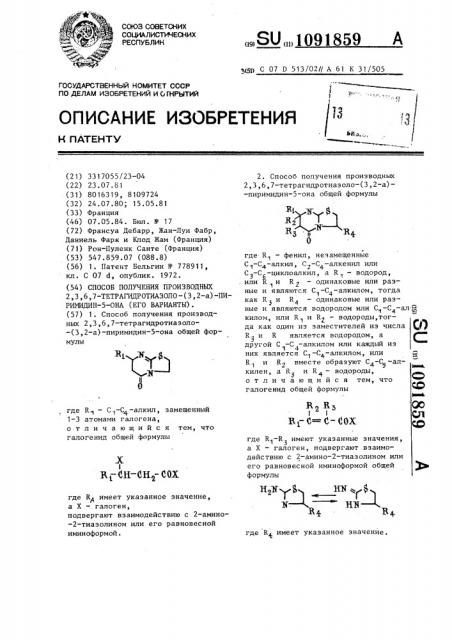
Способ получения производных 2,3,6,7-тетрагидротиазоло/3,2- а/пиримидин-5-она (его варианты)
Иллюстрации
Показать всеРеферат
1. Способ получения производных 2,3,6,7-тeтpaгидpoтиaзoлo-
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И 0ГКРЫТИЙ
ОПИСАНИЕ ИЗОбРЕТЕНИЯ
Н ПАТЕНТУ
Эйли.:,, л, Г
Х
I в; Сн-Сн; еох (21) 3317055/23-04 (22) 23.07.81 (31) 8016319, 8109724 (32) 24.07.80, 15.05.81 (33) Франция (46) 07.05.84. Бюл. Ф 17 (72) Франсуа Дебарр, Жан-Луи Фабр, Даниель Фарж и Клод Жам (Франция) (71) Рон-Пуленк Санте (Франция) (53) 547.859.07 (088.8) (56) 1. Патент Бельгии N- 778911, кл. С 07 d, опублик. 1972. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
2,3,6,7-ТЕТРАГИДРОТИАЗОЛО-(3,2-а)-ПИРИМИДИН-5-ОНА (ЕГО ВАРИАНТЫ). (57) 1. Способ получения производных 2,3,6,7-тетрагидротиаэоло-(3,2-а)-пиримидин-5-она общей формулы где R — С „-С, -алкил, замещенный
1-3 атомами галогена, отличающийся тем, что галогенид общей формулы где R> имеет указанное значение, а Х вЂ” галоген, подвергают взаимодействию с 2-амино-2-тиазолином или его равновесной иминоформой.
„„80„„1091859 A (51) С 07 D 513/02// А 61 К 31/505
2. Способ получения производных
2,3,6,7-тетрагидротиазоло-(3,2-а)-пиримидин-5-она общей формулы где. К1 — фенил, нез амещенные
С1-С4-алкил, С2 С4
С -С -циклоалкил, à R 1 — водород, или R u R — одинаковые или раз1 2 ные и являются С„-С -алкилом, тогда как К и R — одинаковые или раэ4 ные H являются водородом HJIH С„-С4 — BJI g килом, или R1 и R2 - водороды,тогда как один иэ заместителей из числа Q)
R3 и R является водородом, а другой С вЂ” С -алкилом или каждый иэ
1 4них является С„ -С -алкилом, или
R1 и R2 вместе образуют С4-С -алЬаеей килен, а R и R+ — водороды, Ю отличающийся тем, что галогенид общей формулы О
Фее
I О в; с= е- сох CO где R1-R> имеют укаэанные значения, а X — - галоген, подвергают взаимодействию с 2-амино-2-тиаэолином или его равновесной иминоформой общей формулы
IIyIIyEq НМ Г$ х — А нж- .
Rq Rg где К имеет указанное значение.
1091859
Изобретение относится к новому способу получения неописанных производных 2,3,6,7-тетрагидротиазоло-(3,2-а)-пиримидин-5-она, которые обладают ценными фармакологическими свойствами и могут найти применение в медицине.
Известна реакция циклоприсоединения производных пировиноградной кислоты и.2-амино-2-тиазолина с образо- 10 ванием производных 2,3-дигидротиазоло-(3,2-а)-пиримидин-5-она 1 1 .
Известным способом возможно получение только дигидропроизводных тиазоло-(3,2-а)-пиримидин-5-она. ) 5
Цель изобретения — новый способ получения неописанных производных
2,3,6,7-тетрагидротиазоло-(3,2-а)—
-пиримидин-5-она, обладающих ценными фармакологическими свойствами. РО
Поставленная цель достигается способом получения производных 2,3,6,7-тетрагидротиазоло-(3,2-а) -пиримидин-5-она общей формулы I
30 де — фенил,, незамещенные С„-С -алкил С -С -алкенил или С вЂ” С -циклоZ 3 6
R2 водород или R H RZ одинаковые или разные и являются
35 1-С4- о, тогда как К и К4— одинаковые или разные и являются водородом или С -С -алкилом, или
К 1 и R — водороды, тогда как один из заместителей из числа RЭ и R щ является водородом, а другой
С -С, -алкилом или каждый из них з является С,-С -алкилом, или К и
Вi-Сн СН2 Сох
3. Способ получения 7-фенил-2,3,6,7-тетрагидротиазоло-(3,2 — а)—
-пиримидин-5-она, о т л и ч а юшийся тем, что (С„-С+) -алкиловый эфир коричной кислоты подвергают взаимодействию с 2-амина-2-тиазолином или его равновесной иминоформой. где R — С -С -алкил замещенный
1 1 4
Э
1-3 атомами галогена, заключающимся .в том, что галогенид общей формулы II где R1 имеет укаэанное значение, а
Х вЂ” галоген, подвергают взаимодействию с 2-аиино-2-тиазолином или его равновесной иминоформой, Приоритет по признакам:
24.07.80 при R — фенил, незамекенный С,-С+-алкил, R>-R4 — водороды.
15.05.81 при R . — С„-С4-алкил, замещенный 1-3 атомами галогена, С2 — С -алкенил, Сз-С -циклоалкил, R — С,-С -алкил или R и R вместе образуют С;С вЂ”.алкилен, R, и R„- С;С .-алкил.
Обычно реакцию проводят в органическом ароматическом растворителе (например, в бензоле, толуоле,ксилолах), хлорсодержащем растворителе (например, хлороформе, четыреххлористом углероде, 1,2-дихлорэтане), простом эфире (например, диоксане, тетрагидрофуране) или диметилформамиде при температуре от 20 С до температуры кипения смеси в присутствии акцептора кислоты, неорга— нического основания (например, бикарбоната щепочного металла) или органического основания (например, триэтиламина).
Галогениды общей формулы II могут быть получены, например, действием галогенирующего агента, например тионилхлорида, на соответствующую р --оксикислоту.
Другой вариант способа получения производных 2,3,6,7-тетрагидротиазоло-(3,2-а)-пиримидин-5-она общей формулы
1091
Rz вместе образуют С -С -алкилен, а R> и R — водороды, заключается в том, что галогенид общей формулы II де R R> имеют указанные значения, а Х вЂ” галоген, подвергают взаимодействию с 2-амино-2-тиазолином или его равновесной иминоформой общей формулы III где К имеет указанное значение. 20
Обычно реакцию проводят в органическом ароматическом растворителе (например, бензоле, толуоле, ксилолах), хлорсодержащем растворителе (например, хлороформе, тетрахлориде углерода, 1,2-дихлорэтане), простом эфире (например, диоксане, тетрагидрофуране) или диметилформамиде при температуре от 20 С до темперао туры кипения реакционной смеси в 30 присутствии акцептора кислоты, например неорганического основания (бикарбоната щелочного металла) или органического основания (триэтиламин).
Хлорангидриды общей формулы II могут быть получены из соответствующих кислот известными способами.
Третий вариант способа предусматривает получение 7-фенил-2,3,б,7-тетрагидротиазоло-(3,2-а)-пирими- 40 дин-5-она взаимодействием (С -С )1 4
-алкилового эфира коричной кислоты с 2-амико-2-тиазолином или его равновесной иминоформой.
Обычно реакцию ведут без раство- 4 рителя или в органическом ароматическом растворителе, например бензоле, толуоле или ксилолах,при температуре от 50 С до температуры кипения реакционной смеси в присутствии 0 антиоксиданта, например гидрохинона.
Соединения общей формулы I могут быть очищены обычными способами, например кристаллизацией и хроматог- 5 рафией.
Соединения общей формулы I проявляют ценные фармакологические свой859 ства, которые позволяют использовать их при лечении ревматических заболеваний, а также в качестве антиаллергических средств. Кроме того, они обладают анальгетическими свойствами.
Соединения I активны в дозах
10-100 мг/кг у крыс при оральном введении при лечении эдемы, вызванной подкожным введением 50 мкг антиальбуминной кроличьей сыворотки в лапу крыс с последующим немедленным внутривенным введением альбумина.
Соединения активны также у крысы при суточных дозах 5-100 мг/кг при оральном введении в течение 7 сут по отношению к эдеме лапы, вызванной подкожным введением Bordelella
pertussis (HemophiIus pertussis) крысе, сенсибилизированной к этому антигену.
Некоторые из соединений I проявляют активность при суточных дозах
20-80 мг/кг в течение 18 сут при оральном введении при лечении экспериментального полиартрита крысы, вызванного подкожным введением в заднюю лапу.
Анальгетическая активность проявляется у мышей при дозах 1-100 мг/кг при оральном введении.
Соединения по изобретению обладают слабой токсичностью. При оральном введении мышам ЕВ составляет
300-900 мг/кг.
Пример 1. Раствор 3,33 r циннамоилхлорида в 1,7 мл хлороформа добавляют по каплям в течение 3 мин при . 20 С к раствору 2,04 г 2-амио но-2-тиазолина и 2,8 мл тризтиламина в 7,2 мл хлороформа. Затем реакционную смесь, температура которой достигает к этому времени
30 С, кипятят с обратным холодильником в течение 1 ч 40 мин, охлаждают до 4 С в ледяной бане. Образующиеся кристаллы отделяют фильтрованием, промывают два раза 5 мп (общее количество) хлороформа и отбрасывают. Органические фильтраты соединяют и йромывают два раза 5 мп (общее количество) дистиллированной воды, сушат безводным сульфатом натрия, к которому добавлено 0,2 r древесного угля, фильтруют и упаривают до объема 9 мл. Концентрат хроматографируют на колонке диаметром
1,5 см, содержащей 28 r нейтрального глинозема (0,12-0,.15 1 м). Элюируют
1091859
55 смесью хлороформ/циклогексан (40/60 о объ му), собирая фракции по 50 мл.Четыре первые фракции соединяют и упаривают досуха при пониженном, авлении (20 мм рт.ст., 2,7 кПа) и 40 С, получают 1,1 r неочищенного продукта, который растворяют в 1,35 мл кигящего этанола. При охлаждении при 4 С в течео ние 1 ч образуются кристаллы, которые отделяют фильтрованием, промывают два раза 0,4 мл (общее количество) охлажденного до 5 С этанола и сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа) и
20 С в присутствии таблетировано ного едкого кали. Получают 0,6 г
5-оксо-7-фенил-2,3,6,7-тетрагидро-5H-тиазол-(3,2-а)-пиримидина в виде твердого вещества белого цвета с т.пл. 115 С.
Пример 2. Смесь 299,5 r этилциннамата, 173,4 г 2-амино-2-тиазолина и 2 г гидрохинона нагре0 вают при 110 С в течение 24 ч.После о охлаждения до 20 С добавляют
800 мл метиленхлорида и экстрагируют пять раз 2500 мл (общее количество) 2 н. соляной кислоты, объединенные солянокислые экстракты доводят до рН 8 путем добавления
10 н. водного раствора едкого натра, затем экстрагируют четыре раза по
2000 мл (общее количество) метиленхлорида. Органические экстракты объединяют, сушат безводным сульфатом натрия, фильтруют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С.
Полученный остаток (113 r) хрома;, тографируют на колонке диаметром
7,5 см, содержащей }100 г кремнезема (0,06-0,2 мм) . Элюируют метиленхлоридом, собирая фракции 1000 мл.
Первые две фракции отбрасывают, а сс едующие 14 фракций соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и
40 С. Получают 26 г неочищенного продукта, который растворяют в 75 мл кипящего этанола, к которому добавляют 1 г древесного угля. После горячего фильтрования фильтрат охлаждают при 4 С в течение 12 ч. Образовавшиеся кристаллы отделяют фильтрованием, промывают два раза 20 мл (общее количество) этанола, охлаждают до 5 C и сушат при понижен5
1О
4О
45 ном давлении (20 мм рт.ст., 2,7 кПа) и 20 С в присутствии таблеток едкого кали. Таким образом получают 21,6 г
5-оксо-7-фенил-2,3,6,7-тетрагидро-5H-тиазол-(3,2-а)-пиримидина в вио де белых кристаллов с т.пл. 113 С.
Пример 3. Раствор 440 r кротоноилхлорида в 1200 мл хлороформа добавляют по каплям в течение
47 мин к раствору 504 r 2-амино-2-тиазолина и 590 мл триэтиламина в
1200 мп хлороформа. Реакционную смесь, температура которой достигает к этому времени 63 С, кипятят а с обратным холодильником в течение
16 ч. После охлаждения до 20 С о образовавшиеся кристаллы отделяют фг- ьтрованием, промывают два раза
100 мл (общее количество) хлороформа и отбрасывают. Органические фильтраты соединяют, упаривают досуха при пониженном давлении (20 мм рт.ст., о
2,7 кПа) и 40 С и остаток растворяют в 700 мл этилацетата. Образовавшиеся кристаллы отделяют фильтрованием, промывают 200 мл смеси этилацетата и метанола (90:10 по объему) и отбрасывают. Органические фильтраты соединяют и хроматографируют на колонке диаметром 9 см, содержащей 3,5 кг силикагеля (0,06-0,2 мм), элюируя этилацетатом и собирая фракции
1000 мл. Пять первых фракций отбрасывают,шесть следующих фракций соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С. Получают 124 r о неочищенного продукта с т.пл. 91 С, который разделяют на три равные части каждую часть хроматографируют на колонке диаметром 6 см, содержащей 480 г силикагеля (0,0400,063 мм) . Элюируют этилацеч атом при давлении 0,5 бар (51 кПа), отбирая фракции по 200 мл. Первые восемь фракций отбрасывают, следующие десять фракций соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст.„ 2,7 кПа) и 40 С.Поо лучают 109 г продукта в виде белых о кристаллов с т.пл. 93 С, которые растворяют в 160 мл кипящего зтилацетата с добавлением 1 г древесного угля. После горячего фильтрования фильтрат охлаждают до 4 С в тео чение 2 ч, образовавшиеся кристаллы отделяют фильтрованием, промывают три раза 100 мл (общее количество) 40
10О18 охлажденного до -5 С диизопропилового эфира и сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа) и о
20 С в присутствии таблеток едкого кали. Получают 96,8 г 7-метил- 5
-5-оксо-2,3,6,7- .трагидро-5Н-тиазол-(3,2-а)-пиримицина в виде белых о, кристаллов с т.пл. 96 С.
Пример 4. Раствор 50 г
2-пентеноилхлорида в 300 мл хлороформа добавляют по каплям в течение
30 мин к раствору 50,6 г 2-амино-2-тиазолина и 59 мл триэтиламина в
350 мл хлороформа. Реакционную смесь, температура которой достигает 49 С, кипятят с обратным хояодильником в течение 16 ч. После охлаждения до 20 С образовавшиеся кристаллы отделяют фильтрованием и отбрасывают. Органический фильтрат 20 упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и
40 С, затем растворяют в 250 мл ацетона. Образовавшиеся кристаллы отделяют фи ьтрованием, промывают два раза 60 мл (общее количество) ацетона и отбрасывают. Органические фильтраты упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С и хроматографируют 30 о на колонке диаметром 7 см, содержащей 820 г силикагеля (0,06-0,2 мм) элюируя этилацетатом и собирая фракции по 1000 мл. Первую фракцию отбрасывают, следующие четыре соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С. Получают 31 r неочищенного продукта в виде масла, его добавляют к 6 г продукта, полученного таким же способом при другой операции, и хроматографируют на колонке диаметром 6 см, содержащей
480 r силикагеля (0,040-0,063 мм).
Элюируют смесью этилацетат/циклогек- 4 сан (70/30 по объему) при давлении 0,5 бар (51 кПа), собирая фракции по 200 мл. Шесть первых фракций отбрасывают, шесть cs.åäóþùèõ соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С. Получают 21,7 г продукта, который растворяют в 50 мл кипящего ацетона с добавкой 0,2 г древес ного угля . После горячего фильтрования фильтрат охлаждают до 4 С о в течение 1,5 ч, образовавшиеся кристаллы отделяют фильтрованием, промывают два раза 20 мл (общее количество) охлажденного до "5 С ацетона и сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа) и о
20 С в присутствии таблеток едкого кали. Получают 18,6 г 7-этил-5-оксо-2,3,6,7-тетрагидро-5Н-тиазолвЂ(3,2-а)-пиримидина в виде белых о кристаллов с т.пл. 60 С.
Пример 5. Раствор 35,5 г
4-метил-2-пентеноилхлорида в 200 мп хлороформа добавляют по каплям в течение 20 мин к раствору 32,2 г
2-амина-2-тиазолина и 37,7 мл триэтиламина в 200 мл хлороформа.
Реакционную смесь, температура коо торой достигает к этому времени 53 С, кипятят с обратным холодильником в течение 16 ч. После охлаждения до
20 С образовавшиеся кристаллы ото деляют фильтрованием и отбрасывают.
Органический фильтрат упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С, а остаток растворяют в 200 мл ацетона.
Образовавшиеся кристаллы отделяют фильтрованием, промывают два раза
60 мл (общее количество) диизопропилового эфира и отбрасывают. Органические фильтраты выпаривают досуха при пониженном давлении (20 мм рт.ст., 2,6 кПа) и 40 С и хроматографируют на колонке диаметром 4 см, содержащей 550 r нейтрального глинозема (0,12-0,15 мм). Элюируют этилацетатом, собирая фракции по
500 мп. Первую фракцию отбрасывают, две следующие соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С. Получают 25 r неочищенного продукта в виде масла, его снова хроматографируют на колонке диаметром 6 см, содержащей 480 г силикагеля (0,0400,063 мм) . Элюируют смесью этилацетат/циклогексан (60/40 по объему) при давлении 0,5 бар (51 кПа), собирая фракции по 250 мл. Семь первых фракций отбрасывают, девять следующих соединяют и упаривают досуха при пониженном давлении о (20 мм рт.ст., 2,7 кПа) и 40 С. Получают 15 r продукта, который растворяют в 50 мл кипящего ацетона с добавлением 0,2 г древесного угля.
После горячего фильтрования фильто рат охлаждают при 4 С в течение
1 ч, образовавшиеся KpHc TBJQlbl от10
1091859
Фракция 1 Чистый циклогексан
2 Чистый циклогексан
3 и 4 Циклогексан/хлороформ: 90/10 по объему
5 и 6 Циклогексан/хлороформ: 80/20 по объему
7 и 8 Циклогексан/хлороформ: 70/30 rio объему деляют фильтрованием, промыьают два раза 20 ьл (общее количество) охлажденного до 5 С диизопропио лового эфира и сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 20 С в присутствии таблеток о едкого кали. Получают 11,8 r 7-изопропил-5-оксо-2,3,6,7-тетрагидро-5H-тиазол-(3,2-а)-пиримидина в виде о белых кристаллов с т.пл. 50,6 С.
Пример 6. Раствор 79,5 r . 2-гексеноилхлорида в 750 мл хлороформа добавляют по каплям в течение
75 мин к раствору 61,2 г 2-амино-2-тиазолина и 84.,2 мл триэтиламина в 600 мл хлороформа. Реакционную смесь, температура которой достигает к этому времени 40 С, кипятят с обратным холодильником в течение
45 мин, затем после охлаждения до о
20 С промывают четыре раза 1200 мл (общее количество) дистиллированной воды, органическую фазу сушат безводным сульфатом магния, к которому добавлено 10 г древесного угля, фильтруют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2.6 кПа) и 40 С. Получают маслянистый остаток (110 r), который хроматографируют по колонке диаметром
Фракцию 1 отбрасывают, 2-8 соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПЬ) и 40 С. Получают 4,3 г продукта, который растворяют в 20 мл кипящего петролейного эфира (т.кип. 40-65 С). о
После охлаждения при 4 С в течение
16 ч образовавшиеся кристаллы отдеО ляют фильтрованием, промывают 5 мл охлажденного до 5 С петролейного о эфира (т.кип. 40-65 С) и сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 20 С в присутствии таблеток едкого кали. Получают 2,5 г
5-оксо-7-пропил-2,3,6,7-тетрагидро-5H-тиазол-(3 2-а)-пиримидина в виде
У
Q белых кристаллов с т.пл. 47 С.
Пример 7. Раствор 13,1 г хлористого 3-третбутилакрилоила в
60 мл хлороформа добавляют по каплям в течение 25 мин к раствору
5 !
О
5) 5 „1 см, содержащей 1, 1 кг глинозема (О, 12-0, 15 мм) . Элюируют метиленхлоридом, собирая 1000 мл элюата.
Последний упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С. Получают 25 г продукта, которыи опять хроматографируют на колонке диаметром 3,2 см, содержащей 250 г глинозема (0,120,15 MM) в присутствии циклогексана. Элюируют смесями хлороформ/циклогексан, собирая фракции по 200 мп, Три первые фракции (элюент: хлороформ/циклогексан 20/80 по объему) отбрасывают, следую.цие четыре (элюент: хлороформ/циклогексан
30/70 по объему) и три последние (.>астворитель-элювнт: хлороформ/циклогексан 40/60 по объему) соединяют и упаривают досуха при пониженном .давлении (20 мм рт.ст., 2,7 кПа) и
40 С. Получают остаток (14,7 r), который растворяют в 50 мл диэтилового эфира и фильтруют. После фильтрования раствор упаривают досуха при пониженном давлении о (20 мм рт.ст., 2,7 кПа) и 40 С и хроматографируют на колонке диаметром 2,4 см, содержащей 100 г глинозема (0,12-0,15 мм). Элюируют фракциями 100 мл в следующих условиях:
10,25 г 2-амино-2-тиазолина и 12,6 мл триэтиламина в 60 мл хлороформа.
Реакционную смесь, температура котоо рой достигает к этому времени 51 С, кипятят с обратным хс подильником в течение 16 ч. После охлаждения до .20 С образовавшиеся кристаллы отделяют фильтрованием и отбрасыва!OT. Органический фильтрат упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 35 С, затем растворяют в 100 мл ацетона. Образовавшиеся кристаллы отделяют фильтрованием, промывают два раза 50 мл (общее количество) ацетона и отбрасывают. Органические фильтраты соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,/ кПа) и 30 С. Остаток хроматограо фируют на колонке диаметром 3,5 см„ содержащей 200 г силикагеля (0,06311 1091
0,2 мм), элюируя смесью этилацетат/
/циклогексан (50/50 по объему) и собирая фракции по 50 мл. Три первые фракции отбрасывают, шесть следующих соединяют и упаривают досуха при 5 пониженном давлении (20 мм рт.ст., 2,7 кПа) и 30 С. Получают 4 r неочищенного продукта, который добавляют к 2 r продукта, полученного таким же способом при другой операции, и раст-10 воряют в 24 мл кипящего ацетона, к которому добавлено О, 1 r древесного угля. После горячего фильтрования о фильтрат охлаждают при 4 С в течение
2 ч, образовавшиеся кристаллы отде- 15 ляют фильтрованием, промывают два раза 10 мл (общее количество) охлажо денного до 5 С диизопропилового эфира и сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа)и 20 С в присутствии таблеток едкого кали.
Получают 4,3 г 7-третбутил-5-оксо-2,3,6,7-тетрагидро-5Í-тиазол-(3,2-а)-пиримидина в виде белых кристаллов с т.пл. 112 С.
Пример 8. Раствор 142,5 г
5-метил-2-гексеноилхлорида в 600 мл хлороформа добавляют по каплям в течение 35 мин к раствору 106 г 2-ами30 но-2-тиазолина и 124 мл триэтиламина в 700 мл хлороформа. Реакционную смесь, температура которой достигао ет к этому времени 63 С, кипятят с обратным холодильником в течение
16 ч. После охлаждения до - 20 С
35 образовавшиеся кристаллы отделяют фильтрованием и отбрасывают. Органический фильтрат упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 45" С,затем растворяют в 1000 мл ацетона. Образовавшиеся кристаллы отделяют фильтрованием и отбрасывают. Органический фильтрат упаривают досуха при пониженном давлении (20 мм рт.ст., 45 о
2,7 кПа) и 40 С и остаток хроматографируют на колонке диаметром
7 см, содержащей 1".50 г силикагеля (0,06-0,2 мм), элюируя этилацетатом и собирая фракции по 500 мл. Первые восемь фракций отбрасывают, следующие девять соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С. Получают
107 г неочищенного продукта, который перегоняют при пониженном давлении (0,7 мм рт.ст., 0,09 кПа) и 135142 С. Полученный продукт (33 г) 859
12 хроматографируют на колонке диаметром 6 см, содержащей 480 r силикагеля (0,040-0,063 мм). Элюируют смесью этилацетат/циклогексан (50/50 по объему) при давлении
0,5 бар (51 кПа) собирая фракции
250 мл. Первые семь фракций отбрасывают, следующие десять соединяют и упаривают досуха при пониженном давлении (1 мм рт.ст., 0,13 кПа) и о
60 С. Получают 27,8 г 7-изобутил-5-оксо-2,3,6,7-тетрагидро-5Н-тиазол-(3,2-а)-пиримидина в виде бледно-желтого масла, n37 = 1,545.
2Ъ
Пример 9. Раствор 342 г сорбоилхлорида в 1600 мл хлороформа добавляют по каплям в течение
75 мин к раствору 294 г 2-амино-2-тиазолина и 368 мл триэтиламина в 1600 мл хлороформа. Реакционную смесь, температура которой достигает о
52 С, кипятят с обратным холодильником в течение 16 ч. После охлаждения до 20 С образовавшиеся о кристаллы отделяют фильтрованием и отбрасывают. Органический филь рат упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и о
35 С, затем растворяют в 1200 мл ацетона. Образовавшиеся кристаллы опять отделяют фильтрованием и отбрасывают. Органический фильтрат упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С и остаток хроматографируют о на колонке диаметром 6,5 см, содержащей 1620 г нейтрального глинозема (0,12-0,15 мм), элюируя метиленхлоридом и собирая фракции по
300 мл. Первые две фракции отбрасывают, пять следующих соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С. Получают 56 г неочищенного о продукта в виде масла, которое снова хроматографируют на колонке диаметром 5 см с 560 г силикагеля (0,063-0,2 мм), элюируя этилацетатом и собирая фракции по 200 мл.
Первые четыре фракции отбрасывают, следующие восемь соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С. Получают 33,7 г продукта, который добавляют к 5,2 г продукта, полученного таким же способом при другой операции. После перегонки при пониженном давлении (0,8 мм рт.ст., 13
14
1091859
0,11 кПа) получают l4 8 г продукта с т.кип. 165 С. После добавления о
5 мг гидрохинона продукт перегоняют повторно при пониженном давлении (3,5 мм рт.ст., 0,47 кПа) в атмосфере азота. Получают таким образом
9,5 г 5-оксо †-(1 — пропенил)-2,3,6,7—
-тетрагидро-5Н-тиазол-(5,2-а)-пиримидина в виде бледно-желтого масла с т кип 202 C, ng = 1,581 1О
Пример 10. Раствор 24 г
3-циклопропилакрилоилхлорида в
90 мл хлороформа добавляют по каплям в течение 15 мин к раствору
2i г 2-амино-2-тиазолина и 25,9 мп триэтиламина в 90 мл хлороформа.
Реакционную смесь, температура которой достигает к этому времени
63 С, кипятят с обратным холодильником в течение 18 ч. После охлаждения до 20 С образовавшиеся кристало лы отделяют фильтрованием и отбрасывают. Органический фильтрат упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С, затем растворяют в 260 мл ацетона.
Образовавшиеся кристаллы снова отделяют фильтрованием, промывают два раза 100 мл (общее количество) ацетона и отбрасывают. Соединенные органические фильтраты выпаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 30 С и остаток хроматографируют на колонке диаметром 4,7 см с 400 г сипи- 3s кагеля (0,063-0,2 мм), элюируя смесью этилацетат/циклогексан (50/50 по объему) и собирая фракции по
300 мп. Первые восемь фракций отбрасывают, следующие пять соединяют <0 и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,6 кПа) и 40 С. Получают 6 г неочищенного продукта, который перегоняют при пониженном давлении (2,5 мм рт.ст., 0,34 кПа). Получают 4,4 г продукта с т.кип. !72 С. После добавления
15 мп диизопропилового эфира и охлаждения при 5 С образовавшиеся кристаллы отделяют фильтрованием, промы- 50 вают два раза 5 мп (общее количество) диизопропилового эфира, охлажденного до 5 С, и сушат при поо ниженном давлении (20 мм рт.ст., 2,7 кПа) и 20 С в присутствии таблеток едкого кали. Получают
3,5 r 7-циклопропил-5-оксо-2,3,6,7-"reòðагидро-5Н-тиазол-(3,2-а)-пиримилина в виде белых кристаллов с т,пл. 60 С.
Пример 11, Раствор 83,4 г
3-цикпогексипакрилоилхлорида в
340 мл хлороформа добавляют по каплям в течение 30 мин к раствору
55,4 г 2-амино — 2-тиаэолина и 68 мл триэтиламина в 340 мл хлороформа.
Реакционную смесь, температура которой достигает к этому времени
51 С, кипятят с обратным холодильником в течение 15 ч. После охлаждения до . 20 С образовавшиеся крисо таплы отделяют фильтрованием и отбрасывают. Органический фипьтрат упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 45 С, затем растворяют в 700 мл ацетона. Вновь образовавшиеся кристаллы отделяют фильтрованием и отбрасывают. Органический фильтрат упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С и остаток хроматографируют а, на колонке диаметром 6,4 см с 1 кг силикагеля (0,06-0,2 мм), элюируя этилацетатом и собирая фракции по 1000 мл. Первую фракцию отбрасывают, следующие три соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С. Получают 72 r неочищенного продукта, который снова хроматографируют на колонке диаметром 4,2 см с 610 r нейтрального глинозема (0,12-0,15 мм). Элюируют смесью хлороформ/циклогексан (50/50 по объему), собирая фракции по
250 мл. Первую фракцию отбрасывают, девять следующих соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С.
Получают 50,7 г продукта, который растворяют в 250 мл кипящего ацетона с добавлением 0,5 г древесного угля.
ПосЛе горячего фильтрования фильтрат охлаждают при 4 С в течение 3 ч,образовавшиеся кристаллы отделяют фильтрованием, промывают два раза 30 мл (общее количество) охлажденного до
5 С ацетона и сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 20 С в присутствии таблеток едкого кали. Получают 40,7 r 7-циклогексил-5-оксо-2,3,6,7-тетрагидро-5H-тиазол-(3,2-а) -пиримидина в виде белых кристаллов с т. пл.
90 С.
16
1091859
Пример 12. Раствор 72,2 г метакрилоилхлорида в 480 мп хлороформа добавляют по каплям в течение
50 мин к раствору 82,8 r 2-амино-2-тиазолина и 97 мл триэтиламина в
400 мп хлороформа. Реакционную смесь, температура которой достигает к этому времени 54 С, кипятят с обрато ным холодильником в течение 1 ч.
После охлаждения до 20 С обрао зовавшиеся кристаллы отделяют фильтрованием и отбрасывают. Органический фильтрат упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 45 С, затем растворяют о в 400 мл этилацетата. Образовавшиеся кристаллы снова отделяют фильтрованием, промывают два раза 100 мп (общее количество) этилацетата и отбрасывают. Органические растворы соединяют, выпаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С и остаток хроматоа графируют на колонке диаметром
6,2 см с 1 кг силикагеля (0,060,2 мм), элюируя смесями этилацетат/циклогексан и собирая фракции по 500 мл. Восемь первых фракций, полученных элюированием смесью 20/80 по объему, а также следующих семь, полученных элюированием смесью 25/75 по объему, отбрасывают. Следующие восемь фракций, полученных при элюировании смесью
30/70 по объему, соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и
40 С. Получают 27,9 r продукта, который делят на две равные части и хроматографируют раздельно на колонке диаметром 5 см с 300 г силикагеля (0,040-0 063 мм). Элюируют этилацетатом при пониженном давлении 0,5 бар (51 кПа), собирая фракции по 75 мл. Первые семь фракций отбрасывают, шесть следующих соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С. Получают 8 r продукта, который растворяют в кипящей смеси этилацетата и гексана (40/60 по объему) с добавлением
0,5 г древесного угля. После горячего фильтрования фильтрат охлаждают при 4 С в течение 4 ч, образоо вавшиеся кристаллы отделяют фильтрованием, промывают 10 мп смеси этилацетат/гексан (40/60 по объему) 5
55 и сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 20 С в присутствии таблеток едкого кали.
Получают 3,9 г 6-метил-5-оксо-2,3,6,7-тетрагидро-5Н-тиазол †(3,2-а)—
-пиримидина в виде белых кристаллов с т.пл. 76 С.
Пример 13. Раствор 48,5 r
3,3-диметилакрилоилхлорида в 300 мп хлороформа добавляют по каплям в течение 15 мин к раствору 46,6 г
2-амино-2-тиазолина и 54,5 мл триэтиламина в 300 мл хлороформа.Реакционную смесь, температура которой о достигает к этому времени 51 С, кипятят с обратным холодильником в течение 17 ч. После охлаждения до
20 С образовавшиеся кристаллы отделяют фильтроьанием и отбрасывают.
Органический фильтрат упаривают досуха при пониженном давлении о (20 мм рт.ст., 2,7 кПа) и 40 С,затем растворяют в 250 мл этилацетата.
Вновь образовавшиеся кристаллы отделяют фильтрованием, промывают два раза по 100 мл (общее количество) этилацетата и отбрасывают. Органические фильтраты соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и остаток хроматографируют на колонке диаметром 7,5 см с 1,25 кг (0,063-0,2 мм), элюируя этилацетатом и собирая фракции по 500 мп. Первые 9 фракций отбрасывают следующие восемь соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и
40 С. Получают 37 г продукта в виде твердого вещества светло-каштанового цвета, которое растворяют в 190 мл кипящего этилацетата добавлением
0,3 г древесного угля. После горячего фильтрования фильтрат охлаждают до 14 С в течение 2 ч. Образоо вавшиеся кристаллы отделяют фильтрованием, промывают два раза 20 мл (общее количество) охлажденного до
5 С этилацетата и отбрасывают.Органические фильтраты соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа), затем остаток растворяют в 140 мл кипящего ацетона, к которому добавлен
1 r древесного угля. После горячего фильтрования фильтрат охлаждают при
4 С в течение 2 ч,образовавшиеся о кристаллы отделяют фильтрованием, промывают два раза 20 мл (общее ко17
1091859
20 личество) охлажденного до >о0 ацетона и сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа) и
20 С в присутствии таблеток едкого о кали. Получают 13,8 г неочищенного о продукта с т.пл. 92 С. После растворения в 150 мл воды и отцеления нерастворимого остатка фильтрат лиофилизуют, Получают 12,2 г продукта, который растворяют в 110 мп кипящего ацетона. После охлаждения при 4 С в течение 90 мин образовавшиеся кристаллы отделяют фильтрованием, промывают два раза 20 мл (общее о количество) охлажденного до 5 С ацетона и сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 20 С в присутствии таблеток едкоо
ro кали. Получают 11, 1 г 7,7-диметил-5-оксо-2,3,6,7-тетрагидро-5Н-тиазол-(3.2-а)-пиримидина. в виде кристаллов кремового цвета с т.пл, 90 С „
Пример 14. Раствор 23,6 г кротоноилхлорида в 100 мл хлороформа добавляют по каплям в течение 20 мин к раствору 27,1 r 2-амино-4-метил-2-тиазолина и 31,8 мл триэтиламина в 300 мл хлороформа.
Реакционную смесь, температура котоо рой достигает к этому времени 38 С, кипятят с обратным холодильником в течение 3 ч. После охлаждения до
40 С реакционную смесь упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С, за- з тем растворяют в 200 мл ацетона.
Образовавшиеся кристаллы отделяют фильтрованием, промывают два раза
20 мл (общее количество) ацетона и отбрасывают. Органические фильтраты 40 соединяют и концентрируют досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С и остаток хроматографируют на колонке диаметром 4,2 см с 320 r силикагеля (0,063-0,2 мм).
Элюируют этилацетатом, собирая фракции по 250 мп. Первые шесть фракций отбрасывают, следующие четыре соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) . Получают 1 1,1 r неочищенного продукта в виде масла, которое добавляют к 4 r продукта, полученного таким же способом в другой операции, и затем делят на три равные части для разцельного хроматографирования кажцой части на колонке диаметром 4 см с 150 r силикагеля (0,040-0,063) . Злюируют смесью этилацетат/циклогексан (90/10 по объему) при давлении 0,5 бар (51 кПа), собирая фракции по 50 мл. Первые 9 фракций отбрасывают, следующие девять соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст.
О
Э
2,7 кПа) и 40 С.Получают 8 г продукта, который растворяют в 40 мл кипящего диизопропилового эфира. После охлаждения при 4 С в течение 1 ч обо разовавшиеся кристаллы отделяют фильтрованием, промывают 10 мл охлажденного до 5 С диизопропилового о эфира, сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа) и
20 С в присутствии таблеток едкого кали. Получают 6,2 r 3,,7-димечил-5-оксо-2,3 6,7-тетрагидро-5П-тиазол-(3,2-а)-пиримидина в виде белых кристаллов с т.пл . 76 С. о
Пример 15. Раствор 89 r
1-хлорциклогексанацетилхлорида в 350 мл хлороформа добавляют по каплям в течение 35 мин к раствору
52,7 г 2-амино-2-тиазолина и 130 мл триэтиламина в 350 мл хлороформа.
Реакпдонную смесь, температура коо торой достигает к этому времени 42 С, кипятят с обратным холодильником в течение 16 ч. После охлаждения о до 20 С образовавшиеся кристаллы отделяют фильтрованием и отбрасывают. Органический фильтрат упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С, затем растворяют в 400 мл ацетона. Образо= вавшиеся кристаллы снова отделяют фильтрованием,, промывают два раза
50 мл (общее количество) ацетона и отбрасывают, Органические фильтраты соединяют и упаривают досуха при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 40 С и остаток хроматографируют на колонке диаметром 5 см с 880 г нейтрального глинозема (0,12 — О,, 5 мм), элюируя смесью этилацетат/циклогексан (50/50 по обьему) и собирая фракции по 250 мл.
Первые две фракции отбрасывают,три следующие фракции соединяют и упаривают досуха при пониженном давлении (20 мм рт,ст., 2,7 кПа) и 40 С.
Получают 35,6 r неочищенного продукта. Этот продукт хроматографируют второй раз на колонке диаметром
3,7 см, содержащей 360 г нейтрального глинозема (0,12-0, l5 мм), 19
1091859
40
55 г.ужгород, ул.Проектная, 4 элюируя циклогексаном и собирая фракции по 1000 мл. Первые шесть фракций отбрасывают, следующие девять упаривают при пониженном давлении (20 мм рт.ст., 2,7 кПа) и получают 15 r продукта. Осуществляют третью хроматографию на колонке диаметром 6 см, содержащей 500 г силикагеля (0,040-0,063), элюируя смесью циклогексан/этилацетат (45/35 по объему) при давлении
0,5 бар (51 кПа) и собирая фракции по 100 мл. Первые двенадцать фракций отбрасывают, следующие десять упаривают при пониженном давлении (20 мм рт.ст., 2,7 кПа) и отделяют
5,4 г твердого вещества желтого цвета, которое растворяют в кипящей смеси 60 мл диизопропилового эфира и 2 мл ацетонитрила, к которой добавлено 0,05 r древесного угля. После горячего фильтрования о фильтрат охлаждают до 4 С в течение
16 ч, образовавшиеся кристаллы отделяют фильтрованием, промывают два раза 20 мл (общее количество) охлажо денного до 5 С диизопропилового эфира и сушат при пониженном давлении (20 мм рт.ст., 2,7 кПа) и 20 С в присутствии таблеток едкого кали.
Получают 4,4 г 5-оксо-2,3,6,7-тетрагидро-спиро-5Н-тиазол-(3,2-а)-пиримидин-7,1-циклогексана в виде белых кристаллов с т.пл. 110 С.
1-Хлорциклогексанацетилхлорид может быть получен следующим образом. Раствор 14 г 1-циклогексанолуксусной кислоты и 1 мл диметилформамида в 100 мл хлороформа добавляют по каплям к 14,5 мл тионилхлорида в течение 15 мин, постепенно нагревают и кипятят до прекращения выделения