Замещенные 4-цианофлуорены как сенсибилизаторы фотопроводимости полимеров на основе карбазолильных замещенных мономеров
Иллюстрации
Показать всеРеферат
Замещенные 4-цианофлуорены общей формулы где , C(CN)2 , как сенсибилизаторы фотопроводимосСЛ ти полимеров на основе карбазолильных замещенных мономеров.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК .
as) ao, ОПИСАНИЕ ИЗОБРЕТЕНИЯ 1 -
К АВТОРСКОМУ СВИДЕТЕЛЬСТВ
И
В
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И OfHPÈÒÈA (21) 3493809/23-04 (22) 10.06.82 (46) 15.05.84. Бюл. 9 18 (72) Д.Д.Мысык, И.Ф.Перепичка, Н.M.Ñèâ÷åíêîâà, Л.И.Костенко, И.С.Потоцкий и А.Г.Баратов (7l) Донецкий ордена Трудового Красного Знамени политехнический институт (53) 547 ° 678.3(088 ° 8) (56) 1. Патент США !! - 3721?13, кл. 260590, опублик. 1973.
2. Патент США Ф 3226388, кл. кл. 260268.
3. Nikherjel Т,К. Affinites of
Polynnokar Acceptors. Nitro Derivatives of Fluoren-Д -malononitrill.—
"Tetrahedron", 24,721-728.
4. Мигачев Г.И. и др. -"Журнал органической химии", !4 1"* li стр. 2380-2387 1979.
3(59,С 07 С 121 64 G 03 С 1 2. (54) зАмкщкннык 4-циАНОФлуОРены кАк СЕНСИБИЛИЗАТОРЫ ФОТОПРОВОДИМОСТИ ПОЛИМЕРОВ НА ОСНОВЕ КАРБАЗОЛИЛЬНЫХ ЗА,МЕЩЕННЫХ МОНОМЕРОВ. (57) Замещенные 4-цианофлуорены общей формулы. где Х=О, C(CN) как сенсибилизаторы фотопроводимости полимеров на основе карбазолильных замещенных мономеров..
l092l5l
Однако нитрогруппа в положении 4 непланарна с плоскостью цикла за счет стерических помех, создаваемых атомом водорода в положении 5, что
5 снижает электроноакцепторное влия ние нитрогруппы в результате уменьшения эффекта сопряжения.
Целью изобретения является разработка соединений, повышающих дифракционную эффективность сенсибилизаторов поликарбаэолилзамещенных,полимерных веществ.
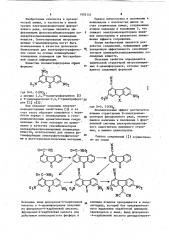
Полезные свойства определяются химической структурой.ннтроэамещен-, 15 ных 4-цианофлуореной, которые выра- жаются следующей формулой
Я
Ш
С где Х=О, С(СН), а именно 2,4,7-тринитрофлуоренон К и 9-дицианметилен-2,4,7-тринитрофпуо-,.25 рен 21 и(3).
Они обладают сильными электроноакцепторными свойствами 3 и за счет этого образуют комплексы с "переносом заряда с полиядерными н гетероциклическими ароматическими соединениями. На этом основано их применение в качестве сенсибилизаторов ноликарбазолилзамещенных полимерных веществ используемых для записи фотоинформации электрофотографически ми и Фототермопластическими методами, N
Н!
o=C-oK
Ж02
ЗС CN
0 0 0
Исходные амид флуоренон-4-карбоновой
55 кислоты и 4-цианофлуоренон получают из флуоренон-4-карбоновой кислоты.
Флуоренон-4-карбоновая кислота под действием пятихлористого фосфора в
Изобретение относится к органической химии, в частности к новой группе электроноакцепторов флуоренового ряда, которые являются эффективными фотосенсибилизаторами поликарбазолилзамещенных полимерных веществ. Синтезированные нитроэамещенные 4-цианофлуорены могут быть использованы в качестве фотосенсибилизаторов для электрофотографических слоев на основе поликарбазилэамещенных полимеров при бессеребряной записи информации. известны полинитрофлуорены общей формулы где Х=О, С(СИ)
Положительный эффект достигается новыми структурами П"электроноак- цепторов флуоренового ряда, отличающихся наличием в положении 4 флуореновой системы электроноакцептор ного заместителя линейного строения, а именно цианогруппы.
Синтез соединений (1 ) осуществляют по схеме кипящем ксилоле превращается в хлорангидрид, который без предварительного выделения обработкой аммиаком переводится в амид. Амид флуоренон"
-4-карбоновой кислоты дегидратируетl 51
3 1092 ся пятихлористым фосфором в кипящем ксилоле с образованием 4-цианофлуоренона.
Нитрование 4-цианофлуоренона смесью концентрированных азотной 5 и серной кислот протекает легко при. комнатной температуре и дает новый электроноакцептор - 2,7-динитро-4-цианофлуоренон. Его строение под.тверждают независимым встречным !О синтезом из амида 2,7-динитрофлуоренон-4-карбоновой кислоты действием на него пятихлористого фосфора в кипящем ксилоле. В результате протекающей реакции дегидратации получают тот же 2,7-динитро-4-цианофлуоренон.
В свою очередь, амид 2,7-динитрофлуоренон-4-карбоновой кислоты получают из амида флуоренон-4-карбоновой кислоты. Последний нитруется смесью в условиях, близких к описанным для нитрования 4-цианофлуоренона.
Взаимное расположение двух нитрогрупп в амиде 2,7-динитрофлуоренон-4-карбоновой кислоты доказано путем гидролиза его в серной кислоте при повышенной температуре. В результате этого превращения образуется 2,7-динитрофлуоренон-4-карбоновая кислота, идентичная известной, полученной нитрованием флуоренон— 4-карбоновой кислоты 14Д.
Таким образом, установленное расположение нитрогрупн в. амиде 2,7-ди-.З5 нитрофлуоренон-4-карбоновой кислоты однозначно указывает и на их расположение в 2,7-динитро-4-цианофлуореноне, получаемом независимым методом.
2,7-Дннитро-4-цианофлуоренон конденсируют с малононитрилом в присутствии основных катализаторов с образованием 9-дицианометилен-2,7-динитро-4-цианофлуорена. . Строение амида 2,7-ppHHTpo@ayoренон-4-карбоновой кислоты, 2,7-динитро-4-цианофлуорена и 9-дицианоме-. тилен-2,7-динитро-4-цианофлуорена
1подтверждают данными ИК-спектроскопии.
Пример l. Получение амида флуоренон-4-. карбоновой кислоты.
Смесь 14 r флуоренон-4- карбоно"
ВоН кислоты, 122 мл ксилола (сухого)
13 r пятихлористого фосфора нагревают ч на масляной бане при 90100 С. Затеи отгоняют 60 мл ксилола и добавляют к остывшей массе 31 мл аммиака. Осадок отфильтровывают, суспендируют в 150 мл воды, нагревают до 40 С; отфильтровывают, промывают водой (!00 мл) и сушат. Выход амида флуоренон-4-карбоновой кислоты 12,2 r (87%).,Внешний вид-светло-желтый порошок. Т.пл. 230230,5 С.
Пример 2. Яегидратация амида фпуоренон-4-карбоновой кислоты, Смесь из 10 r амичба флуоренон-4-карбоновой кислоты, полученного по методике примера 1, 66 мл ксилола, 11 r пятихлористого фосфора нагре1 вают на масляной бане 2 ч при 100о !
20 С. Растворитель отгоняют в вакууме водоструйного насоса, остаток суспендируют в 100 мл воды, нагревают до кипения, отфильтровывают осадок, отмывают водой до нейтраль-. ной реакции промывных вод, сушат.
Выход 4-цианофлуоренона 99,2 г(76,6%)„
Внешний вид — светло-желтый порошок. Т.пл. 241-242 С (из диоксана) . !
Пример 3. Нитрование 4-цианофлуоренона-9.
Растворяют 5 r 4-цианофлуоренона-9 в 75 мл серной кислоты при комнат" ной температуре, затем при перемешивании и охлаждечии льдом прикалывают 5 мл концентрированной азотной кислоты (d 1,,5). Темно-вишневый раствор перемешивают при 20-25 С о
0,5 ч, выливают в 800 мл ледяной во-. ды. Осадок отфильтровывают, промывают водой до нейтральной реакции промывных вод, сушат. Выход 2,7-динитро-4-цианофлуоренона 9 6 г (70,2%). Внешний вид — светло-желтый порошок. Т.пл. 265"266 С (иэ диоксана).
Найдено,%: N 14,43; 14,97 °
Вычислено,X: N 14,5.
Пример 4.,Нитрование амида флуоренон-4-карбоновой кислоты.
Аналогично примеру 3 из 5 r амида флуоренон-4-карбоновой кислоты, !
25 мл Н $0 и 8,0 мл конц. азотной кислоты получают амид 2,7-динитрофлуоренон-4-карбоновой кислоты.
Внешний вид — светло-желтый порошок. о
T-пл..309-310 С (из диметилформамида).
Найдено, %: И 13,14; 13,09.
Вычислено,X: N 13,4.
Пример 5. Дегидратация амида
2,7-динитрофлуоренон-4-карбоновой кислоты.
109215
1 r амида 2,7-динитрофлуоренон-4-карбоновой кислоты, 1 г пятихлористого фосфора и 30 мл Q-ксилола кипятят 4 ч, отгоняют половину растворителя, охлаждают и реакционную ., 5 массу разбавляют 50 мл гексана. Отфильтровывают осадок, обрабатывают горячей водой, сушат. Получают
0,89 г(94, 7% J светло-коричневого порошка 2,7-динитро-4-цианофлуоренона.
Продукт растворяют в 60 мл горячего диоксана, добавляют 60 мл горячей дистиллированной воды, оставляют на кристаллизацию. Отфильтровывают тонкие желтые иглы, промывают 15 на фильтре 10 мл холодного диоксана, сушат. Получают 0,71 г {75,5%) 2,7-динитро-4-цианофлуоренона. Т.пл.
265"266 С.
Пример 6. Гидролиз амида
2,7-динитрофлуоренон-4-карбоновой кислоты.
Суспензию 0,2 r амида 2,7-динитрофлуоренон-4-карбоновой кислоты, 4 мл серной кислоты (70%-ной наг- 25 ревают 1 ч при 145-155 С, затем охлаждают, разбавляют 20 мл воды, отфильтровывают осадок, промывают водой (до рН 7) и сушат. Получают ,7-динитрофлуоренон-4 -карбоновую З0 кислоту с т.пл. 236-237 С (4 . о, Пример 7. Конденсация 2,7-динитро-4-цианофлуоренона-9 с мало« . нонитрилом.
Растворяют 2 г 2,7-динитро-4-ци
-анофлуоренона-9 в 30 мл диоксана при перемешивании и нагревании на водяной бане, затем.при 60-65. С вносят в реакционную массу 1,3 г малононитрила и 5 r анионита .,(марки АБ-!7-8), обработанного 1%-ным раствором Na>CO . Время конденсации 45 мин, о температура 60-65 С.
Раствор отделяют от анионита, промывают анионит 20 мл диоксана, фильтрат оставляют на кристаллиза-цию. Отфильтровывают грязно-зеленый осадок, промывают 10 мл метанола, сушат. Получают 1,72 r (75%) 9-дицианометилен-2,7-динитро-4-,циано" флуорена. Продукт перемешивают с
3,4 мл серной кислоты при комнатной температуре 1 ч, выливают в воду, отфильтровывают осадок, промывают водой и сушат. Получают 1,5 r 9-дицианометилен-2,7-динитро-4-цианофлуорена, который затем кристаллизуют из диоксана. Внеыний вид— светло-желтый порошок. T.ïë. 339340 С.
Найдено,%: N 20,64; 20,67.
Вычислено,%: N 20,4.
В таблице показаны свойства предлагаемых соединений, в качестве сенсибилизаторов, по сравнению с известным веществом.
Показатели
Сенсибилизатор
Чувствительность на пространственной частоте
S Дж/см
Максимальная дифракционная эффективность ф,%
2,7-Динитро-4-цианофлуоренон
2,9 ° 10
10,7
9-Дицианометилен-2,7-динитро-4-цианофлуорен
1,2 10
Известный
2,4,7-Тринитрофлуоренон
5 ° 10 фективиостн превосходят известное у вещество.
Как видно из таблицы, предлагае" мые вещества по дифракционной эфВНИИПИ Ваааэ 3200 15 Д Иаж 410 Цоппщуще
Филиал ШБ эевт, г.Ужгород, ул.Проектиая, 4