Способ получения производных гомосерина
Иллюстрации
Показать всеРеферат
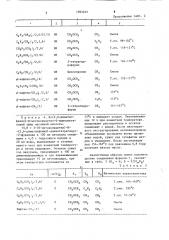
СПОСОБ ПОЛУЧЕНИЯ ПРОИЗЮДНЫХ. ГОМОСЕРИНА общей формулы : енг-сн
! ае 08
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИН
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ или
° а
° Ю
СН2- Н.® -В
А Ж- CK — (" GOB
СΠ— К1 яг- Я о где К1
Ar р Еу (21) 2997501/23-04 (22) 24 ° 10.80 (31) 9631/79 (32) 26. 10. 79 (33) Швейцария (46) 15.05.84. Бюл. Ф 18 (72) Вальтер Кунц (Швейцария), Вольфганг Экхардт, Адольф Хубеле (ФРГ) и Петер Рибли (щвейцария) (7 1) Циба-Гейги АГ (Швейцария) (53) 547.466.07 (088.8) (56) 1. Выложенная заявка ФРГ
У 1643527, кл. 12 Q 6/01, онублик.
1972.
2. Каррер П. Курс органической химии. Л., Госхимиздат, 1960, с. 326. (54)(57) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
ГОМОСЕРИНА общей формулы
СН ОСН 2-тетрагидрофурил
1Н-1, 2,4-триазолилметил или циклопропил; водород или метил; водород или С -С -алкил, фЦР С 07 С 101/32 // A 01 N 37/28 О где R — С„-C -алкил, метоксил или .р .
R — С.,-С -алкил, метоксил, хлор или NO -группа;
R — водород, метил, метоксил или хлор
R>N Rg — водород, метил, К вЂ” метил или NO>-группа;
<о
К„„ — водород, метил или НС -груп. I
nat
 — XH-, -XR> или галоид
Х вЂ” кислород или сера;
К9 - С -С -алкил
3 э отличающийся тем, что производное лактона или тиолактона формулы Й 2
С0 В где Аг, К, Х и К имеют указанные Э значения, :обрабатывают гидроокисью щелочного или
:щелочно-земельного металла в полярном растворителе, преимущественно смеси спирта и воды,при температуре от -10 до
+100 С с последующим выделением це.певого продукта или, при необходимости, алкилированием его для попу.1ения соединения формулы I,,где <., С1-С -алкил.
1093242 где R
Аг — Б
I О со — к
Ar
К
ЦЛИ 8
Х
Rg оси снсоос н5
" oo
Сбн /СН /,/2,6/
Сбн /СНЗ / /2,3,6/
ОН СН2ОСН
ОН СН ОСН
150-152
155-157
Изобретение относится к способу получения новых производных гомосерина общей формулы I сн,-сник,)-B
АГ-Ж вЂ” СН- СООР, 5
СΠ— E
СН ОСН, 2-тетрагидрофурил, 1Н-1, 2,4-триазолилметил или циклопропил водород или метил; водород или С1-С -алкил
R — С -С -алкил, метоксил или хлор, — С -С -алкил метоксил
1 2
Ф 1 хлор или ИО -группа, 6 — водород, метил, метоксил, или хлор;
К и R< - водород, метил, R метил или МО -группа; о
К. — водород, метил или
N0> -гр уппа;
 — одна из следующих групп: -ХН-, -XR Hëè галоид; — кислород или сера, — С -С -алкил обладаю3
3 шими фунгицидной активностью.
В литературе описано производное гомосерина формулы обладающее фунгицидной активностьюГ1 g>
Цель изобретения — расширение ассортимента средств, воздействующих на живой организм.
Поставленная цель достигается способом, основанным на известной реакции раскрытия лактонного кольца
С2 3, и заключающимся в том, что про . изводное лактона или тиолактона формулы 1!
10 где Аг, R<, Х и R имеют указанные значения, 20 обрабатывают гидроокисью щелочного или щелочно-земельного металла в полярном растворителе, преимущественно смеси спирта и воды, при температуре от -10 до +100 С с последующим о ъ&
- выделением целевого продукта или при необходимости алкилированием его для получения соединения формулы I со значением R — С „-С -алкил.
Пример 1. N-(2,6-диметилЗ0 фенил)-N-метоксиацетилгомосерин
11,0 F (0,04 моль) 3-(И-(метокси ацетил)-N-(2,6-диметилфенил)3 -амино-тетрагидро-2-фуранон растворяют
50 мл метанола и смешивают с раствором из 1,6 г гидроокиси натрия в 20 мл воды. Перемешивание, ведется
12 ч при комнатной температуре, затем раствор упаривают и протонируют
Ч полученную соль в кислой ионообмен40 ной колонке. Водный элюат экстрагируют метиленхлоридом, объединенные экстракты промывают водой, сушат над сульфатом натрия и упаривают. Остаток перекристаллизовывают из сложного этилового эфира уксусной (лигроина), Получают бесцветные кристаллы с т.пл. 150-152 С. о
Аналогичным образом получают и другие соединения формулы I, описан50 ные в табл. " (Rz= Н; Кэ= Н).
Таблица.1
1093242
Продолжение табл. 1
ОН
С Н э /С Нз /г /2, 6/
2-тетрагидрофурил
166-170 с нафтил-СН /2/
ОН
125-134
СН,ОСН, 45
Таблица 2 я характеристика
СН10снг г.ОС 3
СнгОСН, Т.пл. 81-83 С
Т.пл. 87-90 С
С Н
СН
Смола
СЬН,/СН, //2/Юг /6/ ОН о4-нафтил-/СН /г /2,3/ ОН
Пример 2, N-(2,6-диметилфенил)-И-метиловый эфир метоксиацетилгомосерина.
11,0 г (0,04 моль) 3-(N-метоксиацетил)-N-(2,6-диметилфенил)-аминотетрагидро-2-феранона растворяют в
50 мл 1,6 г гидроокиси натрия в
20 мл воды и перемешивают в течение
12 ч, затем упаривают и растворяют остаток в 75 мл абсолютного диметилформамида. После этого по каплям добавляют 3,2 мл метилиодида, перемешивают в течение 24 ч при комнатной температуре и прикалывают еще
1,8 мл метилиодида. После 24 ч перемешивания при комнатной температуре удаляют растворитель под вакуумом, остаток растворяют в метиленхлориде, промывают водой, раствор сушат над сульфатом натрия и упаривают. Сухой остаток растворяют в простом эфире, осаждают петролейным эфиром, фильтруют и дважды извлекают из эфира (петролейного эфира) . Полуо ченные кристаллы плавятся при 81-83 С.
Пример 3. N-(2-метилнафтил)-N-метоксиацетилметиловый эфир гомо40 серина. о / 15,7 г N-(2-метилнафтил)-N-метоксиацетил-N-(2-оксотетрагидрофуран-3-ил)-амина растворяют в
Сь Нз/СНз /г /2,6/ ОН
С6Н5/СНЗ/ /2,6/ ОН
Сьнг /СН / /2,3,6/ ОН
СН ОСН 110-114
СН,ОСН, 160-161
100 мп метанола. При ООС прикапывают в течение 10 мин 10 мл раствора ед-, кого натра (303-ного) и затем переме" шивают 3 ч при комнатной температуре.
Затем раствор упаривают в ротационном испарителе и оставшуюся динатриевую соль N-(2-метилнафтил)-N-метоко сиацетил-гомосерина при 90 С сушат под глубоким вакуумом.
p / 0,083 моль полученной динатриевой соли растворяют в 100 мл диметилформамида и в течение 15 мин при
0-5 С добавляют 14,1 r метилиодида.
Перемешивают 6 ч при комнатной температуре, упаривают раствор в ротационном испарителе, смешивают остаток с 50 мп диметилхлорида, органическую фазу выливают на ледяную воду, отделяют два раза, экстрагируют с 25 мл метиленхлорида и сушат объединенные экстракты над сульфатом натрия. После упаривания раствора остаток растворяют в 30 мн горячего хлороформа и после охлаждения добавляют немного диэтилового эфира. Выход 14 г кристаллического конечного продукта. Т.пл. 132-137 С.
Аналогичным образом можно получить соединения, указанные в табл. 2 (R> = н).
1093242
Продолжение табл. 2
СН2ОСН, 2 3
СН20СН3
СН, ОСН, СН6Н3/СН /2 /2,6/
С6Н3ОСН2 /2 /СТ/6/
С НЗ /СН3 /2 /2, 6/
SH сн
ОН
Смола
Т.пл. 104-110 С .
2-тетрагидрофурил
СН3
ОН
С Н3/СНз/г /2,6. с -нафтил-СН /2/
СН
Смола
Т.пл. 132-137 С
Ци клопр о пил
СН ОСН
СН2 ОСН
2 3
СН2ОСН3
ОН
ОН сн
Смола
137 С
115 С
141 — 145. С
С2Н5
QL нафтил-СН3/2/
2-тетрагидрофурил сн
ОН
35 С и выпадает осадок. Перемешивают еше 12 ч при комнатной температуре. выпаривают растворитель и остаток смешивают с водой. После многократного экстрагирования метиленхлоридом объединенные экстракты вновь промывают водой, сушат над сульфатом натрия и упаривают ° После дистилляции при 154-165 С под давлением 0,8 Торр получают вязкое масло.
Пример 4. N-(2,6-диметилфенил)-N-метоксиацетил-4-амннометиловый эфир масляной кислоты.
13,8 r 3-(N-метоксиацетил) -N-(2,6-диметилфенил)-аминотетрагидро-2-фуранона в 100 мл метанола смешивают с 4,0 г гидроокиси натрия в
20 мл воды, выдерживают в течение одного часа при комнатной температуре и затем упаривают. Остаток сушат под вакуумом, примешивают к 100 мл диметилформамида и при перемешивании прикапывают 14 мл ме-.илиодида, при этом температура поднимается до
Аналогичным образом можно получить другие соединения формулы I, указанные в табл. 3 (К2 = H; 8 = Х(0),„Н9)
Таблица 3
-Х/О/(П
Т.кип. 164-160 С
Т.кип. 195 С
Т.пл. 51-52 С
СН,ОСН3 сн сн
СНОСН СН СН, 2 3 3 Э
Щ2ОСНЗ СН3 CH3
СН2ОСНЗ СНЗ СН3
Смола
Смоля
С6 Н2/СН3/2 /2,6/С1/3/ ОН
C6H2/ÑÍ /3/2,3,6/ ОН
С6НЗСН3/2/N02 /6/ ОН в -нафтил/СН /2 /2,3/ ОН
3-нафтил/СН3/ /2,3/ ОН
С,Н,/СН,/,/2,6/
С 6 H 3 / C 3 /2 2,ч 6 /
С Н /С113 2 2 ф 6/
С Н2/СН3 /3 /2,3,6/
Нафтил-С!13,/ 2/ сн Смола
С Н Т.пл, 98-102 С
СН Т.пл. 118-121 С
R9 Физическая характеристика
10932
Пример 5. N-(2,6-диметилфенил)-N-метоксиацетил-4-(N-этилкарба-, моилокси)-2-метиловый эфир аминомасм ляной кислоты.
9,3 r N-(2,6-диметилфенил)-N-меток- 5 сиацетил-метилового эфира гомосерина растворяют в 200 мл абсолютного тетрагидрофурана и примешивают к каталитическому количеству 1,4-диазабицикло-(2,2,2) -октану. При охлаждении 10 льдом и перемешивании прикапывают
2,6 r этилизоцианата, перемешивают в течение 20 ч при 40-50 С, упаривают раствор и оставшуюся смолу извлекают петролейным эфиром, при этом смола, 15 затвердевает. Полученные кристаллы отфильтровывают. Т.пл. 56-60 С.
Пример 6. N-(2,6-диметилфенил)-N-метоксиацетил-(4-имидазол-1-ил)-карбонилокси-метиловый эфир 20 масляной кислоты.
9,3 r N-(3,б-диметилфенил)-N-метоксиацетил-метиловый эфир гомосерина растворяют в 200 мл абсолютного диоксана и под атмосферой азота при- 25 мешивают к 7,3 r И И-карбонилдиимидазола.
Полученный раствор перемешивают в течение ночи при комнатной темпера туре, выливают на ледяную воду и 30 экстрагируют метил енхлоридом. Экстракты промывают водой, сушат над сульфатом натрия и удаляют растворитель под вакуумом. После растворения в простом эфире и обработки активиро- 35 ванным углем получают чистый продукт в виде вязкой смолы °
Пример 7. N-(2,6-диметилфенил)-И-метоксиацетил-2-амйно-4-хлорметиловый эфир масляной кислоты 40
27,7 г 3-({N-метоксиметил)-N-(2 6-диметилфенил)) -амико-тетрагидЭ
О ро-2-Фуоанона растворяют при 40-50 С в 150 мл метанола, охлаждают и при
0-5 С насыщают газообразным хлорводоо
45 родом. После 3-суточной выдержки при комнатной температуре раствор нагревают до 55 С и выдерживают при этой температуре 24 ч. Затем раствор упаривают, остаток растворяют в метилен.
50 хлориде, промывают в ледяной воде, сушат над сульфатом натрия и упаривают. Нерастворимый в диэтиловом эфире не прореагировавший исходный продукт осаждают отфильтровывают. После удаления эфира получают крис- таллы соединения, которые после пе-. рекристаллизации из бензина плавятся при 70-72 С °
42 8
Пример 8. N-(2,3,б-триметипфенил)-N-метоксиацетил-2-амико-4-хлорэтиловый эфир масляной кислоты.
20,4 г 3-(N-метоксиметил) -N-(2,3,6-триметилфенил)-аминотетрагидро-2-фуранона растворяют в 150 мл этанола и при перемешивании прикапывают 12,5 r тионилхлорида. Затем раст.вор нагревают и кипятят 4 ч с обратным холодильником, вторично добавляют 10 г тионилхлорида и еще 2 ч кипятят с обратным холодильником, после упаривания остается смола, которую очищают над силикатной колонкой (хлороформ:эфир 1:1). Соединение осаждают в виде вязкой смолы.
Предлагаемые соединения обладают профилактическим и лечебным действием для защиты культурных растений оТ целого ряда фитопатогенных грибков. По сравнению с известными соединениями 1 1 j они обладают более широким спектром действия, особенно против растительно-патогенных грибков, а также лучшей сопротивляемостью к теплу и солнечному облучению.
Сравнение по фунгицидной активности проводилось со структурными аналогами 1 1, имеющими следующие формулы (A-Г): (Д С1
С1
С1
СН
СнЗ
СНС ООС2Н5 с-©
CiH3 (.Н вЂ” СООС2Н5 .И
С СН2(Н
П
1093242
Продолжейие табл. 4
5-10
100
5-7
90-100
100
F с1
0-5
100
90-100
Контрольные 100 растения
5-10
0-5
5-10
10-12
8-12
Таблица 5 .
0-5
80-100
Т а б л и ц а 4
0-5
100
2-7
100
Поражение, %
Соединение
0-5
100
5-10
90-100
2-7
5-10
0-7
100
0-5
3,5
5-10
7-12
Контрольные 100 растения
90-100
Испытания проводились по отношению к штаммам грибов-Phytophthora infestans и Pythium debarianum на томатных растениях и кукурузе.
Действие против Phytophthora 20
infestans на томатных растениях (остаточно-предохранительное действие).
Томатные растения после 3-недель,ного роста опрыскивают приготовленным из смачивающегося порошка биоло- 25 гически активного вещества рабочим раствором, содержащим 0,02% активного вещества и состоящим из водных, разбавленных смачивающихся порошков. Спустя 24 ч обработанные растения инфицируют суспензией спорангий гриба. Оценку поражения грибом осуществляют после инкуба1 ии инфицированных растений в течение 5 дней при относительной влажности воздуха
90-100% и при 20 С.
По сравнению с необработанными контрольными растениями (100%-ное поражение) томатные растения, которые были обработаны одной из указанных композиций, показывают следующие результаты (табл, 4 и 5).
11.
Контрольные растения были инфицированы спорангами гриба, но не обработаны биологически активным веществом.
Поражение, X Соединение Поражение, X
11 1093242
Продолжение табл. э т п
2 3 емпературе примерно 20оС. При этом очву поддерживают всегда равномерно влажной благодаря легкому орошению
При оценке теста определяют про растание кукурузы, а также долю здоровых и больных растений. Результаты представлены в табл. 6.
Таблица 6
Поражение, Ж Соединение Поражение, Х
0-3
0-6
92-94
93-,95
3 1
5-10
3,4
3-8
0-10
5-10
0-5
0-5
0-5
0-5
0-3
5-10
7-10
0-5
0-5
90-93
Контрольные растения
92-95
92-95
92-95
92-95
85-90
Таким образом, предлагаемые соединения обладают высокой фунгицидной активностью.
ВНИЗПИИ Зажав 3288/46 Тираж 410 Подписное
Филиал ППП "Патеит", г. Ужгород, ул.Проектная,4
Контрольные растения заражены спорангией гриба, но не обработаны биологически активным веществом.
Действие против Phythium debaryanum на кукурузе.
Гриб культивируют на питательном растворе из кусочков моркови и поме- 40 щают в смесь с песком, Таким образом инфицированной почвой заполняют цветочные горшки и высевают туда семена кукурузы. Сразу после повеса почву поливают сформулированными в виде 45 смачивающихся порошков испытуемыми препаратами в виде водной суспенэии.
Эти рабочие растворы содержат 20 .м.д. активного вещества. Горшки затем помещают на 2-3 недели в теплицу при
85-92
90-91
90-92
92-95
92-65
92-95
92-95
92-95
90-95
92-94
93-95