Способ определения иодидов
Иллюстрации
Показать всеРеферат
1. СПОСОБ ОПРЕДЕЛЕНИЯ ИОДИДОВ , включающий потенциометрическое титрование раствором бихромата калия в среде ортофосфорной кислоты, о т .личающийся тем, что, с целью повышения точности анализа в присутствии двухвалентного железа и упрощения процесса, в качестве среды используют смесь концентрированных ортои пирофосфорной кислот. 2. Способ по п. 1, отличающийся тем, что используют смесь 15-20 мл ортофосфорной кислоты плотностью 1,73 г/см и 25-30 мл пирофосфорной кислоты плотностью г/см . (/) с
СОЕЗ СОВЕТСКИХ
И МИН«
РЕСПУБЛИК
0% 01)
3(51) G 01 Й 31/00
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И OTHPbITPN
ОПИСАНИЕ ИЗОБРЕТЕНИЯ и ASTOPCHOMV СВИДЕТЕЛЬСТВУ (21) 3567738/23-26 (22) 25.03.83 (46) 07.06.84. Бюл. У 21 (72) С.Г.. Дятел и Л.И. Вассерман (71) Восточный научно-исследовательский углехимический институт (53) 543.257.1(088.8) (56) 1. Цанкова С.Д., Кулев И.И. Амперометрическое титрование иодидов в присутствии высоких концентраций бромндов и хлоридов с двумя поляризованными электродами. "Заводская лаборатория", 1981, т. 47, И 2, с. 24-25.
2. "Talanta", 1978, v. 25, Ф 1, с. 50-52. (54)(57) 1. СПОСОБ ОПРЕДЕЛЕНИЯ ИОДИДОВ, включающий потенциометрическое титрование раствором бнхромата калия в среде ортофосфорной кислоты, о т.л и ч а ю шийся тем, что, с целью повышения точности анализа в присутствии двухвалентного келеза и упрощения процесса, в качестве среды используют смесь концентрированных орто- и пирофосфорной кислот.
2. Способ по п. 1, о т л и ч аю шийся тем, что используют смесь 15-20 мл ортофосфорной кислоты плотностью 1,73 г/см и 25-30 мл пирофосфорной кислоты плотностью
2 0 г/смз
1096571
Изобретение относится к аналитической химии, а именно к способам определения: иодидов, и может быть использовано для анализа сточных вод, химических реактивов, фармацевтических препаратов, экстрактов алкилиро,ванных углей, рассолов и др.
Известен амперометрический способ определения иодидов, включающий введение в анализируемый раствор бром- 10 ной воды, удаление избытка брома кипячением, введение уксусной кислоты„ тиосульфата натрия и иодида калия.
Полученный иодат окисляет . иодид, выделяя эквивалентное количество 15 иода, который реагирует с добавленным тиосульфатом f13.
Однако данный способ сложен, длителен и требует удаления кислорода током азота. 20
Наиболее близким к изобретению но технической сущности и достигаемому результату является способ определения иодидов, включающий потен,циометрическое титрование раствором бихромата калия в среде 45-60 мл
6-8 М кислоты (уд. вес 1,3-1,39 г/см ) в атмосфере углекислого газа 21, Однако известный способ осложнен ЗО необходимостью проведения анализа в инертной атмосфере, что требует специальных устройств для исключения контак "a - кислородом воздуха. В отсутствие инертного газа при титрова35 нии бихроматом в кислой среде наблюдается частичное окисление иодидионов кислородом воздуха. Кроме того, определению мешает двухвалентное железо, которое титруется совместно с 4 иодидом, чтс приводит к снижению . точности определения, Целью изобретения является повышение точности анализа в присутствии
4 двухвалентного железа и упрощение процесса.
Поставленная цель достигается тем, что согласно способу опрецеления иодидов, включающему потенциометрическое титрование раствором бихромата калия в среде ортофосфорной кислоты, в качестве среды используют смесь концентрированных орто- и пирофосфорной кислот.
При этом используют смесь 15-20 мл ортофосфорной кислоты плотностью .
1,73 г/см и 25-30 мл пирофосфорной
KHCJID 61 ITJI0 I HOCTbIO 2,0 г/CM
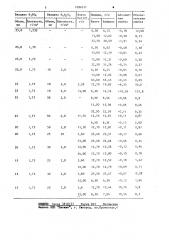
В таблице представлены результаты титрования О, 1 н. водного раствора
KJ водным раствором бихромата в отсутствие и в присутствии Fe в зависимости от содержания в среде ортои пирофосфорной кислот. Титрование проводили в обычных условиях без атмосферы индифферентного газа. Использование в качестве средь для бихроматометрического титрования ортофосфорной кислоты с концентрацией выше
8 М (плотность d больше 1,39 г/см ) увеличивает устойчивость иодида к действию кислорода воздуха, так как абсолютная отрицательная ошибка уменьшается. Однако и при достижении максимальной плотности реактива— концентрированной фосфорной кислоты марки г ., равной 1,73 г/см, еще имеет место систематическое занижение результатов, мешающее влияние кислорода плотностью не устраняется.
Результаты титрования J в присутствии ионов Fe в среде ортофосфорной кислоты плотностью 1,73 г/см завышены (таблица).
В качестве добавок использовали реактивную концентрированную пирофосфорную кислоту марки "., по условиям изготовления содержащую примесь ортофосфорной кислоты и имеющую плотность 2,0 г/см .
Из таблицы видно, что добавление к 25 мл ортофосфарной кислоты 10 мл пирофосфорной кислоты плотностью
2,0 г/см позволяет исключить мешающее влияние кислорода воздуха, так как исчезает систематическая ошибка определения иодида в отсутствие ионов железа.
Однако здесь продолжают оказывать мешающее влияние ионы железа, титрующиеся совместно с иодидом. Относительная ошибка определения иадидов в этих условиях пропорциональна содержанию железа. Так, в присутствии
13 мг железа относительная ошибка определения 6,5 мг иодида составляет 157,8Е. Увеличение содержания пирофосфорной кислоты в смеси до 50 мл позволило получить на кривой титрование не один, а два скачка потенциала, соответствующие раздельному титрованию иодида и железа. Методом стандартных добавок установлено, что первый скачок отвечает дифференциро ванному титрованию железа, а второй скачок — раздельному титрованию иоди1096571 да. Это позволяет по разности объ емов бихромата, затраченных на достижение скачков, рассчитывать содержание иодида, т.е. устранить мешающее
4лияние Уе". В смеси 25 мл ортофос- 5 форной кислоты с d = 1,73 г/см и
50 мл пирофосфорной кислоты с d
2,0 г/см результаты анализа иоди да в присутствии Fe количественные, кислород воздуха не оказывает меша- 10 ющего влияния. Дальнейшее уточнение состава среды велось в направлении ,выяснения возможности сокращения количества используемых реактивов, так как это позволяет повысить эко- 15 номичность анализа. Анализ иодидов в среде 15-20 мл фосфорной кислоты с d - =1,73 г/см и 25-30 мл пирофос- форной кислотв с Cl = 2,0 г/см обеспечивает точные результаты анализа иодидов без мешающего влияния со стороны кислорода воздуха и ионов железа (таблица). Этот интервал является оптимальным, так как отсутствиуют систематические ошибки и относитель- 25 ная ошибка определения иодида не превышает 2Х.
Пример 1 ° Определение иоди" дов в технологических растворах— .экстрактах алкилированных углей.
5 мл исследуемого раствора помещают в стакан для титрования, добавляют 15 мл ортофосфорной кислоты плот.ностью 1,73 г/см и 25 мл пирофосфор. ной кислоты плотностью 2,0 г/см и титруют 0,05 н. стандартным раство35 ром бихромата калия потенциометрическим методом с системой .электродов платиновый . — хлорсеребряный на потенциометре рН-340. Строят график в координатах нв-мл и находят конечные точI ки титрования, Первый скачок (Ч,,мл) раствора бихромата соответствует окислению двухвалентного железа в трехвалентное, второй скачок (Ч1 -Ч мл) раствора би-. хромата — окислению иодида до свободногс иода.
Расчет содержания иодид-иона проводят по формуле ! где С
Ч4
127 (Vz Чл ) 127
С3 а концентрация иодид-иона, г/л; — нормальность раствора; объем Кг С« О, затраченный на титрование Fe, мл; — объем К2Сг О, затраченный на .титрование J мл; — аликвотная часть раствора, мл; эквивалентная масса J, г.
Предлагаемым способом найдено
4,101 г/л иодида, известным — 3,978 r
Относительная ошибка 0,45Х.
Пример 2. Определение иодидов в модельном растворе, содержащем
5, 85 г/л NaCl 16,61 г/л KJ; 4 г/л
ГеЯО+ .
2 мл исследуемого раствора помещают в стакан для титрования, добавляют 20 мл ортофосфорной кислоты плотностью 1,73 г/см, 30 мл пирофорсфорной кислоты плотностью 2,0 г/см и титруют 0,05 н. раствором KzC«z 0 по примеру 1. На титрование затрачено
4,02 мл 0,05 н. раствора К С«„О
Предлагаемым способом найдено
12,726 r/л иодида, Относительная ошибка 0,23Х.
Пример 3. Определение иодида в модельном растворе, содержащем
2,95 г/л К7; 2 г/л Fez(SO );
4 г/л FeSO
5 мл исследуемого раствора помещают в стакан для, титрования, добавляют 17 мл ортофосфорной кислоты плотностью 1,73 г/см и 28 мл пирофосфорной кислоты плотностью 2,0 г/cM и титруют 0 05 н. раствором К С« О> по примеру !. На титрование затрачено 1,79 мл 0,05 í. K Cr>07. Предлагаемым способом найдено 2,26 г/л иодида. Относительная ошибка 1,9Х.
Предлагаемый способ позволяет определить иодид в присутствии железа и упростить этот процесс, так как нет необходимости прибегать к атмос- фере индифферентного газа.
1096571
Введено НуРО Иодиды, г/л
Введено Н4Р О>.АбсолютОтносиВзято
Ре(П), г/л ная ошибка тельная ошибка
Объем, Плотность, мл г /см
Найдено
Объем, Плотность, мл г/см
Взято 25,0 1,532
12,00
8,15
6,24
25,0 1, 70
7,38
6,23
25,0 1,73
5,30
2,27
250 1 73
0,76
2,0
0,61
65,45
19,05
65,00
12,70
0,69
50,0
1,73
9 0
5,58
1,73
2,0
13,00 6,50 16,76
157,8
6,50 6, 56
13 0G 13, 06
1,73
29 О
0,9
0,46
32,50
12,70
32,39
12,81
-0,11
+0,11
0,33
0,87
2,0
1, 7.3
50, 6,50
12,70
6,34
12,81
2,00
0,87
-O 13
+0,11
+0,17
11,50
5,60
2,0
1,73
25,40 25,57
0,66
1,73
23,00 25,40 25,46 l2,00 12,70 12,58
24,00 12,70 12,80
+О, 06
-О, 12
0,24
0,94
2,0
1,73
0,78
5,60
1,42
12,/O 12,52
2,0
1,73
1 2у00 1 2у 70 1 2 у 79
0,71
0,28
25,40 25,47
5,60
2,0
1,73
1,84
12,00 6 50 6, 38
5,8
12,70 13,44
6,50 7,04
5,6
2,0
1,?3!
8,3
12,00
ВНИИПИ Заказ 3818/33 Тираж 823 Поллисное
6,50 6,72
13,00 12,02
32,50 30,59
6,50 6,02
13,00 12,19
13, 00 12, 31
32,50 31,76
6,50 6,45
13,00 12,92 — 0,78 — 0,98 — 1,91
-0,48
-0,81
-0,69
-0,74 — 0,05
-0,08
+0,45
+6,35
+10,26
+0,06
+0,06
+О, 10
-0,18
+0,09
+0,07
-0,12
10,74
10,54