Способ получения антисыворотки к катехоламину
Иллюстрации
Показать всеРеферат
1. СПОСОБ ПОЛУЧЕНИЯ АНТИСЫВОРОТКИ К КАТЕХОЛАМИНУ путем иммунизаДии животного антигеном, ковалентно связанным с носителем, с последукяцим забором крови и выделением из нее антисыворотки, отличаю щ и и с я тем, что, с целью повьппения специфичности целевого продукта, в качестве антигена истюльзуют остаток катехоламина, ковалентно связанньй с белком-носителем по следующей формуле Н Н - I - Б . К - ( (снр, N N Н I N где К - остаток катехоламина, содержавший первичную аминогруппу; Н - I Б - остаток антигенного белN ка-носителя . (СН) - алифатическая цепочкаi 2. Способ по п. 1,отличаю (Л щ и и с я тем, что в качестве белканосителя используют сывороточный G: альбумин, бычий тиреоглобулин или гемоцйанин улитки.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
„.SU„„10 7337
3(51) А 61 К. 37/02
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ABTOPCHOMY СВИДЕТЕЛЬСТВУ рот ц1 3%((Я
Н
i — остаток катехоламина, N содержащий первичную аминогруппу; где КГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3510479/28-13 (22) 09.11.82 (46) 15.06.84. Бюл. Р 22 (72) С.П.Смотров, П.М.Аширов, И.Г.Шанявский и Д.Б.Сапрыгин (71) Тащкикский государственный университет им. В.И.Ленина (53) 615.373.3(088.8) (56) 1. Патент ФРГ Ф 2.608.096, кл. С 07 G 7/00.
2. Патент США Ф 3.704.282, кл. С 07 С 7/00. (54)(57) 1. СПОСОБ ПОЛУЧЕНИЯ АНТИСЫВОРОТКИ К КАТЕХОЛАИИНУ путем иммунизации животного антигеном, ковалентно связанным с носителем, с последующим забором крови и выделением из нее антисыворотки, о т л и ч а юшийся тем, что, с целью повьппения специфичности целевого продукта, в качестве антигена используют остаток катехоломина, ковалентно связан- ный с белком-носителем по следующей формуле
Н Н
К1-(СН)1Б
2 5 1
N . N
Н
1 — Б — остаток антигенного белN ка-носителя. .(СН ). — алифатическая цепочка„ .
2. Способно п. 1, отличаюшийся тем, что в качестве белканосителя используют сывороточный альбумин, бычий тиреоглобулин или гемоцианин улитки.
1097337
10
1
Изобретение относится к иммунохимии, в частности к способаи получения антител к катехоламинам, и может быть использовано в медицине, диагностической и исследовательской работе.
Известен способ получения антисыворотки к катехоламину;путем иммуни-. зации животного антигеном, представлякнцим собой катехоламин, фенильное ядро которого ковалентно связано с полипептидом или протеином (13.
Недостатками данного способа являются низкие специфичность и сродство получаемых антител к катехоламину.
Известен также способ получения антисыворотки к катехоламину путем иммунизации животного антигеном, ковалентно связанным с носителем, прн этом аминогруппа катехоламина ковалентно связана с карбоксильной группой белка или полипептида (23.
Однако известный способ позволяет получить антитела к катехоламину, обладающие низкими специфичностью и сродством, поскольку в используемом для иимунизации конъюгированном антигене остаток катехоламина близко расположен к антигенным детерминантам белка или полипептида, взятых в качестве носителя целевого антигена.
Целью изобретения является повышение специфичности целевого продукта.
Цель достигается теи, что согласно способу к катехолаиину путем иммунизации животного антигеном, ковалентно связанным с носителем, с последующим забором крови и выделением из нее антисыворотки, в качестве интигена используют остаток катехолаиина, ковалентно связанный с белком-носителем по следующей формуле
Н Н
К-1-.(СН) — I -Б
2 У
N N
Н где К вЂ” I — остаток катехоламина, соВ держащий первичную аминогруппу;
Н
1 - Б - остаток антигенного бел0 ка-носителя. (CH ) — алифатическая цепочками
В качестве белка-носителя используют сывороточный альбуиин, бычий тиреоглобулин или гемоцианин улитки.
Пример. Синтез конъюгата осуществляют с помощы сочетающего реагента — глутарового альдегида.
В качестве антигенных носителей используют бычий сывороточный альбумин, бычий тиреоглобулин и гемоцианин улит ки. В 5 мл 0,05 М фосфатного буфера рН 7,2 растворяют 5 мМ катехоламина, например норадреналина, дофамина, дофа или норметанефрина, в 0,001 мМ белка-носителя. В этому раствору прибавляют при постоянном перемешивании по капляи 2 мл 0,05 М раствора глутарового альдегида. Па истечении 30 мин инкубацни при комнатной температуре добавляют 0,2 мл 0,2 М раствора глу.тарового альдегида. Реакционную смесь перемешивают 3 ч, затем к ней. приливают 0,2 ил 1Х-ного раствора боргидрида натрия и оставляют при комнатной температуре 1 ч. Далее раствор диализуют против физиологического раствора 24 ч при 4 С. Содержание связанного катехоламина в конъюгатах оценивают радиационным методом с применением .меченого тритием катехолаиина и спектрофотометрическим методом.
Иммунизацию кроликов проводят по следующей схеме: первую инъекцию (О, 1 ил смеси равных объемов полного адъюванта Фрейнда и раствора антигена с концентрацией 1 иг/мл) делают
35 в лимфатический узел бедра задней лапы. Через 3 недели 0,5 мл смеси вводят внутрикожно во множество точек в область шеи. Затем через 2 недели инъецируют смесь с неполным
4О адъювантом Фрейнда (1 мл) внутримышечно в бедро задней лапы. Последующие инъекции (0,5 ил смеси с неполным адъювантом) проводят внутрикожно с месячным интервалом. Через 7 дней
45 после введения антигена производят забор крови. Полученную антисыворотку инактивируют нагреванием при 56 С
30 мин, разделяют на аликвоты и хра» нят при -20 С.
Антитела к катехоламину идентифицируют иетодаии встречной двухмерной диффузии и по связыванию сыворотками радиоактивного катехоламина по способу, согласно котороиу к 50 мкл сыворотки в 0,1 мл 0,1 М трис-буфера рН 7,5 добавляют 3,4 нг меченого тритием катехоламина и инкубируют ари
4 С 3 ч. Радиационную смесь разделяют на колонке с сефадексом С -25, о
3 1097 применяя в качестве элюента 0,1 М трис-буфер рН 7,5. Фракции (по 1 мл) смешивают с 10 мл сцинтилляционного раствора Брея и измеряют радиактивнОсть В жидкОстнОм сцинтиляционном спектрометре. Контролем служит сыворотка интактного кролика.
Титры антител определяют путем инкубации фиксированного количества меченого тритием катехоламина с серн= 1р ей двухкратных разведений антисыворотки.Для разведения применяют 0,02 М фосфатный буфер рН 7,4, содержащий
2 мг/мл бычьего сывороточного альбумина. 15
Методика определения титров, специфичности и сродства антител следующая ii
К 100 мкл антисыворотки соответствующего разведения добавляют 20
0,34 нг меченого тритием катехолаиина в 0,1 мл 0,2 М фосфатного буфера рН 7,4 и 0,3 мл 0,5 Х-ного раствора бычьего сывороточного альбумнна, содержащего 0,9Х хлористого натрия..: и 0,05 Х кроличьего гаммаглобулина.
Смесь перемешивают и инкубируют 12 ч при 4 С. Связанный меченый трнтием катехоламин осаждают добавлением
0,5 мл ЗОХ-ного раствора полиэтиленглйколя и удаляют центрифугированием при 3000 об/мин 40 мин.. К 0,2 мл надосадочной жидкости добавляют 10 мл раствора Брея и просчитывают на сцинтнлляционном счетчике. Иаксималь35 ное разведение антйсыворотки, при котором связывание меченого тритием катехоламина составляет 15Х, прини- ° мают за титр антител к катехоламину.
Для Оценки перекрестнОЙ реактив 4б ности антител используют известный прием ингибирования связывания антисывороткой меченого гаптена его родственными соединениями. Специфичность антисыворотки оценивают путем добавления аналогов, например, к норадреналину, таких как дофамин, дофа и норметанефрин.
337 4
Определение связывающей способности антител проводят методом сатурационного анализа, Для количественной оценки процесса взаимодействия антител с катехоламином используют значения констант ассоциации (Касс, М ), вычисление которых производят исходя из графика
Скзтчарда.
Результаты исследования обрабатывают методом вариационной статистики по Стьюденту-Фишеру.
Положительные качества получаемых предлагаемым способом антител к кате-. .холамнну представлены в табл. У 1.
Перекрестная реактивность, которая характеризует специфичность антител, получаемых предлагаемым способом, ни.же, чем перекрестная реактивность антител, получаемых по прототипу.
Это говорит о том, что специфичность
:антител, получаемых предлагаемым спо, собом, выше. Поскольку константы ассоциации антител, получаемых предла-. гаемым способом, выше, чем констан- ты ассоциации антител, получаемых по прототипу, то можно утверждать, .что сродство антител, получаеьых предлагаемым способом, вью.
Были получены характеристики связывания катехоламина с антигенным носителем, которые сведены в табл.
;0 2 на примере норадреналина.
В табл. 3 представлены титры антител в полученных антисыворотках.
Из табл. В 3 видно, что титры антител в антисыворотках, получен ных предлагаем4м способом, выше тит-. ров антител в антисыворотках, полученных по прототипу. Для сравнения использованы антисыворотки, полученные по прототипу.
- Таким образом, специфичность целевого продукта возросла в 3-4 раза .по. сравнению с известная, что позволяет повысить чувствительность определения сенсибилизации организма к препаратам катехоламина.
1097337
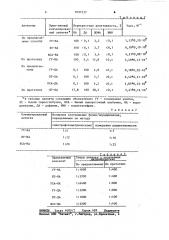
Т блица1. йз
6:аю яка
Касс, М
Перекрестная реактивность, Х
НА ДА ДОФА НМН
Прим .няемый коньюгирован ный антиген
Лнтигены к
1, 12+0, 10 "10
По предлагаемому способу
100 < 0,1 3,2 <0,1
100 <О 1 2 7 <081
ГУ-HA
6, 18+0, 19 ° 10
4921 0908 10
2,49 0,12 10
БТ-НА
БСА-HA
По прототипу ГУ-НА
3,4 <0,1
15,8 <0,1
100 (0,1
100 4,4
По предлагаемому
О, 18+0905.1О
О 1 100 4 8 (0,1
ГУ-ДА
6,42*0,21 "10 к
4,85 0912 1О
О,! 100 3,7 <0,1
БТ-ДА
БСА-ДА
По прототипу БТ-ДА
0 1 100 4,2 <0,1
3,41х0,14 10
17,8 100 28,4 <0,1.
В таблице приняты следующие обозначения: ГУ вЂ” гемоциайин улитки, БТ вЂ” бычий тиреоглобулин, БСА — бычий сывороточный альбумин, НА " норадреналин, ДА — дофамин, HNH — норметанефрин.
Т а б л и ц а 2 олярное соотношение белок/норадреналинр пределяемое по методу
Конъюгированный антиген
1 пектрофотометрическому измерения радиоктивности
ГУ-НА
1:5
1:7
БТ-НА
БСА-НА
1:12
1:16
1:22
I 20 таблица3 ю «м °
Титры антител и полученных с - тках
Применяемый конъюгат прототипу
По пред
1:400
ГУ-НА
БТ-НА
БСА-НА
ГУ-ДА
БТ-ДА
БСЛ-ДА
ВИИИПИ Заказ 4089/7 . Тилак 688 ПаПлиаааа
Филиал 7878 "Патеит, т.ритеред, ул.Праеитий, а
1:1600
1:3200
1:6400
1:3200
1:1600
1:3200
1:400
1:800
1:800
1:400
1:400