Способ получения производных бензо/с/хинолина или их фармацевтически приемлемых солей
Иллюстрации
Показать всеРеферат
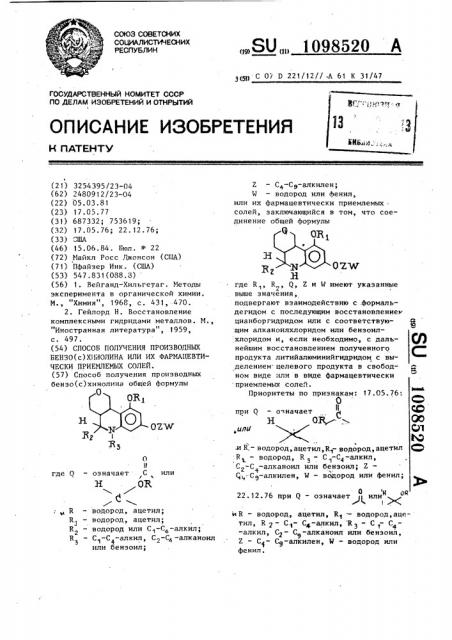
Способ получения производных бензо(с)хинолина общей формулы °- OR, 07ЛЛГ о 1Г ,с, где Q или означает .OR Н R водород , ацетил; V4 3 водород , ацетил; водород или С -С -алкил; Rj С.,-С .-алкил, С2-С4-алканоил R, или бензоил; Z - С4 С9 алкилен; W - водород или фенил, или их фармацевтически приемлемых солей, заключающийся в том, что сое;с (инение общей формулы Q7.-W где R., R И V/ имеют указанные 1 2 выше значения, подвергают взаимодействию с .формальдегидом с последующим восстановлением цианборгидридом или с соответствующим алканоилхлоридом или бензоилсо ;хлоридом и, если необходимо, с дальнейшим восстановлением полученного продукта литийапюминийгидридом с выделениемцелевого продукта в свободном виде или в виде фармацевтически приемлемых солей. 17.05.76: Приоритеты по признакам: О со при Q - означает i OG от to -И R,- водород, ацетил,RT водород, ацетил R - водород, Rj- С -С -алкил, Cj-C -алканоил или бензоил; Z Qi ,-Сд-алкилен, W - водород или фенил; 22.12,76 при Q - означает и или «. 1 хХ nR - водород, ацетил, R - водород,ацетил , R 2 С -алкил, Кз С - С.-алкил , С2- Сд-апканоил или бензоил, Z - Сд-апкилен, W - водород или фекмл.
СООЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
flO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТЪ ф " ««11 т ., 0 ZÚÊ
CO
С©
Ql
К)
Н 2
З5
OZW где ч R
R.
3 и R — -водород,,ацетил, К1 тил, R 2 — С1- С -алкил, -алкил, С2 — С9-алканоил
2 — С - С9-алкилен, Уфен *л. водород,ацеR - С - С
3 1 ф или бензоил, водород или (21) 3254395/23-04 (62) 2480912/23-04 (22) 05.03.81 (23) 17.05.77 (31) 687332; 753619; (3?) 17.05.76; 22. 12.76; (33) ША (46) 15.06.84. Бюл. 22 (72) Майкл Росс Джонсон (CIUA) (71) Пфайзер Инк. (США) (53) 547.831(088.8) (56) 1. Вейганд-Хильгетаг. Методы эксперимента в органической химии.
М., "Химия", 1968, с. 431, 470.
2. Гейлорд Н. Восстановление комплексными гидридами металлов. М., "Иностранная литература", 1959, с. 497 ° (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
БЕНЗО(с)ХПНОЛИНА ИЛИ ИХ ФАРМАПЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ. (57) Способ получения производных бензо(с)хинолинэ общей формулы
И означает С или
OR .б во,цорад, ацетил; водород, ацетил; водород или С1-С -алкил;
С -С -алкил С -С -алканоил
1 4 или бензоил;
„„SU „„1098520 А
3(1) С 07 D 221/12// .А 61 К 31/47
2 — С -Cg-алкилен;
W — водород или фенил, или их фармацевтически приемлемых солей, заключающийся в том, что соединение общей формулы г де R,,R, Q, 2 и W имеют укаэанные выше значения, подвергают взаимодействию с .формальдегидом с последующим восстановление цианборгидридом или с соответствую- I щим алканоилхлоридом или бензоилхлоридом и, если необходимо, с дальнейшим восстановлением полученного продукта литийалюминийгидридом с выделением целевого продукта в свободном виде или в виде фармацевтически приемлемых солей.
° вюй
Приоритеты по признакам: t7.05.76:
0 при () — о начает
1( м К- водород,ацетил,R — водород,ацетил
Ri — водород. R 3 С1 С4-анкилоз
С -С -алканоил или бензоил 2—
2 ф
У (j«, С «-алкилен, W — водород или фенил;
22.12.76 при Q — - означает или
0 н 0R
1 (OZ (/I7 .10 где Q означает
0 1 .г0 или
R —. водород, ацетил; — водород, ацетил;
Й2 — водород или С„-С -алкил;
R — С -С -алкил С -С -алканоил
3 1 2 4 или бензоил;
2 — С -С -алкилен.
4. У
Ж вЂ” водород или фенил
У
25 или их фармацевтически приемлемых солей, действующих на центральную нервную систему и обладающих. анальгезирующим действием.
Известен способ получения алкил или ациламинов путем взаимодействия соот ветствующего исходного амина с формаль. дегидом и последующим восстановлением цианборгидридом f13 или с алканоилили бензоилхлоридом и последующим, если необходимо, восстановлением ли- 35 тийалюминийгидридом (.2 3.
Цель изобретения — способ получения новых производных бензо(с)хинолина или их .фармацевтически приемлемых солей общей формулы(lj, обладающих 40 ценными фармакологическими свойствами .
Указанная цель достигается тем, что соединения общей формулы
45
50 л н
N где Q, R „, Н„, Е и У имеют указанные значения подвергают взаимодействию с формаль.дегидом с последующим восстановлением циа(Иоргидридо((или с состветствующим алканоил-или с бонзи(.(х;.оридом и, 55
Ф 10985
Изобретение относится к способу получения новых производньп(бензо(с) хинолина общей формулы
20 2 если необходимо, с дальнейшим восстановлением полученного продукта литий, алюминийгидридом с выделением целевого продукта в свободном виде или в виде фармацевтически приемлемых сблей.
Пример 1. d,l-транс-5,6,6аф, 7, 10, 10 0 -Гексагидро-1-ацетокси-3(2-гептилокси)-5-бензоил-6р-метилбензо(с)хинолин-9-(8Н)-он.
К d,l-транс-5,6,6(Р, 7, 10, 10ас(-гексагидро-1-ацетокси-бр-метил-3-(2гептилокси)бензо(с)хинолин-9(8Н)-ону (812 мг) в 2,5 мл пиридина добавляют
421 мг хлористого бензоила в 5 мл хлороформа при перемешивании. Спустя
2 ч реакционную смесь выпивают на
1 лед и дважды экстрагируют эфиром, Соединенные эфирные экстракты промывают водой, бикарбонатом натрия, сушат (MgS04) и фильтруют до получения после концентрирования и кристаллизации из смеси эфир/петролейный эфир
d l-транс-5, б, ба Р, 7, 10, 10ad,-гексагидро-1-ацетокси-3-(2-гептилокси)-5бенэоил-бр-метилбензо(с)хинолин-9(8Н) он; т. пл. 108-110 С. m/å 401 (m ) . Выход 290 мг., 28%.
Аналогичным образом, используя эквивалентные количества хлористого ацетила вместо хлористого бензоила и соответствующий бенэо(с)хинолин, получают d,l-тоанс-5,6,6а -7, 10, 10ас гексагидро-1-ацетокси-3-(2-гептилокси)-5-ацетил-бр-метилбензо(с)хинолин-9(8Н)-îí, m/e 433 (m+), выход количественный.
Пример 2. d,l-транс-5,6,6ар, 7, 10, 10ad-Гексагидро-1-ацетокси-5метил-бр-метил-3-(2-гептилокси) бензо(с)хинолин-9(8Н)-он.
К перемешиваемому раствору 387 мг
d, l-транс-5,6,бар-7, 10, 10аd-, гексагидро-1"ацетокси-6(З-метил-3-(2-гептилокси) бензо (с)хинолин-9(8н) †о в 3 мл ацетонитрила, охлажденному до 15 С, добавляют 0,5 мл 37%-ного о формальдегида, а затем 100 мг цианборгидрида. Уксусную кислоту добавляют для поддержания рН до завершения реакции, которое определяют по исчезновению исходного материала на тонкослойной хроматограмме. Продукт выделяют следующим образом. К реакционной смеси добавляют воду и простой эфир, эфирный слой отделяют, а водный еще раз экстрагируют эфиром. Эфирные экстракты соединяют, сушат и упаривают до получения d,l-транс-5,6,6ар7, 10, 10aoL-гексагидро-1-ацетокси-51О
Таблица 1
О
Il 3
Н (.н, z н н, 07.ЪК тп/е +
Выход, %
Z-W
СоединеТ.пл., ОС ние
/ CCHH3
-СН вЂ” (СН,),С,Н „
94-97
449
i CCHH3
-СН вЂ” (СН, ), С Н
59,9
449 Н Масло
3" " -(СН,) С,Н, ;.... Н 102-103 435
21,3
В виде НС1 соли.
Вычислено для С Нз„О N НС1, %: С 69, 19; Н 7,47; N 2,88
Найдено, %: С 68,72; Н 7,18; N 2,74
«» Вычислено для С Нз,0»И,%: С 74,80; Н 7,85; N 3,12 Найдено, %: С 74,66; Z 8,05; N 2,66
Т ° пл. 69-75 С в виде НС1 соли.
В вице НС1 соли.
Вычислено для С, Н О+И,%: С 74,45; Н 7,64; N 3,22
Найдено, %: С 73,89; Й 7,51; N 3,04
° Ф,)
Пример 3. с1,1-транс-5,6,6а 7,8,9,10,10ас -октагидро-1,9-дигидроокси-5-этил-бр-метил-3-(2-гептилокси)
1 бензо(с)хинолин.
К раствору 100 мг литийалюминий-. 50 гидрида в 5 мл сухого тетрагидрофурана (охлажденного на бане лед/вода) по каплям добавляют раствор 90 мг,d,lтранс-5,6,6ар-7,8,9,10,10аос-октагидро1,9-дигидрокси-5-ацетил-бр-метил-3(2-гептилокси) бензо(с)хинолина в
3 мг тетрагидрофураиа. После того как вс сь продукт добавлен, реакцион3 1098 метил-6(3-мс. тил-3- (2- ге и тилак с и) бензо(с)хинолин-9(8Н)-она в виде масла. Вьп:од количестнс»нный. "Н ЯМР (60 Мгц/Я)С1 ) показывает характеристическое поглощение на 2,85 (ч. на
MJIH ) для N-CH3
Аналогичным образом получают из соответствующих реагентов следующие соединения: d 1-транс-5,6,6ав,7,10, 520 4
10аа6-гексагидро-1-ацетокси-5-метил3-(2-гептилокси)бензо (с)хинолин-9(8н) он в виде масла, выход 46%; d,1транс-5,6,6ав, 7,8,9,10,10аХ-октагидро-1,9-диацетокси-5-метил-б -метил3-(2-гептилокси)бензо(с)хинолин в виде масла, m/е 445 (m+).
Следующие соединения получают подобным образом (см. табл. 1). ную смесь нагревают и кипятят с обратным холодильником в течение 1 ч и затем дают остыть до комнатной температуры. Добавляют эквивалентные количества воды с последующим добавлением 3%-ной гидроокиси калия, осадок отфильтровывают и фпльтрат концентрируют в вакууме до получения целевого продукта в виде масла, m/е 375 (m+).
Пример 4. d 1-транс-5 6 баr,,,, 7, 8, 9, 10, 10а ос-.октагилро- 1-ацетокси5 1098520 6
9-окси-5-метил-3-(5-ф нил-2-пентилокси)бензо(с)хннолин.
Формальдегид (1,1 мл 37Х водного раствора) добавляют к раствору d 1транс-5,б,бар,7,10,10ас -гексагидро- 5
1-ацетокси-3-(5-фенил-2-пентилокси) бензо(с)хинолин-9(8Н)-она в ацетонитриле (15 мл) при комнатной температуре с последующим добавлением цианоборгидрида натрия (0,262 г). Реакционную смесь перемешивают в течение 1ч, за это время рН поддерживают нейтральным, добавляя по мере надобности уксусную кислоту. К реакционной смеси добавляют дополнительное количество цианборгидрида натрия (0,262 г) и метанол (15 мл), затем ее подкисляют до рН 3, перемешивают в течение
2 ч и концентрируют при пониженном давпении до масла. Масло разбавляют водой (50 мл), рН устанавливают 9-10 с помощью водной гидроокиси натрия, щелочную смесь экстрагируют эфиром (3x200 мл). Объединенные эфирные экстракты промывают солевым раствором, сушат (MgS04 ) и концентрируют при пониженном давлении до получения прозрачного масла. Масло растворяют в смеси 50 эфир/гексан и вводят в хроматографическую колонку с силика- ЗО гелем. Вначале колонку промывают
50 смесью эфир/гексан, а затем соответственно 60, 70 и 75 смесью эфир/гексан. Элюат исследуют с помощью тонкослойной хроматографии (смесь 5 эфир 10, гексан 1), Первым полученным продуктом является d,l-транс-5,6,ба
7,10,10а -гексагидро-1-ацетокси-5метил-3-(5-фенил-2-пентилокси) бензо (с)хинолин-9(8Н)-он (0,125 г), 40
m/е 435 (m+) .
Рассчитано для С»Н 04М, "-:
С 74,45; Н 7,64; N 3,22
Найдено, : С 74,06; Н 7,77;
N 3,31 45
Вторым продуктом является 9Ы;окси-диастереомер указанного соединения (25 мг), m/å 437 (m+).
Рассчитано для С» Н э О,М, :
С 74,11; Н 8,06; N 3,20
Найдено, Х: С 73,96; Н 8,34;
N 3,00
Третьим продуктом является 9р-окси-диастереомер указанного соединения (0,7 г), m/е 437 (m+) . ,цля С Н О М,%:
С 74,11; Н8 06; N3,20
Найдено, : С 73,56; H 7,86;
N 3,21
Аналогично d, 1-транс -5, б, ба р, 7, 10, 10ас(-гекса-гидро-1-ацетокси-3(2-гептилокси)бензо(с)хинолин-9(8Н)он обрабатывают цианборгидридом натрия, в результате чего получают
d, 1-транс-5,6, бар,7,10,10ао -гексагидро-1-ацетокси-5-метил-3-(2-гептилокси) бензо(с)хинолин-9(8Н)-он в виде масла, m/е 387 (m+), выход 46Х °
ИК (СНС1,): 5,80 (кетон С=О);
5 65 (С=О в сложном эфире).
Рассчитано для С;зН3 04N, :
С 71,29; Н 8,58; N 3,61
Найдено, Х: С 70,78; Н 8,71;
N 3,27
d,1-транс-5,6,6ар, 7,8,9, 10,10а4;
Октагидро-1-ацетокси-9р-гидрокси-5метил-3-(2-гептилокси)бензо(с)хинолин в виде масла, m/е — 389 (m ), выход 72Х.
ИК (CHCl ): 2,80 (О-Н); 5,70 (С=О, сложный эфир) (рассчитано для
С Н 04,N,Х: С 70",92; Н 9,06;
N 3,60; найдено,X: С 70,56; Н 8,95;
N 3,56) и d,l-транс-5,6,6ар,7, 10,10ad гексагидро-1-ацетокси-бр-метил-3(5-фенил-2-пентилокси)бензо(с)хинолин.
9(ЗН)-он превращают в d,l-транс-5,6, бар,7, 10, 10aoL-гексагидро-N-ацетокси5-метил-6р-метил-3-(5-фенил-2-пентилокси)бензо(с)хинолин-9 (ЯН)-он, выход 23, d,l-транс-5,6,6ар,7,8,9, 10,10М-октагидро-1-ацетокси-9р -ãèäрокси-5-метил-68-метил-3-(5-фенил-2пентилокси)бензо(с)хинолин, который выделяют в виде хлоргидрата, т.пл.
163-165 C, m/е 45 1 (m+), выход 18Х.
Пример 5. d,l-транс-5,6, бар,7,10,10aoL-Гексагидро-1-ацетокси6-изобутирил-3-(5-фенил-2-пентилокси) бензо(с)хинолин-9(8Н)-он.
Раствор хлористого изобутирила (114 мг, 1,07 ммоль) в хлороформе (20 мл) постепенно добавляют при перемешивании к раствору d,i-транс5,6,бар,7,10,10аЫ-гексагидро-1-ацетокси-3-(5-фенил-2-пентилокси)бензо(с) хинолин-9(8Н)-она (450 мг, 1,07 ммоль. в сухом пиридине (1,5 мп) при 0 С в атмосфере азота. Реакционную смесь перемешивают в течение 5 ч и затем выливают в смесь лед/вода (50 мл).
Слой хлороформа выделяют и водную фазу экстрагируют хлороформом (2х20 мп).
Экстракты хлороформа соединяют и промывают 10Х-ной соляной кислотой (2х10 мл), затем солевым раствором (1х10 мл) и затем сушат (,TgS04). Пос7 10985 ле концентрирования хлороформного раст-. вора в вакууме получают желтое масло, которое при стоянии отверждается.
Растирание твердого продукта с гексаном дает белое кристаллическое вещест-1 во, которое выделяют фильтрованием и сушат (400 мг), т.пл. 128-129 С. Концентрирование фильтрата гексана дает
121 мг масла.
Пример 6. d,1-транс-5,6,6ар, 10
7,8,9, 10, 10aoL-октагидро-1-ацетокси-9ргидрокси-5-изобутирил-3-(5-фенил-2пентилокси)бензо(с)хинолин.
Боргидрид натрия (38 мг, 1,0 ммоль) медленно добавляют к раствору d 1транс-5,6,6аp,7,10,10ас -.гексагидро- I ацетокси-5-изобутирил-3-(5-фенил-2пентилокси)бензо(с)хинолин-9(8Н)-она (260 мг, 0,529 ммоль) в абсолютном этаноле. (20 мл) при 5-10 С в атмосфе- 20 ре азота. Реакционную смесь перемешивают в течение 1 ч и затем подкисляют 10Х-ной соляной кислотой.. Этанол удаляют концентрированием при пониженном давлении. Добавляют 10 мл воды 25 к оставшемуся раствору, который затем экстрагируют этилацетатом (2x50 мл).
Экстракты соединяют, промывают солевым раствором и сушат (MgSOq). После концентрирования в вакууме получают указанное соединение в виде твердого аморфного вещества (213 мг), которое используют без дальнейшей очистки.
Пример 7. d,l-транс-5,6,6ар, 7,8,9, 10,10aoL-Октагидро-1,9р-äèàöåòокси-5-изобутил-3-(5-фенил-2-пентилокси)бензо(с)хинолин.
В атмосфере азота раствор d,lтранс-5,б,бар, 7,8, 9, 10, 10аЫ-октагидро-1-ацетокси-9р-гидрокси-5-изобути4О рил-3-(5-фенил-2 — пентилокси) бензо(с) хинолина (213 мг, 0,432 ммоль) в тетрагидрофуране (5 мл) добавляют к взвеси литийалюминийгидрида (110 мг, 2,6 ммоль) в тетрагидрофуране (5 мл)
45 при комнатной температуре. Смесь перемешивают в течение ночи и затем добавляют воду (0,1 моль), 15Х-ный раствор гидроокиси натрия(0, 1 мл) и воду (0,3 мл). Затем отфильтровывают в
50 атмосфере азота и оставшийся фильтрат промывают тетрагидрофураном (2х5 мл). Соединенные фильтрат и промывной раствор концентрируют до красноватого масла (О, 174 r), которое растворяют в атмосфере азота в пиридине (1 мл), и полученный раствор охлаждают до ООС. Добавляют уксусный ангидрид (1 мл) при перемешивании
20 к пиридиновому раствору и реакционную смесь перемешивают в течение 30 мин при ООС. Затем ее выливают в воду (25 мл) и экстрагируют этилацетатом (Зх25 мл). Экстракты соединяют, промывают солевым раствором, сушат (MgS0<) и концентрируют до коричневого масла (184 мг). Масло сразу продувают азотом и хроматографируют на силикагеле (49 г), используя в качестве элюирующего растворителя смесь бензол/ эфир (9: 1). Собирают фракции по 10 мп каждая. Фракции 2 — 10 соединяют и концентрируют до масла (109 мг), m/å 521 (m+).
Рассчитано для C> Н О N,X:
С 73,67; Н 8,31; N 2,68
Найдено, Х: С 74,33; Н 8,89;
N 2,23
Н ЯИР (60 МГц) d"csee (ч. на млн)
Тнс
7,22 (с, 5Н, ароматика); 6,05 (д, 1Н, 3 ароматика); 5, 90 (д, 1Н, ароматика);
4,90 (бс. 1Н); 4,30 (бс. 1Н); 3,10 (д, 2Н, N-СНз); 2,90 (д, 2Н, N — СН);
2, 70 (бс, 2Н); 2,40 и 2,15 (с, 6Н, 2-СН,-СОО-); 1,85 (бс, 2Н, Н g и Нр);
1,15 (м); 1,05 (д, 6Н -СН-ГНi) .
1,0-3,0 (перем. остальные протоны).
Пример 8. (2 R, 6 S, ба Н, 9 R, 10a R) (-) - l -Лцетокси-5, ба, 7, 8,9, 10, 10а-октагидро-9-окси-5,6-диметил-3-(5-фенил-2-пентилокси)бенэо(с) хинолин.
К перемешиваемому раствору 1,0 r (0,0021 моль) (2 R, 6S, бай, 9R, 10aR)-(-)-1-ацетокси-5,6,6a,?,8,9, 10,10а-октагидро-9-окси-б-метил-3(.5-фенил-2-пентилокси)бензо(с)хинолингидрохлорида в 30 мл CHCl добавляют
30 мл насыщенного раствора NaHCG u з перемешивают полученную смесь при комнатной температуре в течение 5 мин.
Органическую и водную фазы разделяют и из водной проводят реэкстракцию
Ф
20 мл СНС1. Объединенные хлороформные экстракты высушивают над сульфа том магния, фильтруют и растворитель отгоняют в вакууме., В результате г пучают свободное основание в виде бесцветной пены.
Полученную пену растворяют в
40 мл тетрагидрофурана и смешивают раствор с 1,0 г 5Х-ного палладия на угле-, 1,05 мп (0,018 моль=8,7 эквивалента) ледяной уксусной кислоты и
15,8 мп (0,20 моль=100 эквивалентам)
37Х-ного водного раствора формальдегида. Смесь помещают в аппарат Парра
9 1098520 и проводят гидрогенизацию при давлении 3 5 кг/см в течение 50 мин. Катализатор отфильтровывают через слой диатомовой земли, промытой этилацетатом. Фильтрат разбавляют до 150 мл 5 ! этилацетатом, промывают последовательно трижды насьпценным раствором НаНСО, (порциями по 100 мл), трижды водой 6 (порциями по 75 мл) и 75 мл рассола, а после чего высушивают над сульфатом 10 м магния. Раствор фильтруют, после, б чего растворитель отгоняют в вакууме, В результате получают желтую ( вязкую маслянистую жидкость, которую подвергают-хроматографическому раз- 15 4 делению на колонке, заполненной 50 г силикагеля с размером частиц 0,040,63 мм, используя в качестве элюента смесь толуола и эфира в соотношен нии 1: 1. Близкие по составу фракции объединяют, растворитель отгоняют в 5 вакууме, получая в результате бесцветную маслянистую жидкость, которую растворяют в 50 мл эфира. Через раствор при перемешивании пропускают в 25 атмосфере азота сухой НС1. Выпавший э белый осадок отфильтровывают в атмосэ фере азота, высушивают в вакууме (О, 1 мм рт.ст.) в течение 24 ч при комнатной температуре и получают
0,45 r (44X от теоретического выхода) целевого соединения. Т.пл. 90-95 C (d)
ЯМР (CDC1,) 2,73 ppm, singlet, ЗН. (N-СН, ) .
ИК (KBr) 4,25 р -NH Cl
5,61(-О-С-СН ) .
Jl
О
Рассчитано, X.: С 68,90; Н 7,85;
N 2,87
Найдено, 7.: С 68,60; Н 7,92;
N 2,77 (оЦ =-73 (.С, 1,0,метанол) .
Масс-спектрометрия m/e = 451 (ш )
Аналогичным образом могут быть получены следующие соединения
d,1-1-Ацетокси-5,6,бар,7,8,9, 10, 10ас -октагидро-9б-окси-5,6р-диметил3-(1,1-диметилгептил)бензо(с)хинолин50 гидрохлорид.
Т. пл. 129-130 С (d); m/е = 415 (m
100X) . О
ИК (КВГ) 5,6 7 М. (— С вЂ” СН ).
d, 1-1-Ацетокси-5, 6, бар, 7, 8, 9, 10, 10ййоктагидро-9р-окси-5-метил-бр-нбутил-3-(5-фенил-2-пентилокси)бензо(с) хинолин гидрохлорид.
Т.пл. 106-108 С, m/е -- 493.
С31 Н4 О Н НС1
Рассчитано, 7.: С 70,21; Н 8,37;
N 2,6
Найдено, X.: С 71 02; Н 8,43;
N 2,6
Пример 9. Получение d 1-5,,баj,7,8,9d,10,10ad-октагидро-1— цетокси-5-бензоил-9-бензоилокси-6P-. етил-3-(1-метил-4 — феыилбутокси) ензо(с)хинолина.
Перемешиваемую суспензию 47,4 r
О, 10 моль) d,) -5,6,6ар,7,8,9,10, ОаЫ-октагидро-бр-метил-3-(1-метил-фенилбутокси)бензо(с)хинолингидролорида в 500 мл СНС1 в атмосфере зота охлаждают до 0 С и обрабатыо ают последовательно 250 мл пиридиа, а затем раствором 58 мл
0,50 моль) хлористого бензоила в
00 мл хлороформа. Образующийся гомоенный раствор кипятят в течение часа а паровой бане с обратным холодильиком, выливают реакционную смесь на змельченный лед и проводят из нее кстракцию хлороформом. Органические кстракты объединяют, промывают послеовательно водой (дважды, порциями о 500 мл), 10Х-ным раствором соляной ислоты, 500 мл насыщенного раствора икарбоната натрия и 500 мл насьпценого рассола, высушивают над МдБОЧ, фильтруют и концентрируют. В результате получают 119 г желтоватой маслянистой жидкости. После хроматографии на 2000 г сипикагеля с использованием в качестве элюента смеси зтилацетата (20X) и циклогексана получают 50,5 г (78X от теоретического выхода) d,l5,6,6аА,?,8,9о,10,10ас(-октагидро-1ацетокси-5-бензоил-9-бензоилокси-6— метил-3-(1-метил-4-фенилбутокси)бензо (с)хинолина. Т.пл. 125-130 С.
C %1H4306N, Рассчитано, X: С 76,24; Н 6,72;
N 2, 17
Найдено, 7; С 76,35; Н 6,92;
N 2,19
Разделение d,1-5,6,6ар, 7,8,9о(, 10, 10аа -октагидро-1-ацетокси-5-бензоил9-беизоилокси-бр-метил-3-(1о(-метил-4фенилбутокси)бензо(с)хинолина и
d,1-5,б,бар,7,8,9с(, 10, 10ас(;октагидро1-ацетокси-5-бензоил-9-бензоилоксибР-метил-3-(1р-метил-4-фенилбутокси) бензо(с)хинолина.
После перекристаллизации 50,5 г
d,1-5,6,6ар,7,8,9Ж,10,10ас(-октагидро1098520
1-ацетокси-5-бензоил-9-бензоилоксибр-метил-3-(1-метил-4-фенилбутокси) бензо(с)хинолина из 2л 2-пропанола получают 23,8 г белого твердого материала с т.пл. l36-138 С, который дваж-5 ды перекристаллизовывают из 2-пропанола, а затем из ацетонитрила. В результате получают 5,7 r d,1-5,6,6ая,7,8, 9,10,t0ao(-октагидро-1-ацетокси-3бензоил-9-бензоилокси-6Р-метил-3-(1р- 10 метил-4-фенилбутокси)бензо(с)хинолина.
Т.пл. 148-149 С.
Фильтрат после первой перекристаллизации d,1-5,6,6ар,7,8,9,10, 10аЫ-октагидро-1-ацетокси-5-бензоил-9-бензоилокси-6 -метил-3-(1-метил-4-фенилбутокси)бензо(с)хинолина из 2-пропанола упаривают до образования белой пены, которую растирают с 500 мл эфира.
В результате получают 12,9 г твердого 20 белого материала с т.пл. 129-132 С, который еще дважды растирают с эфиром и получают 3,8 г d,1-5,6,6ар,7,8,94, 10,10ас -октагидро-1-ацетокси-5-бензоил-9-бензоилокси-бр-метил-3-(1Ы-метил- 5
4-фенилбутокси)бензо(с)хинолина.
Т. пл. l 39-141 С.
Получение хлористоводородного d,.1—
5,6,6ар,7,8,9, 10, 10aa(-октагидро-1ацетокси-9-окси-6 -метил-3(1р-метил- 30
4-фенил-бутокси)бензо(с)хинолина.
К перемешиваемому раствору алюмогидрида лития 2,0 г (5,3 моль) .в
150 мл тетрагидрофурана добавляют в атмосфере азота по каплям в течение
5 мин раствор 5,7 г (8,8 моль) d,15,6,6ар, 7,8,9, 10, 10ас -октагидро-1ацетокси-5-бензоил-9-бензоилокси-брметил-3-(ip метил-4-фенилбутокси)бензо(с)хинолина в 1 t2 мл тетрагидрофу- 40 рана. Образующийся раствор кипятят в течение 45 мин с обратным холодильником, охлаждают и осторожно выпивают на охлаждаемую льдом смесь 1125 мп
53-ного водного раствора уксусной 45 кислоты, 2250 мл эфира. Двухфазную смесь перемешивают в течение 10 мин, после чего фазы разделяют. Из водного слоя дополнительно проводят экстракцию 500 мл эфира. Объединенные эфирные экстракты промывают последовательно водой (трижды, порциями по
500 мл), насыщенным раствором бикарбоната натрия (дважды, порциями по
500 мл) и 500 мл насыщенного рассола 55 высушивают над MgSO<, фильтруют и упа. ривают. В результате получают 5,4 г
d, 1-5-бензил-5,6,6ар, 7, 8, по, 10, 10aatоктагидро-1,9-диокси-бр-метил-З-(1 Ьметил-4-фенилбутокси)бензо(с)хинолина в виде маслянистой жидкости с фиолетовым оттенком.
Полученный d,1-5-бензил-5,6,6ар, 7,8,9d, 10, 10аа-октагидро-1,9-диокси68-метил-3-(t/3-метил-4-фенилбутокси) бензо(с)хинолин сразу растворяют в
450 мл метанола и подвергают гидрогенизации при атмосферном давлении в течение 3 ч в присутствии 4,27 r палладия на угле. После окончания гидрогенизации катализатор отфильтровывают и метанол отгоняют. В результате получают d 1-5,6,6а/3,7,8,М,10, 10ad-октагидро-1,9-диокси-6р-метил3-(1 -метил-4-фенилбутокси)бензо(с)хинолин
Полученный d,1-5,6,6ар,7,8,9с(,10, 10ас(;октагидро-1,9-диокси-бр-метил3-(ip-метил-4-фенилбутокси)бензо(с)хинолин сразу растворяют в 210 мл метиленхлорида, охлаждают раствор в атмосфере азота до 0 С и обрабатывают
его последовательно 1,35 мл триэтиламина, 1, 19 г (9,7 ммоль) 4-диметиламинопиридина и 0,834 мп (8,8 ммоль) уксусного ангидрида. После перемешивания в течение 30 мин реакционную смесь выливают в 250 мл воды и органический слой отделяют. Из водной фазы проводят экстракцию метиленхлоридом, объединенные метиленхлоридные экстракты промывают последовательно насыщенным раствором бикарбоната натрия (дважды, порциями по 150 мл), один раз 150 мл воды и насыщенным рассолом, высушивают над MgSOy, фильтруют, упаривают и подвергают остаток хроматографическому разделению на ко-лонке, заполненной 300 г силикагеля с использованием в качестве элюента смеси эфира (33X) и толуола. В результате получают 1,4 г хлористоводородного d,1-5,6,6ае5,7,8,9+,10,10ао(;октагидро-1-ацетокси-9-окси-6 -метил-3(-АЗ-метил-4-фенилбутокси)бензо(с)хинолина в виде свободного основания. После обработки его газообразным HCl, фильтрации и растирании в ацетоне получают 795 мг хлористоводородного
d, I-5,6,6ар,7,8,92,10,i0аd-октагидро1-ацетокци-9-окси-6я-метил-3-(1ф-метил-4-фенилбутокси)бензо(с)хинолина.
7.пл. 213-2 15 C после- фильтрации и растирания в ацетоне, m/е 437 (m, 100X).
С2еНЭ О
Рассчитано, Ж: С 68,42; Н 7,66;
N 2,96
1098520
Найдено, 7: С 68 48; Н 7 63;
N 3.05
Аналогичным образом, исходя из
d,1-5,6,баф,7,8,9g, 10,10ап -октагидро"
1-ацетокси-5-бензоил-9-бензоилокси- 5
6Р-метил-3-(1о -метил-4-фенилбутокси) бензо(с)хинолина (3,8 г), получают
1, 1 r d, 1-5, 6, ба, 7, 8, 9о4, 10, 10апт -октагидро-1-ацетокси-9-окси-бя -метил3-(Ы-метил-4-фенилбутокси)бензо(с)хы
10 нолин гидрохлорида.
Т.пл. 202-205 С (d), m/е = 437 (.!007, m+), С „Н 04И НС1
Рассчйтано, 7: С 68,42; Н 7,66;
N 2,96
Найдено, 7.: С 68,20; Н 7,56;
N 3,04
Пример 10 ° d,1-транс-5,6, бар, 7, 10, 10ап(-Гексагидро-1-ацетокси- >0
5-ацетил-бтра-метил-3-(5-фенил-2-пентилокси)бенэо(с)хинолин-9(8Н)-он.
3,49 r (0,008 моль) d 1-транс-5,6, ба,7,8,9, 10, 10ао -октагидро-1-ацетокси-бр-метил-3-(5-фенил-2-пентилокси) бензо(с)хинолин-9(8н)-она растворяют, в 20 мл хлороформа беэ примесей спирта, раствор охлаждают на водно-ледяной бане и добавляют к нему 14 мл ттиридина (высушенного над гранулиро- 30 ванным гидратом окиси калия), а затем
0,95 мл (0,013 моль) хлористого ацетила, растворенного в 5 мл хлороформа.
Гомогенный раствор перемешивают затем при температуре окружающей среды в теЗ5 чение 18 ч. После этого реакционную смесь выпивают на смесь воды и льда и дважды проводят из нее экстракцию хлороформом порциями по 25 мл. Объединенные органические экстракты про-40 мывают последовательно 25 мл,насыщенного раствора бикарбоната натрия, 25 мл воды, 25 мп рассола, высушивают над сульфатом магния, фильтруют и упаривают досуха при пониженном давлении. Очистку проводят с помощью хроматографии на силикагеле (200 г, марки Brinxman), используя в качестве растворителя смесь циклогексана и эфира в соотношении 3: 1. В резуль- 50 тате получают 2,20 г (83,87 от теоретического выхода) целевого соединения.
С 9 Н О М
Рассчитано, Ж: С 72,90; Н 7,39;
N 2,80
Найдено, 7: С 72,69; Н 7,48;
N 2,49
14
ИК (КВг): 290р(п ); 3, 38рт(я);
3 48+(s); 5,62р»(в) 5,78р»(я);
6,00р(в); б, 154(s) 6,30р»(я), m/е 477 (тп*). Н ЯМР (60 МГц), сг . 7,20 (m
5Н, аромат.); 6,53 (d, 1Н, С,); с003
6,39 (d, 1Н, C4); 4,71-4,08 (m, 2Н,, метин); 2,29 (в, ацетат М .); 2,02 и
2,04 (2s, ЗН, амид Me); 1,25 и 1,23 (2d, ЗН, С», Me); 1,12 (d, ЗН, боковая цепь, Me); 3,20 — 1,36 (меняющиеся остаточные протоны).
Аналогичным образом из d,1-цис-5, б,бар,7,10ар-гексагидро — 1-ацетоксиб -метил-3-(5-фенил-2-пентилокси)— бензо(с)хинолин-9(8Н)-она получают
d,1-цис-5,6,6ар,7,10ая-гексагидро l àöåòîêñè-5-ацетил-6р-метил-3-(5фенил-2-пентилокси)бензо(с)хинолин-9(8Н) -он.
Т.пл. 125-128 С. Вьжод 827.
С29 Н 350Р
Рассчитано, Ж: С 72,90; Н 7,39;
N 2,80
Найдено, 7: С 72,80; Н 7,35;
N 2,70
"Н ЯМР (60 МГц),У0 . 7,22 (тп, 5Н, аром.); 6,55 (2d, 2Н; С и С );
5,02 — 4,62 (m, 1Н, С», метин); 4,524,12 (m, 1Н, боковая цепь, метин);
2,28 (s, ЗН, ацетат Ме); 2, 11 и
2, 13 (ЗН, амид Me); 1,26 и 1,28 (ЗН, C Me); 1,22 (d, ЗН, боковая цепь Me); 3,42-1,65 (меняющиеся остаточные протоны).
ИК (KBr): 2,95pa(w); 3,43,4(в);
5,65/»(s); 5,81т»(в); 6,02р»(я);
6, 16,т» (в); 6,32,т»(я); 6,70/с(в): тп/е 477 (m+) .
Тесты термического ноцептивного раздражения.
Испытание анальгезирующего действия на мышей с помощью горячей пластины.
К лапкам мышей .прикладывают алюминиевую,пластину толщиной 1/8п (3, 1 мм), являющуюся регулируемым источником тепла. Инфракрасный рефлектор (250 Вт) помещают снизу алюминиевой пластины. Терморегулятор в виде термистера, расположенного на поверх ности пластины, регулирует нагрев лампы таким образом, чтобы поддерживать постоянную температуру пластины 57 С. Каждую мышь помещают в стеко лянный цилиндр (61/2/155 мм в, диаметре), основанием которого служит алюминиевая пластина, и отсчет времени на1098520
16
15 чинают с того момента, когда лапки мыши прикасаются к пластине. Спустя 0,5 и 2 ч после обработки тестовым соединением наблюдают за первым конвульсивным движением одной или обеих задних 5 лапок или до установления интервала
10 с между этими движениями, Доза морфина МРЕ=4-4,5 мг/кг. МРЕ=МВЭ (максимальный возможный эффект).
Испытание анальгезирующего действия на мышей по взмахам их хвостов.
Каждую мышь помещают в удобно подогнанный металлический цилиндр так, чтобы ее хвост высовывался из одного конца цилиндра. Цилиндр устанавливают таким образом, чтобы хвост плоско лежал над экранированной лампой, являющейся источником тепла. В начале испытания удаляют алюминиевый экран над лампой, чтобы пучок света проходил через щель и фокусировался на кончике хвоста. Одновременно включают таймер. Определяют время возникновения конвульсивного движения хвоста.
Мыши, не подвергнувшиеся предварительной обработке, обычно реагируют спустя 3-4 с после экспозиции света лампы. Максимальный срок для защиты
10 с. Каждую мышь подвергают испытанию спустя 0,5 и 2 ч после обработки ЗО морфином и тестовым соединением. Доза морфина МВЭ,> 3,2-5,6 кг/кг.
Тесты химического ноцептивного раздражения.
Подавление болевого синдрома, вызванного фенилбензохиноном.
Группы из 5 мышей 5 Carworth Fàràa
CF-1 предварительно обрабатывают путем подкожного или орального введения с физиологическим раствором морфина, кодеина или тестового соединения.
Спустя 20 мин (при подкожном введении) или 50 мин (при оральном введении) кажду группу подвергают внутрибрюшинной инъекции фенилбензохинона, которь1й вызывает абдоминальные сокращения. Спустя 5 мин после инъекции возбудителя мышей наблюдают в течение
5 мин и фиксируют наличие или отсутст вие конвульсивных сокращений. Определяют действие предварительно введен-, ного препарата в дозе МВЭ на.подавso ление конвульсивных сокращений.
Результаты текстов выражают в процентах максимально возможного эфира (X МВЭ) и для каждой группы статистически сопоставляют с 7. МВЭ контроль: ного и предварительно обработанного животного, 7. МВЭ вычисляется следующим образом: тестовое время— контрольной время
7. МВЭ х 100 время отсечки контрольное время
1098520
С> Ж л л
T л
f I О о сс1 Q л л ° о v О л сс1
О сч л л с О л е о л
1 сЛ о сч о сч л л а с л о с ,л О с 3 ч— о л л л
o o
: С4
Ю с о о o o о
СО
<:Ь
co o o о л о л co o с> с4 со о л л л о с о л
t и и u u u х х х х х
cd td tlj ф сц а
u u u u ж х ж
Ф щ ф щ
О а . О О, & х
0 о г 4Ч х х ь о х х
u v х х
v v л х о
<ч и х х и и х х
o v х
u u х о
< 4
ln о х щ и х и х
x D и х х ,и ср
o u х
o u ъГ х х
v .o
Щ
Е о
О
tf х х о
Г- о
Ц о о х э о
В
v х о о х .
u v х
v о х
o u
<1 х о о х х
v u хD И л с»
М о
И й
ФЪ гс х х и х х
O D х о х х о х х х
o o x
4 (» и о х
Ф
Ж
М с6 х и о х о х
v v
o o
u o х х х х
v o o v о о о о о х v v u и о х и х
Щ
Ef x я о
О &
Щ (1) О, Qj tf Oi
C ,с) с» II а .d
Ц !.1
1 1
CY
Ж Рч ц
a (x ф (ф х и о и
X х .8 а х о
У х о о х х х х ь
Я о v о о о о х o
Г ч- C J х х
v и (\ 4 1 х х
u u х х
o v х
О о
С» х х о
/ и х о х и х и
Ф с„ (» ."и
t(6
1О f» д
au C о ох х ю
Х и
1 р х ц х х Й о и х А)х ж с Ф
Х»Р о ах
Р1 Х О, х о о
Ф М
1о Г Ц х
Ю Q) Э
° 9 Е
1098520
19
I о о
P 1 е»
Х 1 Л 1
t
1
I О о о
ill л о о
n I ь л о о л л о с
А о сч а
1
I
1-1 с6 о г
v u v u v v v v v ж х ы ж x x x x ж сС! С! cCI cCI e ctt ca cII V ctt а а а а а а а а х
1
11 г- М х
ClI In
u o х" х
o o х х
o o г г ч г г г г- г х х х
IA ЮС Ю
o o o v х х х х
o u o
o v o u
1
1 2»
1
1
1
Г 1
° I с»
И е и х х
v u х х
u u
М М М 11 Г1 М х х х х х х х u o u o x v v м м х х
u u
04
1
1
I м м 11 \1 х х х х
v o u o v о о о о о х и х о v v vх х
v о о о о х о и
IC! сс!
В
И а е
Ф C( с» ж
v u о о о о о о г о о л м м Х х х х
О n n u О U о х х о о о
U О U О О О
III СС1 Щ х х х
° Ф Ф Ю
o o o ач . сч сч х х х с
o v u
» / Ф,ф
m м 11 р х х х
u u o / х х х х v
u u o
21
1098520
Составитель Н. Нарышкова
Редактор О. Колесникова Техред М,Кузьма Корректор M. Шароши
Заказ 42?8/46 Тираж 410
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Подписное
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4
В таблицах 2 и 3 приведены данные испытаний, анальгезирующая активность здесь выражена в единицах МВЭ, т.е. в дозе, при которой в данном испытании достигают половины возможного мак. 5 симального эффекта.
Соединения являются активными, анальгезирующими средствами как при оральном, так и при парэнтеральном введении, и их вводят обычно в составе композиций. Такие композиции включают фармацевтические носители, выбранные исходя из способа приема и на основании общепринятой фармацевтической практики. Например, их мож- 15 но вводить в виде таблеток, пилюль, порошков или гранул, содержащих такие добавки, как крахмал, молочный сахар, некоторые сорта глины и т.д.
Их можно вводить в виде капсул в 20 смеси с такими же или эквивалентными
-добавками; в виде суспензий, растворов, эмульсий, сиропов для орального введения и элексиров, которые могут содержать отдушки и окрашивающие 25 агенты. Для орального введения .терапевтических агентов пригодны таблетки и капсулы, содержащие 0,01
100 мг.
Назначается доза, наиболее под- зо ходящая для конкретного пациента, зависящая от возраста, веса и восприимчивости больного и от .способа приема. Обычно, однако, начальная анальгезирующая доза для взрослых 0,01500 мг в день для разового приема или разделенная на части. Во многих случаях нет необходимости превышать дозу 100 мг в день. Наиболее подходящей дозой являетея доза около 0,01 в щ
300 мг/день, предпочтительной около
О, 10-50 мг/день, наиболее подходящей при парэнтеральном введении около
0,01-100 мг/день, наиболее предпочтительной около 0,01-20 мг/день.
С помощью указанных методов определяют анальгезирующую активность некоторых предложенных и известных соединений.
Предложены также фармацевТические композиции, включающие единичную дозу, пригодные для использования указанных соединений в качестве анальгезирующих препаратов.
Доза может быть как для отдельного приема, так и разделенной на несколько частей для достижения дневой дозы эффективной для конкретного применения.
Соединения (лекарства) могут быть приготовлены в твердой или жидкой форме для орального или парентерального введения. Капсулы, содержащие препараты по изобретению, а именно соединения формул I, получают смешивая 1 вес.ч препарата с 9 ч наполнителя, например крахмалах, молочного сахара, а затем помещая смесь в желатиновую капсулу так, чтобы каждая капсула содержала 10 ч смеси. Таблетки, содержащие соединения по изобретению, получают запрессовывая соответствующие смеси лекарственного препарата и стандартных ингредиентов, применяемых при изготовлении таблеток, например крахмал, связующая смазка так, чтобы каждая таблетка содержала 0 01100 мг лекарственного препарата в каждой таблетке.
Суспензии и растворы этих препаратов, особенно тех, у которых OR(является гидроксилом, обычно приготавливают непосредственно перед употреблением для того, чтобы избежать нестабильность лекарства (например, окисления) или суспензии или раствора (например, выпадения в осадок) препарата при хранении. Композиции, пригодные для этой цели, обычно являются сухими твердыми композициями, которые растворяют
1 для использования в виде инъекций..
Таким образом, предложенный способ позволяет получить новые производные бензо(с)хинолинов общей формулы I обладающие ценными фармакологически ми свойствами.