Способ получения производных пиридилаллиламина или их солей, или их смеси циси транс-изомеров, или индивидуальных изомеров
Иллюстрации
Показать всеРеферат
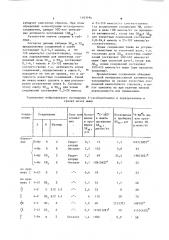
Способ получения производных пиридилаллиламина общей формулы. (1) :х: где R - водорбд или метил; X - хлор в положении 3, 4 или 2 и 4, бром в положении 2 или 3, в положении 4, йод в положении 4, или их солей, или их смеси циси транс-изомеров, или индивидуальных изомеров, о тли чающийся тем, что соединение общей формулы (Ц) CiHdHzCii W где X имеет указанное значение, .подвергают взаимодействию с соедйненигм обшей Формулы (Ш) dH. X НК: Е оо 1 где R имеет указанное значение, .Е с последующим вьщелением целевого . продукта в свободном виде,или в виде соли, или смеси циси транс-изомеров , или индивидуальных изомеров.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИН
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ
В(. РСВК36...;
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1 Я»
К IlATEHTY б
1 (4абкгб1
3 бя z З н бн,м
Р. (21) 3306852/23-04 (РСТ) SE 80/00286 (22) 15.07.81 (14. 11.80) (31) 7909514-7 (32) 16. 11.79 (33) Швеция (46) 15.07.84 Бюл. Ф 26 (72) Томас Хегберг, Томас де Паулис, Сванте Бертил Росс и Карл Бенгт Иоган
Ульфф (Швеция) (71) Астра Лэкемедель Актиеболаг
-(lllBeqHs) (53) 547.822.7(088.8) (56) 1. Бюллер К., Пирсон Д. Органические синтезы. М, 1973, ч. 1, с. 504-507.
2. Патент США У 4186202, кл. 424-263 опублик. 1980.
3. Патент Бельгии Ф 781105, кл. С 07 D 213/24, опублик. 1976., (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРИДИЛАЛЛИЛАМИНА ИЛИ ИХ СОЛЕЙ, ИЛИ ИХ
СМЕСИ ЦИС- И ТРАНС-H30NEPOB ИЛИ ИНДИВИДУАЛЬНЫХ ИЗОМЕРОВ. (57) Способ получения производных пиридилаллиламина общей формулы.(1) „SU„„»0 4 А
З(д) С 07 D 213/38 // A 61 K 31/44 где Й вЂ” водорбд или метил;
Х вЂ” хлор в положении 3, 4 или
2 и 4, бром в положении 2 или 3, фтор в положении 4, йод в положении 4, или их солей, или их смеси цис- и транс"изомеров, или индивидуальных . изомеров, отличающийся тем, что соединение общей формулы (Ц) где Х имеет указанное значение," .подвергают взаимодействию с соединениам обшей Формулы (Ш) где R имеет указанное значение, с последующим выделением целевого продукта в свободном виде,или в виде соли, или смеси цис- и транс-изомеров, или йндивидуальных изомеров.
1103794
Изобретение относится к способу получения новых производных пиридилаллиламина, общей формулы
1 быз Н " Н2Б (i-) 10! бНбН2(-"1
45 где X имеет указанное значение, подвергают взаимодействию с соедине" нием общей формулы
50 (9) (!Н
НН
В. где 12 имеет укаэанное значенйе, с последующим выделением целевого 55 продукта в свободном виде или в виде соли, или смеси цис- и транс-изомеров, или индивидуальных изомеров. где R — водород или метил; — хлор в положении 3, 4 или
2 и 4, бром в положении 2 или 3, фтор в положении 4, йод в положении 4„ 15 или их солей, или их смеси цис- и транс-изомеров, или индивидуальных изомеров, обладающих антидепрессивной активностью, которые могут найти применение в медицине. 20
Известен способ получения вторичных или третичных аминов путем взаимодействия первичных или вторичных аминов соответственно с галоидными алкилами 1 1 1. Реакцию обычно проводят в присутствии органического растворителя, если необходимо, при нагревании.
Цель изобретения — разработка(на основании известного метода) способа 30 получения новых производных пиридилаллиламина, обладающих антидепрессивной активностью.
Указанная цель достигается тем, что согласно способу получения производных пиридилаллиламина общей формулы (1) или их солей, или их смеси цис- и транс-изомеров, или индивидуальных изомеров соединение общей формулы 40
Процесс можно проводить в среде инертного органического растворителя.
Пример 1. Оксалат (Z) 3-(4хлорфенил)-N,N-диметил-3-(3-ниридил)—
-алилламина, Раствор 40 ммоль сырого 3-хлор-1(4-хлорфенил)-1-(3-пиридил)-1-пропена добавляют к 18,0 r (400 ммоль) диметиламина в 25 мл хлористого метилена при температуре 10"С. После перемешивания при комнатной температуре в течение 90 мин добавляют 25 мл воды, фазы разделяют и растворитель удаляют из органической фазы. Остаток поглощают в простом эфире и экстрагируют разбавленной хлористоводородной кислотой до рН 4,5. Водную фазу подщелачивают, экстрагируют простым эфиром и удаляют растворитель. Получают
6,8 r масла, которое растворяют в ацетоне, и к раствору добавляют один эквивалент щавелевой кислоты в ацетоне. Осаждающий оксалат перекристаллизовывают два раза из этанола. IIozlywaev 5,1 г (35X) чистого продукта с т.пл, 164;168 С.
Пример 2. Оксалат 3-(4-хлорфенил)-Ы-метил-3-(3-пиридил)-аллиламина.
Изомер Z. Целевой продукт получают аналогично примеру 1 из сырого 3-хлор1-(4-хлорфенил)-1-(3-пиридил)-1-пропена и метиламина, причем этанол применяют в качестве дополнительного растворителя и сырой оксалат перекристаллизовывают из смеси этанола с водой (3:1). При этом получают продукт в виде изомера Z с т.пл. 203-704 С.
Выход 23Х. УФ (0,1 М НС1):
245 нм и 1 224 нм.
Иэомер Е. Маточный раствор, получаемый при перекристаллизации продукта предыдущей стадии, очищают жидкостной хроматографией (нуклеозил с величиной 5 мик. метанольно-фосфатный буфер; рН 3,0; 40:60). Метанол упаривают и водный раствор подщелачивают и два раза экстрагируют простым эфиром. После сушки над сульфатом магния эфирный раствор концентрируют в вакууме. При этом получают изомер-E в виде масла. УФ (0,1 И НС1): Л,ц„„
219 нм и 235 нм (плечо) . Выход 187.
Аналогично примерам 1 и 2 получают следующие соединения.
1. Оксалат 3(4-фторфенил)-N,Nдиметил-3-(3-пиридил)-аллиламина в
3 11037 виде смеси изомеров и z (1:1) с т. пл. 151 "155ОС. Выход 407 °
13. Оксалат 3- (4-фторфенил) -Я-метил-3-(3-пиридил)-аллиламина в виде смеси изомеров Е и Z (1:1) с т.пл. 196-198 С. Выход ЗОХ.
Ш. Оксалат 3-(2-.бромфенил)-N,Nдиметил-3-(3-пиридил)-аллиламина в виде изомера Е с т.пл. 148-149 С.
Выход 20Х.
1f. Оксалат 3-(2-бромфенил)-Nметил-3-(3-пиридил)-аллиламина в виде изомера Е с т.пл. 200-202 С. Выход 20Х.
У. Оксалат 3-(3-бромфенил)-N-ме15 тил-3-(3-пиридил) -аллиламина в виде изомера Z с т.пл. !98-199 С. Выход 217.
У1. Оксалат 3-(2,4-дихлорфенил)N N-диметил-3-(3-пиридил)-аллиламина а 20 в виде изомера Е с т.пл. 167-169 С.
Выход 25 .
У11. Оксалат 3-(2,4-дихлорфенил)N-метил-3-(3-пиридил)-аллиламина в виде изомера E с т.пл. 203-205 С.
Выход 25Х.
УШ. Оксалат 3-(4-йодфенил)-N,Nдиметил-3-(3-пиридил)-аллиламина в виде изомера Z с т.пл. 170-173 С (из смеси этанола и изопропилового эфира). Выход 257.
1Х..З-(З-Хлорфенил)-N,N-диметил-. с
3-(3-пирндил)-аллиламин в виде изомера 2 с т.пл. 171 — 174 С. Выход 32Х.
Х. Оксалат 3-(3-бромфенил)-N,Nдиметил-3-(3-пиридил)-аллиламин в виде изомера Z с т.пл. 162-163 С (из смеси этанола и изопропилового эфира). Выход 287.
Х1. 3-(2-бромфенил)-N-метил-3-(3пиридил)-аллиламин в виде смеси изомеров Е и 2 (1:1) . Выход 307.
Н ЯМР (СОС1 ): 1,90 (S,ЫН), 2,40, (д, СН ), 3,11 (д,Z-аллил), 3,42 (д,Е-аллил), 5,91 (т, Е-винил), о,35 (т, Z-винил), 6,9-7,7 (ароматический и 3,4-пиридил), 8,3-8,5 (м, 2,6-пиридил).
ХП. 3-(2-Бромфенил)-N,N-диметил3-(3-пиридил)-аллиламин в виде смеси изомеров Е и Z (1:1). Выход 287.
Н ЯМР(СОС1 ):.d"2,02 (д,СН ), 2,84 (д,Е-аллил), 3,13(д,Е-аллил), 5,93 (т,Е-винил), 6,33 (т,Z-винил), 7,07,7 (ароматический и 3,4-пиридил)
8,3-8,5 (м, 2,б-пиридил). 55
ХШ. 3-(2,4-дихлорфенил)-Х-метил-3-. (3-пиридиламин) в виде смеси изомеров и Z (1:1). Выход 287.
94 4 чН ЯМР (СОС1 ): d 1,63 (S,NH), 2 40 (д,СН ), 3,13 (д, Z-аллил), 3,43 (д,Е-аллил), 5,94 (т,Е-винил), 6",3Ь (т,Ъвинил), 7,0-7, 6 (ароматический и 3 4-пиридил), 8,3-8,6 (м, 2,б-пири- дил).
ХТУ. 3-,(2,4-дихлорфенил)-N,N-диметил-3-(3-пиридиламин) в виде смеси изомеров Е и 2 (1:1). Выход 26Х.
"Н ЯМР(СОС1 ): " 2,23(д,СН ), 2,69 (д, Z-аллил), 3, 14 (д, Е-аллил), 6,01 (т,Е-винил), 6,41 (т,Z-винил), 7,07,6 (ароматический и 3,4-пиридил), 8 4-8,6 (м, 2,6- пиридил) .
Фармакологические;опыты.
Экспериментальным путем вызвать у животных депрессии невозможно. Для определения возможной подавляющей депрессии, активности новых соединений проводят исследования биохимическифармакологическими методами. Этот метод сводится к определению уменьшения поглощения " С-5-окситроптамина (" С-5-НТ) и 3Н-норадреналина (Н-NA) в срезах мозга мыши после аппликации исследуемого соединения в пробирке и в живом организме.
Торможение поглощения "4С-5-НТ и ь
Н-NA в живом организме и в пробирке.
Исследуемые соединения вводят внутрибрюшинно за полчаса до умерщвления животного. Средний мозг вынимают, режут и инкубируют в смеси, состоящей из 1 10 М "4С-5-НТ, 1 10" М Н-МА, 5,6 ммоль глюкозы, 5 ° 10 M паргилина, 1,1 моль аскорбиновой кислоты и 1,3.10" динатриевой соли этилсндиаминтетрауксусной кислоты в 2 мл буфера Кребса-Гензелейта на 25 мг срезов мозга (рН 7,4). Инкубируют в течение 5.мин при 5-минутной предварительной инкубации. Затем добавляют указанные в таблице маркированные соединения. Срезы растворяют в солуэ не (зарегистрированный товарный знак) и количество поглощаемых радиоактивных аминов определяют жидкой сцинтйл ляцией. Дозу, дающую 50Х-ное уменьшение активного поглощения (ЭД ) " С50
5-НТ и Э Н-ЙА, линейной регрессией определяют по кривой 1 доза-реакция. Активное поглощение определяют как часть радиоактивного поглощения, которая тормозится высокой концентрацией кокаина.
При опытах в пробирке срезы среднего мозга мьппи предварительно инкубируют в течение 5 мин в растворе исследуемого соединения и затем ин 1103794
Торможение нейронального поглощения 5-окситриптамина и норадреналина в срезах мозга мыши
Соединение й
Н-NA в жи1+С- 5НТз в живом организме
ЭД ,@моль/кг
ПоглоПоглощение в пробирке
ЭК О,,им
Соль или основаСоединения щение в пробирке
ЭК а м вом организме ЭД р моль/кг ние
R Из омер
Иэвест)101(38X)"
0,1 15
2,5 102
1,7 49
6,1 )98(36X) -Br Н Z
-Br Н Е
Гидрохлорид
Оксалат ные
0,8
) 98(2631
24,4
-Вг СН
-Br СН Е
Гидрохлорид
Оксалат
6,1
25 по примеру 2 4-С1 Н Z
0,4 19
23 по примеру 1 4-С1
1,1 34
2,4 72
СН У.
Н Е/Z 1:1
4-F СН Е/Z 1:1
72
4 115
> 88 (О)"
)110(417) 22 (333) 1,3 46
2,7 )110(12K) I,4 )102
4-I
3-С1
СН Z
Н
3-Br
0,9
Оксалат
58 кубируют описанным образом. При этом определяют концентрацию исследуемого соединения, дающую 50Х-ное уменьшение активного поглощения (ЭД ).
Результаты опытов сведены в таб- 5 лице.
Согласно данным таблицы ЭК и ЭД предлагаемых соединений в опыте составляют 0,4-4,2 мкмоль, и 18126 мкмоль/кг соответственно, тогда как определенные для известных соединений дозы ЭК и ЭД О составляют
0,1-6,1 мкмоль и 15-102 мкмоль/кг соответственно т.е. активность новых соединений, определенная в опыте.A находится на том же уровне, что и активность известных соединений. Такой же вывод может сделать и при рассмотрении результатов опыта 5. Согласно этому опыту ЭК „и ЭД для новых соединений составляют 0,3-29 мкмоль и 25-110 мкмоль/кг соответственно (за исключением соединения УШ, которое в дозе ) 88 мкмоль/кг не проявляет активности), тогда как ЭК1 и ЭД для известных соединений составляют
0,8-24,4 мкмоль и 25-101 мкмоль/кг соответственно.
Новые -оединения также не уступают известным по токсичной дозе, т.е. токсичная доза ЛД известных соединений составляет 400-4 10 мкмоль/кг мыши (при оральной даче), тогда как
ЛДэо новых соединений составляет
390-425 мкмоль/кг мыши (при оральном введении).
Предлагаемые соединения обладают высокой антидепрессивной активностью, находящейся на уровне известных соединений аналогичного строения, и могут заменять их при наличии плохой переносимости или привыкания.
1103794
Соеди нения
3-Br СН
Оксалат 0,9 > 98
4,2
Х1
2-Br Н Е/Е 1: 1 Основание 1,5 >132
1,4
Основание 3,5 >1 26
2,2
2 Br СН Е/Е 1.!
Оксалат 0,6 102
2-Br Н
0,3
2-Br СН
4„2 > 98
0,5 60
Оксалат
2,2
Е/Z 1:1 Основание
0,9
Е/Z 1;1 Основание 2,7 42
Оксалат 0,5, 18
2,3
У1
Оксадат 1,5 43
>101
Примечания: 1)
2)
3)
4)
Составитель Ж.Сергеева
Редактор М.Петрова Техред Л.Коцюбняк . Корректор А.Ильин
Заказ 5044/45 Тираж 410 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
1I3035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", r.Óæãoðoä, ул.Проектная, 4
2,4-ди- Н
С1
2,4-ди- СН
С1
2,4-ди- Н
С1
2,4-ди- СНэ
С1 известное соединение (2 3; известное соединение (3 ); опыт А; опыт Б; — процентное торможение при этой дозе.
Н-NA ) в живом организме ЭД моль/кг