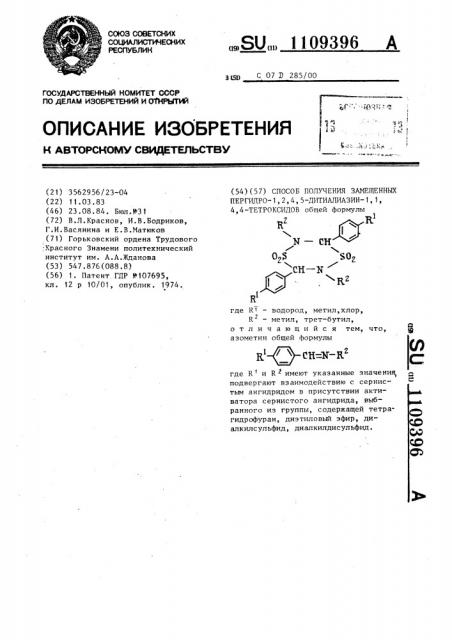
Способ получения замещенных пергидро-1,2,4,5-дитиадиазин-1, 1,4,4-тетроксидов
Иллюстрации
Показать всеРеферат
СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ПЕРГИДРО-1,2,4,5-ДИТИАДИАЗИН-1,1, 4,4-ТЕТРОКСИДОВ общей формулы R N- СН СН-N R2
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПЬЬЛИН эсю С 07 Р 285/00
h+ !
«1
1
1 !
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTOPCHOMY СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТ1Ф (21) 3562956/23-04 (22) 11.03.83 (46) 23.08.84. Бюл.ФЗ 1 (72) В.Л.Краснов, И.В.Бодриков, Г.И.Васянина и Е.В.Матюков (71) Горьковский ордена Трудового ,.Красного Знамени политехнический институт им. А.А«Жданова (53) 547.876(088.8) (56) 1. Патент ГДР 1107695, кл. 12 р 10/01, опублик. 1974.
„„SU„„1109396 А (54) (57) СПОСОБ ПОЛУЧЕНИЯ ЗАМЕН1ЕННЫХ
ПЕРГИДРО-1,2,4,5-ДИТИАДИАЗИН-1, 1, 4,4 — ТЕТРОКСИДОВ общей формулы г R
N — СН
0,$
СН вЂ” N
WRz 1 где Н1 — водород, метил, хлор, 2
R — метил, трет-бутил, отличающийся тем, что, азометин общей формулы г где R" и R имеют указанные значения, подвергают взаимодействию с сернистым ангидридом в присутствии активатора сернистого ангидрида, выбранного из группы, содержащей тетрагидрофуран, диэтиловый эфир, диалкилсульфид, диалкилдисульфид.
1109396
Изобретение относится к получению гетероциклических соединений — замещенных пергидро-1,2,4,5-дитиадиазинов, которые могут найти применение
s качестве присадок к гидравлическим
EtOOC(CN) С=С С=-C(CN) COOEt
S с азидом натрия (1).
Однако известным способом могут быть получены только п ргидро-1,24,5-дитиадиазины, не имеющие заместителей у атома азота и серы в цикле, а набор заместителей у атомов углеро20 да в цикле ограничен имеющимся в малодоступных исходных 1,3-дитиетанах заместителем.
Целью изобретения является получение новых производных пергидро25
1,2,4,5-дитиадиазинов, которые могут найти применение в качестве присадок к гидравлическим жидкостям.
Поставленная цель достигается тем, что согласно способу получения замещенных пергидро-1,2,4,5-дитиадиазин-1,1,4,4-тетроксидов общей формулы г
N — C3f
2 О2 к
40 где R — водород, метил, хлор, R — метил, третбутил; заключающемуся в том, что азометин
15 общей формулы
Я Щ=Я-Р (й) 50 где R u R имеют указанные знаг чения, подвергают взаимодействию с сернистым ангидридом в присутствии активатора сернистого ангидрида, выбран- 55 ного из группы, содержащей тетрагидрофуран, диэтиловый эфир, диалкилсульфид, диалкилдисульфид. жидкостям.
Известен способ получения 3,6-бис (этоксикарбонилцианметилен)-пергидро1,4,2,5-дитиадиазина взаимодействием
1 3-дитиетана формулы 10
Роль активаторов заключается в повышении нуклеофильных свойств молекулы БО за счет образования донорно-акцепторных комплексов с активатором.
Состав и структура соеди (ений (I) доказаны по данным элементного анализа, ИК- и ПМР-спектров.
Полученные пергидро-1,2,4,5-дитиадиазин-1,1,4,4- тетроксиды (1а-г) представляют собой твердые кристаллические вещества, растворимые в диметилсульфоксиде, реагирующие с водой и метанолом с раскрытием цикла.
Выходы продуктов (1а-г) колеблются от 10-157 до количественного, Способ осуществляют следующим образом.
Смесь азометина, 50 и активато ра выдерживают при -20-20 С в запаянной ампуле в течение 1-24 ч.
Затем смесь упаривают, промывают гексаном и получают в остатке соединения (1а-r). Реакцию можно проводить в среде 50, азометина или активатора. Соотношение азометин:
50,:активатор можно варьировать в пределах 1: 20: 1-5: 1: О, 05-1: 1: 10 .
Предлагаемый способ не требует выдерживания жесткого температурного режима °
Пример 1. 2 5-диметил-3,6дифенилпергидро-1,2,4,5-дитиадиазин- 1, 1,4,4-тетроксид, .О Ж вЂ” СН
828 ЯОi Л a)
В ампулу помещают 6, 10 г (0,05 моль) диэтилдисульфида, добавляют 2,38 г (0,02 моль) бензальметиламина и при -50 С приливают о
1,30 r (0,02 моль) жидкого БО (соотношение бензальметиламин: 50< . диэтилдисульфид 1: 1:2,5) . Смесь выдерживают в запаянной ампуле в течение 24 ч. Затем ЬоДержимое ампулы упаривают, остаток промывают гексаном, Получили 3,5 г (96_#_ от расчетного) соединения (1а) т,пл.115 С.
Идентификацию соединения (1а) осуществляли по данным элементного анализа, ИК-и ПМР-спектров.
1 109396
Найдено,7: С 52,34; Н 4, 90;
7,0-, 5 17,58, 1ь 1 2 52 Ф
Рассчитано,7: С 52,46; Н 4,92;
7,65; 5 17,47.
ИК-спектр соединения (ra) (V,см )
1180 (S 5Ог); 1400 (as 50 ); 1240 (С-М
1520, 1620, (С-Сар. ) .
ПИР-спектр соединения (1а) содержит сигналы (с, м.д. ) метиновых протонов гетероцикла и бензольных колец и протонов метильной группы:
5,06, С, 2Н; 6,9-8, 1, М, 10Н; 2,75, С, 6Н.
Пример 2. Смесь из 0,47 r (0,005 моль) диметилдисульфида, 3,57 г (0,03 моль) бензальметиламина и 0,64 r (0,01 моль) жидкого S02 (соотношение бензальметипамин: Sg г диметилдисульфид 3: 1:О, 5) готовят аналогично примеру 1. После выдерживания при 20ОС в течение 24 ч содержимое ампулы упаривают, осадок промывают гексаном. Получили 0,89 r (45% от расчетного) соединения (fa).
Идентификацию соединения (Ia) осуществляли аналогично примеру 1.
Пример 3. Смесь из 1,28 г (0,02 моль) сернистого ангидрида, 4,70 г (0,05 моль) диметилдисульфида и 2,38 r (0,02 моль) бензальметиламина (соотношение бензальметиламин: 50> .диметилдисульфид I: 1: 2, 5) готовят аналогично примеру 1. После вьдерживания в запаянной ампуле при
20 С в течение 24 ч содержимое амо пулы упаривают, промывают гексаном.
Получили 3,34 г (857 от расчетного) соединения (Ia). Идентификацию соединения (1a) осуществляют аналогично примеру 1.
Пример 4. Смесь из 2,38 г (0,02 моль) бензальметиламина, О, 12 г (0,001 моль) дипропилсульфида и 6,40 r (0,10 моль) жидкого 50< (соотношение бензальметиламин: So дипропропилсульфид 1:5:0,05) готовят аналогично примеру 1. После выдерживания при 20 С в течение 24 ч о смесь упаривают и промывают гексаном, Получили 2,29 г (637. от расчетного) соединения (7a). Идентификацию соединения (а) осуществляют аналогично примеру 1.
Пример 5. В ампулу загружают 2,85 г (0,04 моль) осушенного над натрием диэтилового эфира, добавляют 1,28 r (0,02 моль) жидкого
5 !
О
35 и приливают 1 г (О, 008 моль) бензальметиламина (соотношение бенэальметиламин: 502 . диэтиловый эфир
2,5:5) . Полученную после .вьдерживания при 20 С в течение 24 ч смесь упаривают в токе азота, остаток промывают сухим эфиром. Получают 0,24 r (167 от расчетного) соединения (1а).
Идентификацию соединения (Ia) осуществляют аналогично примеру 1.
Пример 6. 2,5-диметил-3,6ди-п-толилпергидро-1,2,4,5-дитиадиазин-1, 1,4,4-тетроксид (16). Смесь из 3,10 г (0,05 моль), диметилсульфида, 2,66 г (0,02 моль) метилбензальметиламина и 1,28 r (0,02 моль) жидкого so (соотношение-,n — метилбензальметиламин: 50 г диметилсульфид 1: 1: 2, 5) готовят аналогично примеру 1. Смесь после о вьдерживания при 20.С в течение
24 ч упаривают и экстрагируют гексаном. Получают 0,49 r (257. от расчетного) нерастворимого в гексане соединения (76), т.пл. 82 С.
Идентификацию соединения (16) осуществляют по данным элементного анализа, ИК-и ПМР спектров.
Найдено, Х: С 49, 84, Н 5, 61; N 7, 07, 15,68, 18 22 2 2
Расс. читано,:.: С 54,82; H 5,58, М 7 11 5 16 24.
ИК-спектр соединения аналогичен описанному в примере 1.
ПМР-спектр соединения содержит сигналы (Ы,м.д.) метиновых протонов гетероцикла и бензольных колец и протонов метильных групп (CH9 -и-. йСНз):5,13, С,2H; 6,8-8,3, И, 8Н;
2,58, С, 6Н; 2,68, С, 6Н.
Пример 7 ° 2, 5-диметил- 3, 6ди — п-хлорфенилпергидро-1,2,4,5-дитиадиазин-1,1,4,4-тетроксид (Ta).
Смесь из 1,28 г (0,02 моль) жидкого So» !г (0,0065 моль) и -хлорбензальметиламина и 4,2 г (0,068 моль диметилсульфида (соотношение п -хлорбензальметиламнн: 50 :диметилсульфид
1:3: 10) готовят аналогично примеру
1. После вьдерживания в запаянной ампуле при 20 С в течение 24 ч содержимое ампулы упаривают, промывают гексаном. Получают 0,59 r (427 от расчетного) соединения (Ja), т.пл. 102 С.
Идентификацию соединения осуществляют по данным элементного анализа
ИК-и IlNP-спектров.,1 109396
Составитель Т. Раевская
Редактор В, Данко Техред N.Kóçüèà Корректор м. Демчик й
Заказ 5996/16 Тираж 410 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д, 4/5
Филиал ПЛП "Патент", г. Ужгород, ул. Проектная, 4
Найдено, l: С 42,50; Н 4,72; Н 5,64
5 15, 76; СВ 14, 42.
СЦ Н М2 92 О СЕ °
Рассчитано,%: С 44, 14, Н 3,68, М 6,44, Б 14 71, CI? 16,32.
ИК-спектр соедин -ния аналогичен описанному в примере 1, IIMP-спектр соединения содержит сигналы (d м.д.) метиновых прото10 нов гетероцикла и бензольных колец и протонов метильных групп: 5,24, С, 2Н, 7 5 8 О, М, 8Н, 2 61, С бН.
Пример 8. Приготовили смесь из 3,6 г (0,05 моль) тетрагидрофурана, 0,64 г (0,01 моль) жидкого
50> и О, 76 r (О, 005 моль) н -хлор-. бензапьметиламина (соотношение хлорбензальметиламин: 50z . тетрагидрофуран 1:2: 10) аналогично примеру
2О
1. Полученную смесь выдерживают в а запаянной ампуле при 20 С в течение
24 ч. Выпавший осадок отфильтровывают, промывают сухим эфиром. Получают
0,12 r (13X от расчетного) соединения (1в). Идентификацию соединения осуществляли аналогично примеру 7.
Пример 9. 2,5-ди-трет-бутилЗ,б-дифенилпергидро-1, 2,4, 5-дитиадиазин-1, 1, 4, 4-тетроксид (Ir) . Смесь из 61 г (О, 01 моль) бензаль-трет -бутиламина, 4,50 r (0,05 моль) диэтилсульфида и 0,64 г (0,01 моль) жидкого О {соотношение бенэаль-трет -бутиламин: 50 : диэтил- З сульфид 1:1:5) готовят аналогично примеру 1. После выдерживания при
20 С в течение 24 ч смесь упаривают, затем промывают гексаном. Получе:o
0,2 r (117. от расчетного) соединения (1г), т.пл. Ч8"С.
Идентификацию соединения осуществляют по данным элементного анализа, ИК- и IINP-спектров.
Найдено,%: С 51,63, H 7,12;И 8,04; б 12,41.
С Н И 0
ZZ Яо 2
Рассчитано, ь . С 58, б 7; Н 6, 67;
М 6,22; 5 14,22.
ИК-спектр соединения аналогичен описанному в примере 1.
ПьР-спектр соединения содержит сигналы (6,м.д.) метиноных про-.онов гетероцикла и бензольных колец и протонов Трр7-бутильной группы, 5,25, С, 2Н; 7,4-8,3, М7 10Н, 1,48,С, 18Н.
Пример 10. Смесь из 1,61 г (0,01 моль) бензаль-трет — бутиламина, О, á4 г (О, 01 моль) жидкого б 0 и
3,,10 r (0,05 моль) диметилсульфида (соотношение бензаль- трет -бутиламин
5 0 . диметилсульфид 1:1:5) готовят аналогично примеру 1. После выдерживания в запаянной ампуле при 20 С в течение 24 ч смесь упаривают, промывают гексаном. Получают 0,35 r (167 от расчетного) соединения ($r)
Идентификацию соединения осуществляют аналогично примеру 9.
Предлагаемым способом можно получать пергидро-1,2,4,5-дитиадиазин1,1.,4,4-тетроксиды,, содержащие разли. ные арильные заместители у атомов углерода и алкильные заместители у атомов азота, что расширяет технологические возможности предлагаемого способа по сравнению с известным.