Способ получения диангидрида 1,1-динафтил-4,4,5,5,8,8- гексакарбоновой кислоты
Иллюстрации
Показать всеРеферат
СПОСОБ ПОЛУЧЕНИЯ ДИАНПЩРИДА I ,1-ДИНАФТНЛ-4,4, 5,..5, 8,8-гексакарбоновой кислоты диазотированием аминосодержащего полициклического ароматического соединения нитритом щелочного металла при температуре 5-15°С и рН 0-2 с последующей биарильной конденсацией полученного диазосоединения в присутствии раствора аммиака и однохлористой меди в качестве катализатора, выделением кислоты обработкой соляной кислотой, отличаю П1ийся тем, что, с целью повышения выхода целевого продукта и упрощения процесса D ка ;естве аминосодержащего полициклического ароматического соединения нспользуют калиевую соль 1-аминонафтаS лин-4,5,8-трикарбоновой кислоты. (Л
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (19) (1ll
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ABTOPCKOMY СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 2 ) 73921/23-04 (22) 19.09. 75 (46) 23.08.84. Бкл. Ф 31 (72) Г. Г.Соломатин и В.А.Шигалевский (53) 547. 65 7. 07 (088. 8) (56) 1. Авторское свидетельство СССР
И 247946, кл. С 07 С 63/48, опублик. 1967 (прототип) .
2. Авторское свидетельство СССР
Р 202920, кл. С 07 С 63/48, опуб-лик. )964.
3. Авторское свидетельство СССР
1(202926, кл. С 07 D 209/92, опублик. 1964. (54) (57) СПОСОБ ПОЛУЧЕНИЯ ДИАНП!ДРИДА
l, l -ДИНАФТИЛ-4,4, 5,.5, 8,8 -гексаЗ(Я) С 07 D 3)1/02; С 07 С 63/48 карбоновой кислоты диазотированием аминосодержащего полициклического ароматического соединения нитритом щелочного металла при температуре
5-15 С и рН 0-2 с последующей биарильной конденсацией полученного диазосоединения в присутствии раствора аммиака и однохлористой меди в качестве катализатора, выделением кислоты обработкой соляной кислотой, отличающий ся тем, что, с целью повышения выхода целевого продукта и упрощения процесса в ка;естве аминосодержащего полициклического ароматического соединения используют калиевую соль !-аминонафтаЯ лин-4,5,8-трикарбоновой кислоты.
11О94ОО
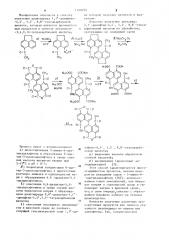
r)-cL(ce чк„он а) -t4aNclã
ICE
К) maC о, H>50
О=С Н CF
О
Н ООС - COOH и 000C COG Na г) е) Иа OCR йа0Н
) HCP
HOOC COOH
0 =с-, гав=О
Я ЛООС COONn
О= С с — О е) О =- C -С=О
Изобретение относится к способу получения диангидрида 1,1 -динафтилi
-4,4, 5,5, 8,8 -гексакарбоновой кислоты, которая является промежуточным продуктом в синтезе антантрон-3,4,9, 10 — тетракарбоновой кислоты, Процесс ведут с использованием:
a) диазотирования 5-амино-6 — аце)Щ тилаценафтена и образования 6-ацетил-5 — диазоаценафтена в среде соляной кислоты нитритом натрия при
5-15 C r r рН = О-?;
У) биарильной конденсации 6-ацетил-5-диазоаценафтена в присутствии раствора аммиака и однохлористой меди. с образрванием 6,,6 -диацетил-5,5
-ди аце н афт енил а.
5 ) окисления 6,6-диацетил-5,5-диаценафтенила в среде серной кислоты бихроматом натрия с образованием диангидрида 8,8 -диацетил-1,1 —
-динафтил-4,4,5,5 -тетракарбоновой кислоты
Г ) окисления последнего гипохлоригом в щелочной среде до соответствующей гексанатрие вой соли 1, 1 -дииз которой получают пигменты и красит ели .
Известно получение ангидрип„
1, 1 — динафтил — 4,4, 5,5, 8,8 -гексакарбоновой кислоты из а (енафтена, протекающее по следующей схеме нафтил-4,4, 5,5, 8,8 -гексакарбоновой кислоты, Ь.) выделения кислоты обработкой соляной кислотой;
p) высушивания (происходит анГидридиз ация ) C l j °.
Этот способ характеризуется многостадийностью процесса, низким выходом по исходному сырью — 5-амино-6-ацетилаценафтену (267), использованием таких окислителей, как бихромат натрия в сернокислой среде и гипохлорит натрия в щелочной среде, что в свою очередь связано с образо—
/ Р ванием большого количес. ва отходов проиЗводства.
Известно получение различных промежуточных продуктов для синтеза указанного диангидрида из пирена или аценафтена. Так „катапитическим
l 109400
KODC
СООК
a) к о NO
КООС СООК НСЕ
5) к ксе д) CU Ce, НООС СООН мн Он к
KO0C COOK
О=С С=О
ОН
Н окислением пирена озонокислородной смесью получают 1,4,5.8-нафталинтетракарбоновую кислоту С21, которую используют в синтезе мононафталин-1,4,5,8-тетракарбоновой кислоты и имида (нафтостирил-5,6,-дикарбоновой кислоты). Гидролиэом последней получают натриевую соль 1 †аминонафталин-4,5,8-трикарбоновой кислоты С33.
Однако во всех случаях также предусматривается многостадийность процесса.
Целью изобретения является упрощение процесса и повыиение выхода целевого продукта.
Процесс ведут с использованием:
o ) диазотирования (соли) 1-амино-нафталин-4,5,8 — трикарбоновой кислоЮ ты нитритом натрия при 5-15 С и рН = 0-2 и получения суспенэии диазониевой соли l-аминонафталин-4,5,8-трикарбоновой кислоты, Ю) биарильной конденсации I-диазонафталин-4,5,8-трикарбоновой кислоты в присутствии раствора аммиака и однохлористой меди при 10-20с С и рН раствора 8-10 с образованием гексакалиевой соли 1,I -динафтил-4,4, 5,5, 8,8 -гексакарбоновой кислоты;
В ) выделения .диангидрида 1, 1-ди/ нафтил-4, 4, 5,5, 8,8 -гексакарбоновой кислоты из ее соли дейс1 вием соляной кислоты или серной кислоты (получение па.ты);
Г ) при необходимости очистки и высушивания целевого продукта, Указанная цель достигается тем, что в качестве аминосодержащего полиц1 клического ароматического соединения используют капиевую соль
l -аминонафт алин-4, 5,8-трикарбоновой кислоты.
В сравнении с известным способом предлагаемое изобретение поз—
10 воляет уменьшить число стадий в два раза и повысить выход целевого пролукта до 637 против 26Х, считая на
5-амино-6-ацетил аце нафт ен. с
15 Предл оженный способ о суще ст вля ют по следующей схеме
Пример i. Диазотирование.
В 400 мп водного раствора, содеркащего 0,073 моля капиевой соли 1-амино — нафтапин-4,5,8-трикарбоновой кислоты, растворяют 6,136 r (0,876 моль)
98,57-ного нитрита натрия и охлаждают до 10 С. Полученный раствор медленно приливают к 380 мл I4X-. ной соляной кислоты, поддерживая температуру в пределах 2 †10. Дпительность диаэотирования I ч, рН к концу приливания амина не бо50 лее 2. По окончании реакции суспензию размешивают еще 15-20 мин, разрушают избыток нитрита обработкой сульфаминовой кислотой до отсутствия синего пятна на иодокрахмальной бумажке и суспенэию 1-диаэонафталин-4, 5, 8-трикарбоновой кислоты подают на биарильную конденсацию.
l!09400
Биарильная конденсация 15,00 г (О, 148 моль) 98%-ной однохлористой меди растворяют в 60 мп воды и к полученной суспензии белого цвета приливают 215 мп (0,736 моль) 6,0%— ного раствора аммиака, размешивают до полного растворения однохлористой меди и к полученному раствору медно-аммиачного комплекса приливают суспензию 1-диазонафталин10
-4,5,8-трикарбоновой кислоты с таким расчетом, чтобы температура не превышала 15-20 С,a рН среды 9-10.
По окончании подачи массу размешивают еще 1 ч, подкисляют соляной кислотой 15 до рН=1 и дают отстояться 7-8 ч. Выпавший в осадок диангидрид 1, — динафтил-4,4, 5,5, 8, 8 -гекса— карбоновой кислоты отфильтровывают, промывают 30 мп О, 1 н, соляной кисло- 20 ты и сушат при 100-110 С до постоянного веса. Выход 15,77 r диангидрида 1, 1 -ди нафтил-4, 4, 5, 5 . 8, 8 -гексакарбоновой кислоты с содержанием основного вещества 70,32% или I 1,, 09 г 25 (0,023 моль) в пересчете на 100%-ный диангидрид. Выход 63,0!%.
Очистка и идентификация. 14,65 г
7G, 32%-ного диангидрида 1 „! -ди- .,0 нафтил-4,4, 5,5, 8,8 -гексакарбоновой кислоты нагреваюз с 3 50 г ацетата натрия в 500 мп воды до кипения, фильтруют горячим, промывают
30 мп горячей воды и фильтрат подкисляют до рН 0,5, поспе отстаивания в течение 8 ч суспепзию фильтруют, промывают 30 мп 0,1 н. соляной кислоты и при атмс сферном дав— лении сушат (100 — 10 С) до диангидрида. Получают 10,59 r аморфного порошка белого цвета со слегка желт о в атым от т ен ком, с од ержани е диангидрида 1, 1 -динаЖтил — 4, 4, 5, 5, 8,8 -гексакарбоновой кислоты 93, !2%. ,! г
Выход по очистке 95,70%. Кристаллизацией из ацетона получают иглообразные прозрачные призмы с Т.пл. выше 300 С. !
Найдено, %: С 64,42; 64,51;
Н 2,01; 1,98.
СУЙ! H ja 01о
Вычислено, %: С 64 74; Н 2,09.
ИК-спектр таблетки КВ1, UR-20) имеет полосы, см : 635, 684, 754, 780, 829, 873, 1041, 1123, 1163, 1230, 1300, 1320, 1370, 1470, 1525, 1600, 1742 и 1788.
Соединение полностью идентич— !
:o по ИК-спекгру диангидриду 1,1 — див н афтил-4, 4, 5,, 5, 8,8 — гексак ар— боновой i:èñëîòû, полученному из аценафт="на ь13 .
Пример 2. Диазотирование.
В 450 мл водного раствора, содержащего О, 075 моля калиевой -.олы 1-ами— нафт алин-4, 5, 8 — три карбоновой кислоты, растворяют 6,3 r (0,09 моля) 98,5%ного нитрита натрия и охлаждают до
С. Полученный р а створ придают к водному раствору соляной кислоты, поддерживая "-10 С и рН среды 1 — 1,2.
По окончании добавления раствора амина дают выдержку при перемешивании 30 мин и направляют на стадию биарильной конденсации.
Биарильная конденсация. 20, О г (О, 198 моля) 98%-ной однохлористой меди р аз мешивают в 70 мл воды и к полученной суспензии белого цвета приливают 215 мл 8%-ного раствора аммиака. Массу перемешивают до полного растворения и к раствору медно-а ;миачного комплекса приливают соль диазония при 15-?O С и рН среды 9, 5 — 10,, перемешивают еще 30 мин, придают 23,3 г едкого кали, отдуваюг аммиак, проводят очистную фильтрацию и полученный раствор подкисляют .
Вььделение „К раствору ка невой соли 1,, -бинафтил-4.,4, 5,5, 8,8 —
--гексакарбоновой кислоты добавляют с оляную кислоту при 60-65 С до рН=1, кристаллизуют осацок 8 — 10 ч, фильтруют, пр омывают 30 мл воды, отжимают и получают 40,8 г водной пасты (б l, 9%) диан гидрида 1, 1 — би— нафтил — 4,4, 5,5, 8,8 -гексакарбокозой кислоты с содержанием ее
2 7,45%, примеси соляной кислоты О, 24%., воды 53,92%, неорганических примесей 2,21%, органических примесей 16. 18%. Полученная паста без зысушивания может быть использова— на в производстве кубогенов.
Анализ на содержание диангидрида з пасте ведут путем вакуумиронания ее над серной кислотой при 20 С (при этом уцаляется соляная кислота) и измерением ИК-спектров. В ИК-спектрах имеются полосы 1788 и 1742 см соответствующие ангидридному карбониду.
1 109400
Сост авител ь Г. Андион
Техред Т.Маточка
Редактор В.Данко
Корректор Е.Сирохман
Заказ 5997/17 Тирык 410 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
F13035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г. Ужгород, ул . Проектная, 4
Определение количества основного вещества проводилось превращением диан гидрида бинафтилге ксакар боновой кислоты в диан идрид антантронтетракарбоновой кислоты и измерением оптической плотности на спектрофотометре СФ-14 при 3. =525 нм. Содержание неорганических примесей определялось по зольности продукта, а органических-по разности в зольности.