Устройство для определения проницаемости модельных биологических мембран
Иллюстрации
Показать всеРеферат
УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕтм ПРОНИЦАЕМОСТИ МОДЕЛЬНЫХ БИШОГИЧЕСКИХ МЕМБРАН, содержащее ячейку с разделительной мембраной, измерительные обратимые электроды, расположенные по обе стороны мембраны, измеритель электрической проводимости и регистрирующее устроГство, отличающееся тем, что, с целью повышения точности и сокращения времени при определении проницаемости двух и более мембран, в ячейке установлен ряд дополнительных отсеков с мембранами, причем объем каждого последующего отсека составляет 0,005-0,5 объема предыдущего, а измерительный обратимый электрод расположен в каждом отсеке и подключен через коммутатор к измерителю эл ектрич ее кой пр оводимос ти,
COOS СОВЕТСКИХ
NUI É
РЕСПУБЛИК зш Ч 01й 33 48
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н CB TOPCKOMV CBMBBTBllbCTHV
/() д
t 1. I
% с
ГОСУДАРСТ8ЕННЫЙ КОМИТЕТ, СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 2965957/28-13 (22) 20.03.81 (46) 23.08.84 . Бюл. У 31 (72) Э.К.Алекберли, З.Ш.Алиев, P.À.Ãàñàíîâ и В.П.Топалы (71) Институт ботаники,им. В.Л.Комарова (53) @616.07 (088.8) (56) 1. Либерман Е.А. и Ненашев И.А.. . Моделирование взаимодействия клеточных мембран на искусственных фосфолипидных мембранах. - "Биофизика", 1970, .15,2, 1014-1021.
2. Либерман Е.А. Мембраны (ионная .проницаемость, возбудимость, управление). - "Биофизика", 1970, 15,2, 278-297 (прототип).,Я0„;, 1109644 А (54)(57) УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ
ПРОНИЦАЕМОСТИ МОДЕЛЬНЫХ БИОЛОГИЧЕСКИХ МЕМБРАН, содержащее ячейку с разделительной мембраной, измерительные обратимые электроды, расположенные по обе стороны мембраны, измеритель электрической проводимости и регистрирующее устройство, о т л и ч а ю— щ е е с я тем, что, с целью повышения точности и сокращения времени при определении проницаемости двух и более мембран, в ячейке установлен ряд дополнительных отсеков с мембранами, причем объем каящого последующего отсека составляет
0,005»0,5 объема предыдущего, а измерительный обратимый электрод расположен в каждом отсеке и подключен через коммутатор к измерителю элекгрической проводимости.
1 1
Изобретение относится к биофизике, а именно к устройствам для определения проницаемости модельных биологических мембран, и может служить для исследования проницаемости различных биологически активных соединений.
Известно устройство для определения проницаемости бимолекулярных фосфолипидных мембран для антибиотиков и ионофоров, заключающегося в
Ф сведении исследуемой мембраны и мембраны электрода.(11. .Известно также устройство для определения проницаемости бимолекулярных фосфолипидных мембран для антибиотиков и разобщителей окислительного фосфорилирования, состоящее иэ измерительной ячейки, содержа щей два соизмеримых рабочих отсека с измерительными электродами, моста сопротивлений, регистратора (2 J.
Недостатками известных устройств являются низкая точность, ограниченный круг соединений, проницаемость которых можно изучать, а также невозможность определения проницаемости для нескольких мембран.
Целью изобретения является сокращение времени, повышение точности при определении проницаемости двух и более мембран.
Поставленная цель достигается тем
Р что в устройстве для определения проницаемости модельных биологических мембран, содержащем ячейку с разделительной мембраной, измерительные обратимые электроды, расположенные по обе стороны мембраны, измеритель электрической проводимос ти и регистрирующее устройство, при этом в ячейке установлен ряд дополнительных.отсеков с мембранами, причем объем каждого последующего отсека составляет 0,005-0,5 объема предыдущего, а измерительный обратимый электрод расположен в каждом отсеке и подключен через коммутатор к измерителю электрической проводимости.
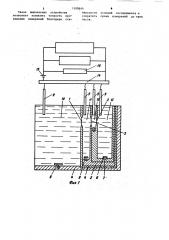
На фиг. t изображено устройство, общий вид и измерительная ячейка, разрез, на фиг. 2 - зависимость роста электропроводности от времени, на фиг. 3 - зависимость электропроводности от концентрации, на фиг.4рост концентрации во времени.
Проведение измерений с помощью предлагаемого устройства проводится. по схеме (фиг.1) для изучения трех
109644 2 последовательно расположенных мембран 1-3.
Измерительная ячейка состоит из нескольких разных размеров тефлоновых стаканчиков 5-7, которые плотно вставляются один в другой так, чтобы отверстия для посадки мембран были расположены концентрически. Затем наружный тефлоновый стакан 5 плотно вставляется в стаканчик из оргстекла 4 с плоской и прозрачной стенкой, что позволяет наблюдать за всеми исследуемыми мембранами г отраженном свете с помощью микроско/ па. Все отсеки рабочей ячейки 10-13 заполняются одинаковой средой и разделяются исследуемыми мембранами
1-3. В первый отсек ячейки 10 вводится раствор соли исследуемого ионофора известной концентрации С и наблюдается измерение проводимости всех исследуемых мембран. Величина проводимости каждой из последующих
2, 3 н т.д. мембран однозначно определяется концентрацией ионофора во втором 11, третьем 12 и т.д. отсеках рабочей ячейки. Таким образом, ионы ионофора, диффундируя через первую исследуемую мембрану 1, попа 30 дают во второй отсек ячейки 11 созФ давая со временем определенную концентрацию С ионофора во втором отсеке, затем диффундируя через вторую мембрану, создают определенную концентрацию ионофора С в третьем .отсеке ячейки и т.д. изменение концентрации исследуемого ионофора о другую сторону мембраны описывается следующим кинетическим уравнением
1 где С„- концентрация ионофора в первом отсеке измерительной ячейки;
Ч и Ч - соответственно 1-й и
1 2
2-й объемы отсеков ячейки;
50 S — площадь мембраны, t - время измерений, P - коэффициент проницаемости мембраны.
Поэтому в целях уменьшения времени достижения равновесных концентраций ионофора, добавленного в первый отсек ячейки, во всех остальных отсеках ячейки каждый последующий
1109644 отсек рабочей ячейки изготовляется в 10-20 раз меньше относительно предшествующего.
Определение электропроводности модельных липидных мембран проводится е помощью хлорсеребряных электродов 9, опущенньж в водные растворы, и электрической схемы, состоящей из коммутатора 14, моста 15 сопротивлений и регистратора 16. Коммутатор 14 позволяет переключать мост сопротивлений на каждую из исследуемых мембран и сопоставлять сопротивление мембраны с каким-либо из стандартных сопротивлений из моста сопротивлений.
Сопротивление мембраны определяется из известного выражения
Ю
"м р = — я
11 Ц Ст где R сопротивление мембраны;
R — стандартное сопротивление эквивалента;
U — напряжение включенного в цепь источниками
Цц — падение напряжения на мембране.
С помощью известного сопротивления находится удельная проводимость
1 мембраны g = (где g — удельная
R . S проводимость, S — площадь мембраны) .
Измеряемые характеристики мембран регистрируются с помощью автоматических потенциометров. Водные растворы во всех отсеках рабочей ячейки интен сивно перемешиваются с помощью магнитной мешалки и Т-образных мешалок 8, -ножки которых вставляются в специальные углубления на дне отсеков.
Каждая из исследуемых мембран предва.рительно калибруется в тех же условиях перемешивания в отсутствие остальньж мембран, т.е. строится график зависимости электропроводности мембран g данного состава от концентрации ионофора С . Зная значения электропроводностей мембран g в данный момент времени t, по этим калибровочным графикам определяются концентрации ионофора в этот момент времени во втором С, третьем С и последующих отсеках ячейки. Удельный поток ионофора через исследуемую мембрану площади S определяется из
Си(Е). Ч еырееееия 1 —" — - - (где V
S. t Ь объем и-го отсека ячейки). КоэффициЗная значения электропроводности мембран g в данный момент времени t (фиг.2), по калибровочной зависимости (фиг.3) определяется количество ионофора, в данном случае ТТФБ, про50 шедшее через первую исследуемую мемб рану, т. е. концентрация ионофора во втором рабочем отсеке. Описанный подход применяется и к последующим мембранам. Как видно из фиг. 4, экспериментально выявленные зависимости роста концентрации ТТФБ от времени — линейны, что является критерием применимости предлагаемого метода измерений.
35 ент проницаемости Р определяется из
I тг =та ь г
Пример. Проводят измерения
Ъищуцируемых тетрахлор-2-трифторметилбензимидазолом (ТТФБ) электрических проводимостей модельных липидных мембран, сформированных иэ яичного лецитина в концентрации
50 мг/мл н-декана (первая мембрана), ие общих липидов мозга в концентра- . ции 20 мг/мл н-декана (вторая мембрана), из окисленного холестерина в концентрации 50 мг/мл н-декана (третья мембрана), причем вторая мембрана является для первой мембраны одновременно и мембраной-электродом, также как и и-я для (и-1)-ой мембраны.
На фиг. 2 показана экспериментально выявленная зависимость роста электропроводности g мембраны (вторая мембрана на фиг.1), сформирован ной из общих липидов мозга, от времени t при внесении в первый рабочий отсек 10 с раствором 0,05 M бор-. ной кислоты ТТФБ до конечной концентрации 8.10 M..., На фиг. 3 показана экспериментально выявленная зависимость электропроводности g мембраны (вторая мембрана на фиг.1), сформированной из раствора общих липидов мозга, от концентрации С ТТББ в растворе
0,05 М борной кислоты в присутствии остальных исследуемых мембран (калибровочная зависимость)
На фиг. 4 показан экспериментально выявленный рост концентрации Ср
ТТФБ. во втором рабочем отсеке,11 изме-рительной ячейки во времени t npu наличии всех трех исследуемых мембран 1-3.
1109644 бильности сократить часов.
Такое выполнение устройства позволяет повысить точность проведения измерений благодаря . стаусловий эксперимента и сроки измерений . до трех
4 8 Ф Х У 7
Фиг./
1109644
1109644
2d Ж
Фаг.4
Составитель В.Перов
Техред Т.Фанта
Корректор Е.Сирокман
Редактор Г.Волкова
Филиал ППП "Патент", r. Увгород, ул. Проектная, 4
Заказ 6022/29 Тирам 823 Подписное
ВНИКПК Государственного комитета СССР по делам изобретений и откръпий
1.13035, Иосква, Ж-35, Раушская наб., д. 4/5