Способ определения никеля
Иллюстрации
Показать всеРеферат
СПОСОБ ОПРЕДЕЛЕНИЯ НИКЕЛЯ путем перевода его в комплексное со-. единение с органическим азотсодержащим реагентом в водно-ацетоновой щелочнойсреде с последующим измерением интенсивности окраски комплекса, отличающийся тем, что, с целью повышения селективности определения , в качестве органического реагента используют 2-
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК
89) SU (1и ф
ОПИСАНИЕ ИЗОБРЕТЕНИЯМИ
Н АВТОРСНОМУ СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 3530675/23-26 (22). 23.12.82 (46) 07,09.84, Бюл. ¹ 33 (72) Г.Н. Дударева, А,В. Долгорев, Б.И. Бузыкин, Л.П, Сысоева и .Ю.П. Китаев (71) Институт нефте- и углехимического синтеза при Иркутском государственном университете им. А.А. Жданова и Институт органической и физической химии им. А.Е.Арбузова Казанского филиала АН СССР (53) 543.062(088.8) (56) 1. Пешкова В.М., Савостина В.М.
Аналитическая химия никеля. М., "Наука", 1966, с. 312.
2, Авторское свидетельство СССР № 622761, кл. С 01 С 53/00, 1978.
3. Авторское свидетельство СССР № 638879, кл. С 01 С 53/00, 1978.
4. Авторское свидетельство СССР
¹ 842029, кл. С 01 G 53/00, 1981.
gag С 01 N 31/22 G 01 N 21 78 (54) (57) СПОСОБ ОПРЕДЕЛЕНИЯ НИКЕЛЯ путем перевода его в комплексное со-. единение с органическим азотсодержащим реагентом в водно-ацетоновой щелочной среде с последующим измерени- ем интенсивности окраски комплекса, отличающийся тем, что, с целью повышения селективности определения, в качестве органического реагента используют 2-(4-метоксибенэоил)-4-(2-нитрофенил)ацетгидразидин.
1112274
Изобретение относится к аналитической химии, а именно к способу on; ределения микрограммовых количеств никеля, и может быть применено для анализа различных никельсодержащих
5 природных и промышленных материалов.
Известны способы определения никеля с использованием органических реагентов, таких как диметилглиоксим (1), 1-(4-окси-6-метилпиримидил-2)3-фенил-5(П -карбокси)фенилформазан. )2), 1,5-ди(2-карбоксиметоксифенил)-3-фенил-формазан (3).
Основными недостатками таких способов определения никеля являются недостаточная чувствительность и селективность определения по отношению к цинку, меди, кобальту, свинцу, железу и другим элементам.
Наиболее близким к изобретению по технической сущности и достигаемому результату является способ фотометрического определения никеля с использованием в качестве реагента 2-бен25 зоил-4-(2-нитрофенил)ацетгидразидина.
Нижний предел определяемых концентраций никеля составляет 0>01 мкг/мл (рН 8,5) (4J.
Недостатками изве стного способа являются необходимость приготовления по ходу анализа холостой пробы, для полного связывания никеля в окрашенный комплекс необходим 5-ти кратный избыток реагента в растворе, малоиз35 бирательность по отношению к ионам меди, цинка, свинца (до 5-ти кратных количеств), а при отделении гидроокисей железа, титана и редкоземельных элементов неизбежны потери никеля за счет адсорбирования его осадками гидроокисей.
Целью изобретения является повышение селективности определения никеля, позволяющее проводить определение никеля в присутствии больших количеств других катионов и анионов (железа, цинка, меди, хлоридов, нитратов, фосфатов, фторидон), которые мешают или оказывают влияние на определение
50 никеля известными способами.
Поставленная цель достигается способом определения никеля, согласно которому в качестве органического азэтсодержащего реагента используют
2-(4-метоксибензоил)-4-(2-нитрофенил)ацетгидразидин. .При рН 7,2- 10,6 в водно-ацетоновой, среде образуется интенсивно окрашенное комплексное соединение никеля (Е = 5,3 10 при 600 нм), Методами изомолярных серий, насыщЕния,, прямой линии Асмуса, методом Комаря установлено, что соотношение металл - реагент 1 : 1. Концентрацию никеля определяют по градуировочному графику, построенному в тех же условиях по стандартным растворам никеля в интервале от 0,01 до 1000 мкг/мл.
Определению никеля не мешают следующие кратные количества ионов: кальция 1,4 10, магния 1-10, моФ ! либдена (IV) 5 10, железа (III)
3 10, меди (II) 1-10, кобальта (II)
2, титана (IV) 7. 102, ванадия (V) 10, марганца (II) 1,5 10, алюминия
2 10, цинка 2 10
При определении никеля в присутствии гидрализующихся элементов в условиях его определения добавляют
1 мл 207.-ного раствора сегнетовой соли. При определении никеля предлагаемым способом нет необходимости готовить раствор сравнения, так как при максимуме поглощения окрашенного комплекса (A - 600 нм) сам реагент практически не поглощает. Однако при
pH ) 10 0 в растворе преобладает окрашенная ионизированная форма реагента с Ъ „ = 500-520 нм. Для устранения влияния поглощения этой формы нужно работать при рН (10,0 или экстрагировать избыток реагента четыреххлористым углеродом.
Для снижения предела определения никеля комплексное окрашенное соединение экстрагируют н-бутиловым спиртом. Количественная экстракция комплекса наблюдается даже при соотношении объемов органической и водной фаз, равном 1;8. При использовании экстракции можно определять до
0 O01 Ni.
Способ осуществляют следующим образом.
Навеску образца растворяют, помещают в мерную колбу емкостью 100 мл.
Аликвотную часть, содержащую менее
100 мкг Ni, помещают в колбу емкостью
25 мл, приливают 1 мл 0,1/-ного раствора реагента в ацетоне, 1 мл 201 ного раствора сегнетовой соли и доливают буферным раствором до метки.
Оптическую плотность раствора определяют при 600 нм. Если годер канис никеля мало, определения проводят по следующей методике. h.и квотную
111227 4 часть раствора, содержащую не более
100 мкг Ni, помещают в делительную воронКу емкостью 50-100 мл, приливают i мл О, 1 -ного ацетонового. раствора реагента, 1 мл 20 .-ного раствора сегнетовой соли и доливают буферным раствором с рН 8,0-9,0 до 25 мл.
Приливают 5 мл четыреххлористого углерода и экстрагируют избыток непрореагировавшего реагента в течение
30 с. К водной фазе приливают 5,5 мл н-бутилового спирта и экстрагируют в течение 1 мин. Водный слой отбрасывают, а органический слой сливают в кювету с 2 = 1 см и измеряют оптическую плотность на фотоэлектроколориметре или спектрофотометре (600 нм) на фоне н-бутилового спирта.
Пример 1. Навеску стали 20
О, 1-0,2 г (стандартный образец 157 r, 53а) растворяют при нагревании в разбавленной соляной кислоте (1:1) с добавлением нескольких капель азотной кислоты (пл, 1,4) и помещают в мерную колбу емкостью 100 мл. Аликвотную часть раствора помещают в .мерную колбу емкостью 25 мл, приливают 1 мл 0,1 -ного раствора реагента в ацетоне, 1 мл 20 .-ного раствора З0 сегнетовой соли и доливают буферным раствором до метки. Оптическую плотность растворов измеряют на спектрофотометре или фотоэлектроколориметре (при 5 = 600 нм). Содержание никеля
35 рассчитывают по градуировочному графику, который строят в интервале концентраций от 5 до 100 мкг никеля.
Результаты определения никеля в сталях (n = 4, P = 0,95 t = 3,182) 4о приведены в табл. 1.
Пример 2. Способ определения никеля в сталях. Навеску стали 0,1—
0,2 r растворяют при кагревании в разбавленной соляной кислоте (1:1) с добавлением нескольких капель азотной кислоты (пл, 1,4) и помещают в мерную колбу емкостью 100 мл. Аликвотную часть раствора, содержащую не более 100 Ni, помещают в делитель- SO ную воронтку емкостью 50-100 мл, при.ливают 1 мл 0,1%-ного ацетонового раствора 2-(4-метоксибензопл)-4. (2нитрофенил)ацетгпдразидина, .1 мл
20 -ного раствора сегнетовой соли и 55 доливают буферным раствором с рН
8,0-9,0 до 35 мл. Приливают 5 мл четыреххлористого углерода и экстрагируют избыток непрореагировавшего реагента в течение 30 с. К водной фазе приливают 5,5 мл н-бутилового спирта и экстрагируют комплексное соединение никеля в течение 60 с. Водный слой отбрасывают, а органический слой сливают в кювету с Р = 1 см и измеряют оптическую плотность на фотоэлектрокалориметре или спектрофотометре (7 = 605 нм) на фоне н-бутилового спирта.
Результаты определения никеля в сталях (п = 4, Р = 0,95, г. = 3, 182) приведены в табл. 2.
Оценка полученных результатов и сопоставление их с аттестованными содержаниями показывает отсутствие систематических ошибок, Пример 3. Определение никеля в образцах асбеста. Навеску асбес. та 0.,1-0,2 r растворяют при нагревании в царской водке, затем кипятят в течение 5-10 мин, нерастворимый осадок отфильтровывают, филътрат переносят в мерную колбу емкостью
100 мл. Далее определение никеля проводят аналогично способу, описанному в примере 2.
Определение никеля в образцах асбеста (n = 6, t о9, 5 = 2,57 1) при) ведено в табл. 3.
Сравнение результатов определения никеля (по F u t-критериям), полученных двумя различными методами, показало отсутствие систематических расхождений между средними результатами.
Пример 4. Определение никеля в водах термальных источников.
Воду термальных источников кон-центрируют упариванием, затем аликвотную часть раствора, содержащую не более 100 мкг fi, помещают в делительную воронку, приливают 1 мл
О, 1%-ного ацетонового раствора 2-(4метоксибензоил-)-4-(2-нитрофенил)ацетгидразидина, 1 мл сегнетовой соли и доливают буферным раствором с рН 8 0-9,0 до 25 мл, далее аналогично примеру 1. Определение никеля в водах термальных источников (n = 4, йод, = 3,182) приведено в табл. 4.
Преимущество предлагаемого способа по сравнению с известным способом определения малых концентраций никеля заключается в том, что органический реагент 2-(4-метоксибензоил)-41112274 упрощает методику.. определения, сокращает объем работ и дает выигрыш во времени. (2-нитрофенил) ацетгидразидин является более избирательным по отношению к ионам никеля, что значительно
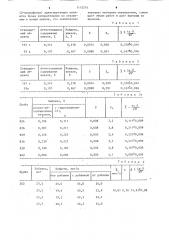
Таблица 1
Найдено, никеля, Х, %
Аттестованное
Стандарт.ный обсодержание никеля, 7 разец
0,378-0,014
0,167 0„016
О, 020
0,051
0,0074
0.,378
° 0,167
0,374
О, 170
157 г
0,0088.г
53 а
Таблица 2
Найдено, никеля, 7
Стандартный обАттестованное
tp ° S
Sr содержание никеля, 7 разец
0,378-0,014
0,167-0,016
0,374
0,170
0,020
0,051
0,0074
0,0088
0,378
О, 167
157 г
53а
Таблица 3
Найдено, %
Проба
tp S
l атомно-абсорбционным методом, Y с гидразидином741, 824
7,2
3,8
826 .
2,4
829
3 5
836
0,187+0 006
838
2,8
0,084+0,004
4,1
842
Таблица 4
Найдено, мкг/л
tp S
S Х
1п
Лобавка, мкг .
Х, мкг/л от добавки
Проба без добавки с добавкой
24,0
23,5
202
44,0
20,0
43,5
23,9
23,5
23,3
42,5
44,5
23,5
19,2
20,5
24,0
23,5.
0,106
0,207
0,226
0,230
О, 190
О,О8О
О, 111
0,211
0,225
0,227
0,187
0,084
0,008
0,008
0,005
0,008
0,005
0,003
О, 111-0, 009
0,211-0,009
0,225+0,006
0,227-0,009
19,Я3 0,56 19,83"0,88
1112274
Продолжение табл. 4
Проба
Добавка, мкг
tð 8
Х вЂ”вЂ” ï
Х, мкг/л без добавки с добавкой от добавки
204
23,5
24,0
16,0
40,0
16, 30,,63 16,,13-1, 00
23,5
23,0
40,0
17,0
24, 1
23,5
39,6
15,5
23,5
23,2
16,0
39,2
Заказ 6449/29 Тираж 822 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, iK-35, Раушская наб,, д. 4/5
Филиал ППП "Патент", r, Ужгород, ул. Проектная, 4
Составитель В. Шкинев
Редактор Н. Джуган ТехредC..Пегеза Корректор В. Бутяга с