Способ выделения лейцинаминопептидазы
Иллюстрации
Показать всеРеферат
СПОСОБ ВВДЕЛЕНИЯ ЛЕЙЦИНАМИНОПЕПТИДАЗЫ из биологических жидкостей , предусматривающий нанесение пробы жидкости на хроматографическую колонку, заполненную сорбентом, с последующим элюированием целевого продукта , отличающийся тем, что, с целью упрощения способа, в качестве исходного сырья используют биологические жидкости больных с демиелинизирующими заболеваниями, в качестве сорбента используют сефадекс G-75, промывают колонку физиологическим раствором и вьщерживают сорбированный на сефадексе фермент 3-4 сут, а целевой продукт элюируют физиологическим раствором.
СОЮЗ СОВЕТСНИХ
Э
РЕСПУБЛИК
С 12 N 9/48; А 61 К 37/48
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTOPCHOMY СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 3581801/28-13 (22) 28.03.83 (46) 23.09.84. Бюл. Р 35 (72) А.П.Хохлов, Т.С.Баскаева, Ю.Н.Савченко и Н.А.Хрусталева (71) 1-й Московский ордена Ленина и ордена Трудового Красного Знамени медицинский институт им.И.М.Сеченова (53) 577. 15(088.8) (56) 1 ° Авторское свидетельство СССР
В 975797, кл. С 12 N 9/48, 1980.
2. Патент Японии В 56-6276, кл. С 12 N 9/48, 1981. (54)(57) СПОСОБ ВЦЦЕЛЕНИЯ ЛЕЙЦИНАМИНОПЕПТИДАЗЫ из биологических жидкос„.SU„„1114 99 А тей, предусматривающий нанесение пробы жидкости на хроматографическую колонку, заполненную сорбентом, с последующим элюированием целевого продукта, отличающийся тем, что, с целью упрощения способа, в качестве исходного сырья используют биологические жидкости больных с демиелинизирующими заболеваниями, в качестве сорбента используют сефадекс
Q-75, промывают колонку физиологичес" ким раствором и выдерживают сорбированный на сефадексе фермент 3-4 сут, а целевой продукт элюируют физиологическим раствором.
1 11146
Изобретение относится к биохимии и предназначено для получения широко используемого в биологии и медицине фермента лейцинаминопептидазы.
Известен способ получения лейцинаминопептидазы путем микробиологического синтеза с последующей многостадийной очисткой «1 .
Однако данный способ достаточно сложен, требует длительного времени и дорогостоящих реактивов.
Наиболее близким к изобретению по технической сущности и достигаемому результату является способ выделения лойцинаминопептидазы из крови убойных животных, заключающийся в нанесении исходной биологической жидкости на хроматографическую колонку, заполненную диэтиламиноэтилцеллюлозой, с последующим элюированием це-, щ левого продукта буферным раствором и диализом элюата,, после чего диализат подвергают повторной хроматографии на колонках с гидроксилапатитом и ДЗАЭ-сефадексом. Степень очистки 2 целевого продукта 5042 раза от исходного С23.
Недостатками известного способа являются его сложность и многостадийность. 30
Цель изобретения — упрощение способа.
Указанная цель достигается тем, что согласно способу выделения лейцинаминопептидазы;из биологических
35 жидкостей, предусматривающему нанесение пробы жидкости на хроматографическую колонку, заполненную сорбентом, с последующим элюированием целевого продукта, в качестве исходного,, сырья используют биологические жидкости больных с демиелинизирующими заболеваниями, в качестве сорбента используют сефадекс G -75, промывают колонку физиологическим раствором 4> и выдерживают сорбированный на сефадексе фермент 3-4 сут, а целевой продукт элюируют физиологическим раствором.
Способ заключается в проведении всего одной хроматографической стадии и обусловливает достаточно высокую степень очистки, в среднем 5161 раз.
Упрощение способа при сохранении наибольшего эффекта очистки получают при55 использовании сефадекса Я-75.
При применении частиц декстрана с другими размерами пор (6-10, Ь -25, 99 2
9-50) степень очистки ниже. Жесткие условия опыта не позволяют использовать крупнопористые сефадексы.
Оптимальное время инкубации сефадекса с адсорбированным ферментом установлено опытным путем и составляет 3-4 сут. При инкубации сорбированного фермента менее трех суток активность его не определяется или значитепьно снижена, а более четырех суток — активность фермента также низка по отношению к оптимальной, которая достигается при инкубации в течение
3-4 сут.
Упрощенное получение фермента объясняется следующими причинами. В биологических жидкостях у больных с демиелинизирующими заболеваниями основная масса фермента лейцинаминопептидазы связана с ингибитором. Ингибитор имеет повышенное сродство к соединениям типа дектрана и мол. вес в пределах 20000-50000, поэтому он адсорбируется на колонке с размером частиц, соответствующим сефадексу
Q 75, тогда как связанный фермент имеет мол. вес 150000 и в поры сефадекса ч -75 не проникает. Инкубация в течение указанного времени приводит к отделению фермента от ингибитора, после чего фермент элюируют физиологическим раствором. Ингибитор остается на колонке и может быть использован для реохроматографии.
Предлагаемый способ осуществляют следующим образом.
Биологическую жидкость (сыворотка, кровь, ликвор, моча) наносят на хроматографическую колонку с приспособлениями для центрифугирования, заполненную предварительно отцентрифугированным сефадексом lj -75, центрифугируют в течение 2 мин со скоростью
3000 об/мин, промывают физиологическим раствором для удаления балластных белков и вновь центрифугируют
2 мин со скоростью 3000 об/мин. Колонку инкубируют в течение 3-4 сут при 0-4 C а конечный продукт элюируют физиологическим раствором.
Пример 1. Сыворотку крови больного с рассеянным склерозом наслаивают на хроматографическую колонку (с приспособлениями для центрифугирования), заполненную предварительно отцентрифугиооялнным сефадексом 5-75, центрифугируют 3 мин со скоростью 3000 об/мин> промывают
11146 очист
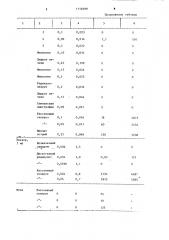
Сыворотка крови, 50 мп
Доноры
0,0096
0,013
0 05
0,08
20 мл физиологического раствора для удаления балластных белков и вновь центрифугируют 2 мин со скоростью
3000 об/мин. Колонку, содержащую сорбированный фермент, инкубируют в течение 72 ч при 4,0 С, конечный продукт элюируют 5 мл физиологического раствора.
Удельная активность ЛАП до инкубации 0,048 ед/г белка, после инкуба- 1О ции — 250 ед/г белка. Степень очистки 5208 раз.
Пример 2. Метод осуществляют аналогично примеру 1, при этом инкубацию проводят 96 ч. Удельная ак- f5 тивность фермента до инкубации
0,011 ед/г белка, после инкубации
60 ед/г белка. Степень очистки
5454 раза.
Пример 3. У больного с рас- 20 сеянным склерозом берут ликвор, проводят исследования аналогичные примеру 1, инкубацию проводят 84 ч. При этом удельная активность ЛАП до инкубации 0,7 ед/г белка, после инкуба- 25 ции 3910 ед/г белка. Степень очистки 5585 раз.
Пример 4. Исследовали мочу больного рассеянным склерозом. Приемы исследования аналогичны примеру 1, 3fI инкубировали 74 ч. Исходная активность ЛАП нулевая, после инкубации
125 ед/г белка.
Специфическая активность целевого продукта подвергается исследованию его активности с помощью ЛАП-теста фирмы Fermognost.
Метод определения JIAII основан на том, что лейцингидразид под влиянием
ЛАП расщепляется, отщепленный гидра- 4О зин образует с 4-диметиламинобензаль—
99 4 дегидом в солянокислой среде оранжево-красное красящее вещество, которое определяют колориметрически. Испытания проводят в четырех пробирках.
Вначале в пробирки 1 и 2 наливают по
0,5 мл лейцингидразида, выдерживают на водяной бане при 37 С в течение
10 мин, в опытную пробирку добавляют
0,2 мп испытуемой жидкости. Далее все пробирки инкубируют на водяной бане при 37 С 30 мин, после инкубации, в контрольную пробу (пробирка 3) вносят 0,7 мл гидразина, а в пробирку (4 вносят 0,7 мл дистиллированной воды. Затем во все пробирки 1-4 добавляют по 5 мл диметилбензальдегида и быстро перемешивают содержимое пробирок.
Далее в пробирку 2 добавляют 0,2 мл испытуемой жидкости и 30 мин инкубируют при 37аС Не более, чем через
6 ч, изменяют экстинкцию опытной про" бы (пробирка 1) против пустой пробы (пробирка 2) и экстпнкцию контрольной пробы (пробирка 3) против второй пустой пробы (пробирка 4), длина волны
455 мм (можно в области 450-460 нм), ширина слоя 1,00 см. При расчете первое полученное значение экстинкции делят HE второс, активность фермента выражают в единицах (1 ед. — количество ЛАП, которое расщепляет 1 мМоль ;лейцингидразиде в течение 1 мин в условиях одной пробы).
Одновременно в исследуемых образцах проводят количественное определение белка методом Лоури и удельную активность фермента выражают на 1 r белка. Выделение лейцинаминопептидазы из различных биологических жидкостей приведено в таблице.
1114699
3 ) 4
О,!
0,06
791
510
О,1
Миопатия О, 13
Цирроз печени 0,45
Миопатия 0,15
Миопатия О, 1
Радикулоневрит
0,2
0,036
0,12
0,046
Спинальная амистрафия 0,09
0,021
О
Рассеянный склероз О, 1
0,016
0,011
4875
0,05
5454
Миелит острый
0 25
0,048
250
5208
Ликвор, 5 мп
Мо зжечк овый синдром 0,006
1,5
Дискогенный радикулит 0,004
0,05!
1,0
0,0036
Рассеянный склероз 0,004
4687
5585
3750
0,8
3910
0,04
0,7
Моча
25
О!
Цирроз печени
Рассеянный склероз
I о,огз
0,014
0,022 о,оз!
0,109
0,024
0,025
Продолжение таблицы
1 11469.9
Составитель О.Скородумова
Редактор Н.Джуга Техред З.Палий- Корректор И.Муска
Заказ 6735/18 Тираж 521 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д.4/5
Филиал ППП "Патент", г.ужгород, ул.Проектная, 4
Данные таблицы показывают, что предлагаемый способ эффективен при использовании биологических жидкостей только от больных демиелиниэирующими заболеваниями. 5 редлагаемый способ значительно упрощен при сохранении высокой степени очистки, позволяет практически использовать биологический материал. взятый у больных с демиелииизирующими заболеваниями, который в настоящее время является отходом после клиникодиагностических исследований.
Преимуществом способа является возможность дальнейшего использования биологических жидкостей после сорбции лейцинаминопептидазы как исходного сырья для получения биологических препаратов.