Способ выделения фибронектина
Иллюстрации
Показать всеРеферат
СПОСОБ ВЬЩЕЛЕНИЯ .ФИБРОПЕКТИНА из плазмы крови путем аффинной хроматографии на сорбенте, представляющем собой матрицу с иммобилизованной желатиной с элюцией фибронектина раствором мочевины, отличающийся тем, что, с целью повышения выхода и чистоты целевого продукта, в качестве сорбента используют обработанные раствором желатины , предварительно поперечносшитые, активированные глутаровым альдегидом желатиновые гранулы, а элюцию фибронектина осуществляют раствором, мочевины в градиенте концентрации 4-8 М при рН 7,2-7,4. СЛ
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН
„„ЯО„„1124230
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н АВТОРСКОМЪ СВИДЕТЕЛЬСТВУ
Az80
1,0
0,5
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И OTHPbfTHA (21) 3567898/28-13 (22) 29.12.82 (46) 15.11.84. Бюл, К - 42 (72) Г.А. Ермолин, В.Э. Котелянский, Е,Е, Ефремов, А.И. Сапожникова, Л.В. Курманова, Р;И. Литвинов и P.Ã. Мухутдинова (71) Всесоюзный кардиологический научный центр АМН СССР (53) 543.54(088.8) (56) 1. Mosesson М.W. Umflut R.À.
3. Biol. Chem . 1970, N - 245, S.5728 â€
5736.
2. Vuento M, Vaheri А. Риг йхса. tion of fibronectin. — Biochem. J
1979, 183, Р 2, р. 331-337.
3. Авторское свидетельство СССР
У 984305, кл. G 01 N 33/48, 1981.
3(5O G 01 И 33/50; С 07 О 7/00 //
// А 61 K 37/02 (54) (57) СПОСОБ ВЬЩЕЛЕНИЯ ФИБРОНЕКТИНА из плазмы крови путем аффинной хроматографии на сорбенте, представляющем собой матрицу с иммобилизованной желатиной с элюцией фибронектина раствором мочевины, о т л и— чающий с я тем, что, с целью повышения выхода и чистоты целевого продукта, в качестве сорбента используют обработанные раствором желатины, предварительно поперечносшитые, активированные глутаровым альдегидом желатиновые гранулы, а элюцию фибронектина осуществляют раствором мочевины в градиенте концентрации
4-8 M при рН 7,2-7,4.
1124230
Изобретение относится к медицине, в частности к прикладной медицинской биохимии.
Фибронектин представляет собой высокомолекулярный белок плазмы крови и необходим для лечения обширных травм; сепсиса, ожогов, последствий обильных кровопотеоь, острых кишечных инфекций.
Известен способ вьделения фибро- 10 нектина с помощью хроматографии на
ДЭАЭ-целлюлозе криопреципитата сыворотки крови, заключающийся в том, что свежую кровь свертывают при 37 С, и центрифугируют при 3000-4000 об/мин,15 отделившуюся сыворотку вьдерживают
10 — 12 ч при 4а С. По истечении этого срока выпадает бельй хлопьевидный осадок, который многократно отмывают физиологическим раствбром и хроматографируют затем на ДЭАЭ-целлюлозе, отделяя фибронектин от сопутствующих белков $1).
Указанная методика не дает возможности получить достаточно чистый препарат фибронектина, посколькукриопрецйпитат сыворотки содержит множество белков, плохо отделяющихся от фибронектина.
Известен также способ выделения 30 фибронектина из плазмы крови путем аффинной хроматографии на нерастворимом сорбенте, представляющем собой желатину, иммобилизованную на активированной бромцианом сефарозе с элюцией фибронектина буфером или раствором аргинина. Метод основан на способности фибронектина специфически связываться с желатиной(23.
Недостатками способа являются невысокие выход белка (60%) и чистота продукта,.а также контакт с высокотоксичным реагентом, каким является оромциан, используемый для.акти- 4$ вации матрицы сорбента.
Наиболее близким к предлагаемому по технической сущности и достигаемому результату является способ вьде- 50 ления фибронектина из плазмы или сыворотки крови путем аффинной хроматографии на сорбенте, представляющем собой матрицу — активированную тионилхлоридом карбоксиметилцеллюлозу — с 55 иммобилизованной желатиной.с элюцией 4,0-4,5 М раствором мочевины при рН 7,4-7,5 С33.
Способ характеризуется недостаточно высокими выходом и чистотой вьделяемого фибронектина (90%).
Цель изобретения — повышение выхода и чистоты целевого продукта.
Указанная цель достигается тем, что IIO способу вьделения фибронектинз из плазмы крови путем аффинной хроматографии на сорбенте, представляющем собой матрицу с иммобилизованной желатиной с элюцией фибронектина раствором мочевины, в качестве сорбента используют обработанные раствором желатины, предварительно попереченосшитые, активированные глутаровым альдегидом желатиновые гранулы и осуществляют эл цию фибронектина раствором мочевины в градиенте концентрации 4-8М при рН 7 2-7,4, Вышеприведенная совокупность признаков способа обеспечивает более полное сродство выделяемого белка с афинным сорбентом, более эффективные условия элюции, что, в конечном итоге, обеспечивает лучшие, по сравнению с известным способом, характеристики процесса выделения.
В предлагаемом способе в качестве матрицы используют поперечносшитыс желатиновые гранулы, а желатину иммобилизуют на них путсм инкубации ее
1%-ного раствора с гранулами в течение 1 — 1,5 ч при 37-39 С и рН 7,2-7,4 или в течение ночи при 4 . Затем сорбент отмывают от несвязавшейся ! желатины збуференным физиологическим раствором рН 7,2-7,4 и блокируют свободные альдегидные группы путем инкубации гранул в растворах 0 1М лизина или 1М этаноламина. После отмывания гранул их инкубируют в 4М мочевине или 2М Kbr в течение
1,5 ч при 37-39 С, снова отмывают забуференным физиологическим раствором рН 7,2-7,4 и используют для получения фибронектина из плазмы.
Матрицу для предлагаемого сорбента, т.е. гранулы поперечносшитой желатины, получают путем вливания 15—
20%-ного раствора желатины в 0,1М цитратном буфере рН 5,0 при 85-90 С в а вазелиновое масло, нагретое до 75-80 С, с дальнейшим перемешиваниемдвухфазной смеси механической мешалкой при
1500-1700 o6/Nèí и последующим охо лаждением смеси до 4 С. Образовавшиеся гранулы отделяют путем декантирования,промывают от масла гексаном или ° петролейным эфиром при 4 С и обрабатывают сначала О, 5 раствором глутарового альдегида в течение 10-15 ч при
4 С, а затем 5 -ным раствором глутароо вого альдегида в течение 2-3 ч при рН
5,0 и 37 С.Поперечносшитые, активированные глутар овым альдегидом желатиновые гранулы тщательно отмывают забуференным физиологическим раствором vFI 10
7,2-7,4.
Выделение .фибронектина из плазмы проводят следующим образом.
После отмывания полученного сорбента (желатины на желатиновых грану-1f лах) забуференным физиологйческим раствором рН 7,2-7,4 на сорбент наносят свежую или размороженную плазму в отношении 10 мл плазмы на 1 мл сорбента и инкубируют смесь в течение 20
1 5-2 ч при комнатной температуре.
Сорбент промывают Физиологическим раствором рН 7,2-7,4, чтобы удалить все несвязавшиеся белки плазмы. Элюцию фибронектина проводят градиентом 25
4-8М мочевины в буфере, рН 7,2-7,4.
Полученный белок диализуют против физраствора рН 7,2-7,4, концентрируют до 10 мг/мл и хранят до использования в течение двух недель при Зр
4 С. Более длительное время фиброо нектин следует хранить при -20 С.
Общий выход фибронектина — po 97 от среднего содержания в плазме.
Достигаемая чистота 99%.
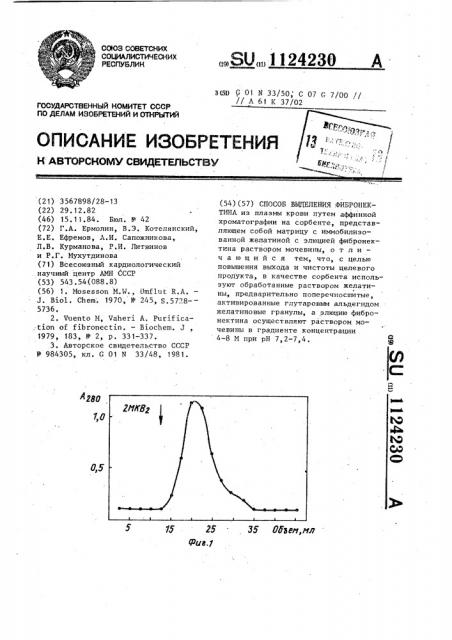
На фиг. 1 приведен график элюции фибронектина с сорбента; на фиг. 2 . характеристика фибронектина на степень чистоты и гомогенности; на фиг. 3 — то же, иммунофореграмма ° 40
Пример . 20 г желатины в
100 мл 0,2 М цитратного буфера рН
5 0 нагревают до 85 С к вливают в
0,5 .ч вазелинового масла, нагретого до 80 С. Смесь, помещенную в баню с тающим льдом. интенсивно перемешивают пропеллерной мешалкой 15 мин при 1700 об/мин ° Затем смесь о стаивают и отсасывают масло. Нелатиновые гранулы трижды отмывают трехкратным объемом петролейного эфира или гексана при 4 С, затем заливают
200 мл 0,5 раствора глутарового
1124230 альпегипа в 0,1 М цитратном буфере рН 5,0 и инкубируют. 10-15 ч при
4 С. После этого концентрацию глутарового альдегида доводят до 5% и инкубируют смьсь 2-3 ч при 37 С, Цоперечносшитые желатиновые гранулы, активированные глутаровым альдегидом, многократно отмывают забуференным физиологическим раствором рН 7,2-7,4 и затем смешивают с равным объемом раствора желатины (10 мг/мл) в том же буфере. Смесь перемешивают в течение ночи при
4 С или в течение 1,5 ч при 37 С.
Затем гранулы многократно отмывают от несвязавшегося белка забуференНым физраствором и суспендируют в
200 мл О, 1 М лизина или 1М этаноламина в течение 2 ч при 37 С. После этого суспензию инкубируют 1,5 ч при 37 С в 4М растворе мочевины, трижды отмывают пятью объемами забуференного физраствора рН 7,2-7,4 и используют для получения фибронектина из плазмы крови человека.
100 мл свежей или размороженной плазмы добавляют к 10 мл приготовленного сорбента и инкубируют смесь при комнатной температуре в течение
1,5 ч. Сорбент промывают эабуференным физиологическим раствором, чтобы удалить все несвязавшиеся белки плаз. мы. Элюцию фибронектина проводят градиентом 4-8М мочевины в буфере рН 7,2-7,4. Полученный белок диализуют в течение 36 ч против забуференного физиологического раствора при рН 7,2-7,4, концентрируют да 10мг/мл о и хранят до использования при 4 С в течение 12 дней или дольше при
-20 С. Выход м 97 ..
Таким образом, предлагаемый способ по сравнению с изв"стным обеспечивает повышение выхода в среднем до 977, Уровень исходного фибронектина в плазме подвержен резким колебаниям (180-600 мг/л), однако емкость сорбента такова, что позволяет за один шаг иммуносорбци . произвести исчерпывающее извлечение фибронектина.
Результаты выделения фибронектина приведены в табл. 1.
1124230
Таблица 1 !
Исходное содержание фибронектина в плазме, мг/л
Партия сорбируемой плаз97,8
230
225
97,6.
420
410
98,3
305
300
190
98,4
187
280
270
96,4
Выделенный по предлагаемому способу фибронектин (препарат) характеризуют на степень чистоты и гомогенности следующими методами: аналитическим ультрацентрифугированием; диск-злектрофорезом в полиакриламид- >> ном геле; иммунозлектрофорезом; детекцией эффекта на адгеэию и рас пластывание клеток.
В результате в SDS-электрофорезе в полиакриламидном геле показана ro- 30 могенность фибронектина, что согла-, суется с, данными 52 3 (фиг. 2А), Чистота препарата 99%.
Аналитическое ультрацентрифугирование (фиг. 2В) в диапазоне 14-17 ед.з
Сведберга {S) также свидетельствует об отсутствии загрязнения препарата иными макромолекулами.
На иммунофореграмме (Ьиг. 3), .проявленной антисывороткой к сыворо- 4б точным белкам человека (1) и моноспецифической антисывороткой к фибронектину (1Т), показана серологическая гомогенность фибронектина (НФ, 3,0 мг/мл) и отсутствие загрязнения 4 иными плазменными антигенами.
Поверхность гезия, Расплас% тывание, %
Коллаген
Таблица 3
Партии фибронектина:Среднее из трех партий
Фибриноген
11,5 9,0 15,5
12 0
0,24
Продукты деградации фибриногена 2,3
4,3
6,0
4,2
О, 084 аименование примесных белков
Дипопротеиды низкой плотности
Количество выделенного фибронектина
В табл. 2 приведены данные по биологической активности фибронектина (адгезии и распластыванию клеток на . поверхности, покрытой коллагеном) °
Таблица 2
Коллаген, обработанный фиброкектином 88
Данные говорят о том, что основные характеристики биоактивности фибронектина сохранны (повышение адгезии клеток на 70% и распластывание на 35%) по сравнению с контролемм.
Данные иммуноферментного анализа примесных белков в препаратах фибронектина, полученных предлагаемым способом приведены в табл. 3.
3 мг/мл % от среднего содержания
1124230
8.
Продолжение -табл. 3
20,0 32,0 17,0
23;0
0,46
0,019
1,2
0,96
2,3
3,13
0,06
Следы
Следы
ФН
Составитель О, Скородумова
Редактор И.Рыбченко Техред Я.Кастелевич Корректор И. Эрдейи
Заказ 8272/34 Тираж 822 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент.", г. Ужгород, ул. Проектная, 4 Липопротеиды высокой плотности
Иммчноглобулины: С
Внеэритроцитарный- гемоглобин
Другие сывороточные белки
Предлагаемый способ позволяет достаточно простым методом извлечь из нлазмы крови с высоким выходом.
1,0 0,7
3,9 3,2
Следы и высокой степенью чистоты фнбронектин, являющийся ценным лечебным препаратом.