Способ получения производных @ -карбамилфенилглицина
Иллюстрации
Показать всеРеферат
СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ Ы-КАРБАМШ1ФЕНШ1ГЛИ1ЩНА путем ферментативного гидролиза растворов соответствуюпщх производных гидантионов , отличающийся тем, что, с целью обеспечения возможности использования концентрированных растворов 1гидантоинов при высоком выходе целевых продуктов, ферментативный гидролиз осуществляют штаммом Bacillus brevis NRRL 1286 или Bacillus stearothermophilus NRRL 1287 при 40-50 0. О)
СОЮЗ СОВЕТСКИХ
СОЦ ВЛИСТИЧЕСКИХ
РЕСПУБЛИК д511 С 12 Р 13/00
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР.
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
H IlATEHTY
У(-)В-кй1Иа аи1фенм иихф а/, р (21) 2589348/28-13 (22) 15.03. 78 (31) 21232 А/77 (32) 15.03.77 (33) Италия (46) 15. 11.84 Бюп. 11 42 (72) Аурелио Вилья, Эудженио Фасчетти, Елена Перрнконе (Италия) и Людвиг Деген (ФРГ) (71) Аник С.п.А. (Италия) (53) 663.18(088.8) (56) 1. Патент СССР В 810082, кл, С 12 Р 13/04, опублик. 1981.
„,SU „„1124889 А (54) (57) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОД Ъ|Х N-КАРБАИИЛФГНИЛГЛИЦИНА путем ферментативного гидролиза растворов со" ответствующих производных гидантионов, отличающийся тем, что, с целью обеспечения возможности
> использования концентрированных растворов гидантоинов при высоком выходе целевых продуктов, ферментативный гидролиз осуществляют штаммом Bacil
lus brevis NRRL 1286 или Bacillus
stearothermophilus NRRL 1287 при
40-50 С.
89 3
1 . 11248
Изобретение относится к микробиологической промышленности, а именно к способу получения производных фенилглицина, в частности N-карбамилфенилглицина и карбамилпараметокси5 фенилглицина, используемых в фарма— цевтической промышленности.
Известен способ получения производных фенилглицина, в том числе
N-карбамилфенилглицина, заключающийся в проведении ферментативного гидролиза 5-(D,L) -фенилгидантоина штаммом Pseudomonas sp. 942 или 945 при
30 С в течение 24 ч 1).
Выход целевого продукта составляет 57-907 от теоретического при максимальной концентрации 20 мм/мп.
Цель изобретения — обеспечение возможности использования концентрированных растворов гидантоинов при высоком выходе целевых продуктов.
Поставленная цель достигается тем, что согласно способу получения производнык N-карбамилфенилглицина, предусматривающему ферментативный гидролиз растворов соответствующий производных гидантоинов, Ферментативный гидролиз осуществляют штаммом
Bacillus brevis NRRL 1286 или Bacil—
lus ьtearothermophilus NRRL 1287 при 40-50 С.
Способ осуществляется следующим образом.
Бактериапьные штаммы, выделенные из почвы, овощей и мусора, инокулируют при 50 С со скошенного агара в 35 колбы Эрленмейера объемом 250 мл, содержащие каждая по 50 мл следующей питательной среды, при рН 7,2, г/л:
Мясной пептон !О
Дрожжевой экстракт 10
NaC1, 3
5-D L-метилгидантион l
Э о
Среду стерилизуют при 110 С в течение 30 мин. Инкубирование проводят ч течение 18-20 ч при 50 С при перео 45 ешивании. В колбу Эрленмейера объем
500 мл помещают 100 мл той же среды с добавлением 2 мл предварительно
- приготовленной культуры. После 1618 ч дополнительной выдержки проводят ферментативную реакцию, для чего в пробирку, содержащую 10 мп 0,07 M фосфатного буфера при рН 8,5 и
20 мкмоль/мп 5-D L-фенилгидантоина, вносят f мл бактериальной суспензии (сухой вес 40 мг/мп). По прошествии
15 мин инкубирования при 40 С прово. дят реакпию с b -диметиламинобензальдегидом для количественного определения полученного таким путем карбамилпроизводного.
В способе используют культуры
Bacillus brevis u Bacillus stefrothermophilus которые были переданы на хранение в 1977 r. в Северный региональный исследовательский центр
r. Пеория, штат Иллинойс, США. Им были присвоены номера NRRL 11079 для штамма 1286 и NRRL-В 11080 для штамма 1287.
Характеристика штаммов представлена в табл. I.
Во время протекания ферментативного гидролиза D -гидантоина при рН 7-10 установлено, что в результате получающиеся карбаминпроизводные находятся в D-форме. Химическая структура и его .идснтичность N -карбамил-! фенилглицину и N-карбамилпараметоксифенилглицину подтверждена после перектристаллизации продукта реакции с помощью ИК-спектров N.M.R. массспектрометрии и элементарного анализа. Постоянные оптического вращения
25оС о составляют соответственно (oL) +-137 (С=1 в 1 н. растворе ЯН+ОН) ego(3
zoo
140 (С=1 в 1 н. растворе МН4ОН), что соответствует литературным данным.
Гидролиз может протекать при использовании целых клеток микроорганизмов, спор .или экстрактов вышеназванных микроорганизмов с помощью так называемых покоящихся клеток, для чего выделенные из культуральной среды бактериальные клетки после тщательной промывки суспендируют в буфере с добавлением рацемического гидантоина. Могут быть использованы препараты, содержащие гидролазу, такие как ее экстракты или концентраты, очищенные гицролазы, полученные с использованием вышеназванных микроорганизмов.
Пример 1..Готовят среду для бактериального штамма В.brevis 1286 следующего состава, г/л:
Мясной пептон 10
Дрожжевой экстракт 10
NaCi 3
5-D,L-метилгидантоин 1
PH среды доводят до 7,2, стерилизуют при 110 С в течение 30 мин и инкубируют. Отбирают 100 мл культуральной жидкости, помещают в колбу
Эрленмейера объемом 500 мл и добавляют на 18 часу инкубирования (с ис1 1248
3 пользованием планетарной мешалки) при 40 С 100 мл 0,14 И фосфатного буфера (рН 8,5) содержащего
40 мкмоль/мп 5-(Р,L) -фенилгидантоина.
По прошествии еще 4 ч инкубирования
5 при тех же условиях определяют количество полученного таким путем Nкарбамилф енилглицина .
Из 705 мг 5-(D,Е)-фенилгидантаина получают 700 мг И-карбам лфенилглицина, что соответствует выходу приблизительно 90%.
Пример 2. Также, как в примере 1, но по прошествии 4 ч при
40 С и с помощью штамма В. stearo15
thermophilus NRRL 1287 из 705 мг
5-(D,L)-фенилгидантиона получают
600 мг N-карбамилфенилглицина, что соответствует выходу около 85%.
Пример 3. Готовят среду, имеющую приведенный выше состав и содержащую 1 г/л 5-(D,L)-метилгидантоина. Добавлением соды рН доводят до 7,5 и культуральную жидкость распределяют порциями по 50 мл в
Эрленмейера объемом 250 мл. После стерилизации в течение 30 мин при
110 С колбы инокулируют штаммом Вас Пса brevis NRRL 1286 со скошенного агара, содержащего ту же твердую среду с агаром (фирма "ЦИФКО") при
2%-ной концентрации, и инкубируют в течение 22 ч при 40-С с использовао, нием планетарной мешалки со скоростью 220 об./мин.
Используя полученную культуру (оптическая плотность 0,4 при 550 нм, разбавление 1:10) в количестве 2 мп для инокулирования 100 мл той же сре †ды в 500-миллилитровых колбах Эрлен— мейера, полученную культуру инкуби- 40 руют при 40 С с использованием планетарной мешалки (220 об./мин), в течение 18 ч. Клетки отделяют от бульона центрифугированием при
g-500 (g — ускорение силы тяжести) 45 в течение 20 мин, промывают трижды изотоническим раствором при рН 8,0 и суспендируют в 0,07 M фосфатном буфере (рН 8,5), получая тем самым покоящиеся клетки. 50
Для проведения реакции ферментативного гидролиза при 40 С и перемешивании (220 об/мин) в 250-миллилитровых колбах Эрленмейера инкубируют
64 мп реакционной смеси, содержащей
200.мг бактерий (сухой вес) и
20 мкмоль/мп 5-(D,L)-фенилгидантоина (3,52 мг/мп). В подходящие моменты времени проводят измерения содержания продукта гидролиза т,e. D-карбамилфенилглицина, с использованием колорнметрического метода на
438 ммкм.
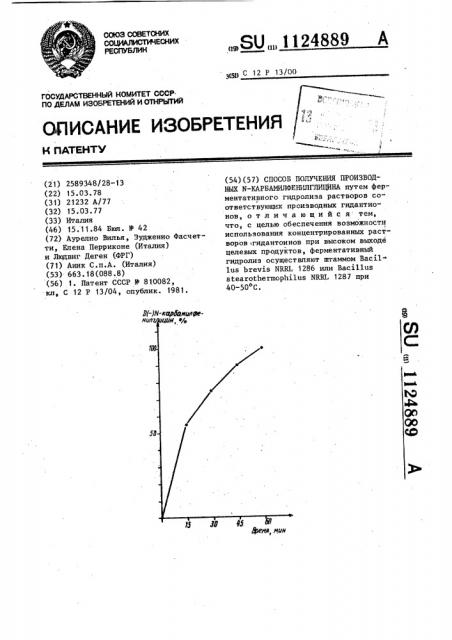
Еа чертеже дана кривая зависимости, выражающая процент теоретического выхода получаемого карбамилпроизводного.
Пример 4. Бактериальные клет ки штамма В. brevis NRBL 1286 получают описанным в примере 3 путем.
Суспензию клеток (41,5 мг/мп сухих бактериальных клеток) помещают в буфер фосфатных солей при рН 8,5, подвергают механическому измельчению в гомогенизаторе типа Manton laulin при температуре ниже 35 С и давлении
650 кгс/см Клеточный мусор отделяют от экстракта в с помощью центрифугирования (25000-кратное ускорение силы тяжести в течение 30 мин). К 970 мл
0,2 М буфера фосфатных солей (рн 8,5), содержащего 4,7 г 5-(D,L) -фенилгпдантоина, добавляют 30 мл экстракта, содержащего 280 ед. фермента (одна единица соответствует количеству фер-. мента, которое обеспечивает преобразование 1 мкмоль/мл в минуту субстрата в 0,2 И фосфатном буфере, рН 8,5, при 50 С, причем буфер содержит 20 мкмоль/мл 5-(D,L)-фенилгидантоина). По прошествии одного часа образуется 3,2 г И вЂ карбамилфенилглицина, что соответствует приблизительно 63% полногб гидролиза.
Пример 5. Готовят полусинте" тическую среду, имующую следующий состав, г/л: ин„сХ 5
Наг РО 7,05
КнгРО 2,72
Мясной пептон 5
Дражжевой экстракт 0,5
5- (D,L) -Цетилгидантоин 1,0
Среду распределяют порциями по
50 мл в колбы Эрленмейера емкостью
250 мл и.по 100 мл в колбы Эрленмейера емкостью 500 мл и стерилизуют в течение 30 ьп н при 110 С ° Посевную культуру получают инокулированием в
250-миллилитровых колбах со скошенного агара культурой штамма В.Ьгечis и инкубируют, как в примере 4, при
40 С в течение 22 ч, Для инокулиров .ния эту культуру (оптическая плотность 0 105 при 550 нм, разбавление
1: 10) отбирают в количестве 2,5 мл
3 112488 в колбы Эрленмейера объемом 500 мл, содержащие ту же среду. По прошествии 15 ч инкубирования при 40 С реакционная смесь содержит в 64 мл буфера 100 мг бактерий (в пересчете на сухой вес и эквивалент 100 мл бульонной культуры) и 20 мкмоль/мл
5-(Р,Ь)-фенилгидантиона.
По прошествии 5, 10 и 15 мин проводят определение количества получен- 10 ного N-карбамилфенилглицина, которое соответственно равно 0,6; 1,0 и
1,4 мкмоль/мл.
Пример 6. Готовят нитательную среду, состоящую из воды от зама- 15 чивания кукурузы в количестве 2,67 (в пересчете на сухой вес). Среду доводят до рН 7,5 с помощью КОН, распределяют порциями по 50 мл в колбы емкостью 250 мл, а также порциями по
100 мл в колбы емкостью 250 и 500 мл с последующей стерилизацией в течение 30 мин при 110 С. Для получения посевной культуры производят инокулирование в колбах по 250 мл со скошенного агара с культурой штамма
В brevis .МВШ 1286 с последующим инкубированием, как в примере 4, при
40 С в течение 22 ч.
Для инокулирования среды в колбах по 500 мл отбирают по 2,5 мл полученной посевной культуры. По прошествии
18 ч инкубирования при 40 С получают покоящиеся клетки аналогично примеру 3.
Ферментативный гидролиз проводят при 40 С в реакционной смеси, содер" жащей в 64 мл 0,07 М фосфатного буфера (рН 9,5) бактериальные клетки, полученные из 100 мл бульонной куль<0 ????????, ?? 20 ????????????>
По прошествии 5, 10, 15 и 60 мин определяют количество полученного таким путем N-карбамилфенилглицина и N-карбамилпараметоксифенилглицина, 50
Результаты представлены в табл.2.
Пример 7. Получают, ацетоновый порошок клеток штамма Bacillius
Ьгevis NRRL 1286, и 80 мг этого по9 б рошка, содержащего 420 ед. фермента, суспендируют в 1 л 0,2 М фосфатного солевого буфера (рН 8,5), содержащего 5,0 г 5-(D,L)-фенилгидантиона.
По прошествии одного часа при 50 С получают 4,8 г N-карбамилфенилглицина, что соответствует приблизительно 8?X полного гидролиза.
Пример 8. С использованием штамма Bacillus brevis NRRL 1286 получают биомассу в 20-литровом ферментаторе Fomel, содержащем 16 л культурной среды рН 7,8, имеющей состав, г/л:
Дрожжевой экстракт 10
Мясной пелтон 10
НаСХ 3
К НР04. 0,56
5-(D,1.)-Метилгидант.аин 1
Культур в ферментаторе инокулируют с использованием 16- мл посевной культуры (оптическая плотность
0,360 при 550 нм, разбавление 1:10), выращенной в 50-миллилитровых колбах, содержащих 100 мл той же питательной
-среды, и инкубированной в течение
16 ч при 40 С при перемешивании (220 об/мин) . Ферментацию проводят при рН 7,8 с добавлением 2н.HC R, при поддержании коэффициента О.А.Р. порядка 0,45. К 16-му часу ферментации (оптическая плотность 0,350 при
550 нм. разбавление 1:10) биомассу отделяют от культуральной жидкости с помощью центрифугирования в сеператоре фирмы "Альфа Лаваль" при комнатной температуре.
Клетки промывают изотоническим раствором при рН 8,0. Ферментативный гидролиз осуществляют при 40 С в реакционной смеси, содержащей в 64 мл
0,07 М фосфатного солевого буфера (рН 8,5) 0,5 г бактериальной суспензии (эквивалентно 0,120 r сухих клеток) и 20 мкмоль/мл 5-(D,L)-гидантоина, и в реакционной смеси, аналогичной вышеуказанной,но содержащей
20 мкмоль/мл 5-(D,L)"H-метоксифенилгидантоина. По прошествии 5, 10, 15 и 60 мин определяют количество полученного N-карбамилфенилглицина и N-карбаминпараметоксифенилглицина.
Результаты представлены в табл.3.
Таблица
1 t 24889
Характеристика штамма
0,6-1
2,0-3,5 длина
Эллипсоидная . Эллипсоидная форма спор
Подвижность
40-50
40-50
Катал аза
Уреаза
7Х-ном
Оптимум рН
Наименование показателей
Bacillus brevis
ЯКИ 1286
Палочки, мм: ширина
0,6-0,9
1, 5-4
Реакция Грама
Cr.ора
Субтерминаль° ное
Доминирующее положение споры
Иаксимальная температура роста, С
Минимальная температура роста, С
Аназробный агар
Гидролиз крахмала
Разложение казеина
Щелочная реакция в
У-Р бульоне
Отношение к нитратам и нитритам (ЯО,NO ) Рост в хлориде натрия:
ЗЖ-ном
Bacillus stearothermophilus
ЯКИ 1287
Субтерминальное
10! 124889
Та блица 2
Время, мин
Полученный Я- карбамилфенил— глицин
Полученный N-карбамил-и-метоксифенилглицин
Количество, мкмоль/мл
Конверсия „%
Конверсия, %
Количество, мкмоль/мп
6,55
6,45
32,8
32,3
55,5
10,9
54,5
14,85
15,05
75,5
74,2
19,8
19,85
99,0
99,2
Таблица 3
Полученный N-карбамил-й"метоксифенилглицин
Полученный И-карбамилфенилглицин
Время, мин
Количество, мкмоль/мп
Конверсия, %
Конверсия, %
Количество, мкмоль/мл
20,5
4,10
28,2
4,05
7,6
38,2
7,65
38,0
10,5
52,5
52,0
10, 4.
90,5
18,1
91,0
18,2
Заказ 8305/47 : Тираж 521 Подписное
ВНИИПИ Государственного комитета. СССР по делам изобретений и открытий
113035, Иосква, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г.ужгород, ул.Проектная, 4
Составитель И.Ларина
Редактор И.Рыбченко Техред С.Мигунова Корректор М.Иаксимишинец