Состав мембраны халькогенидного стеклянного электрода для определения ионов железа ( @ )
Иллюстрации
Показать всеРеферат
СОСТАВ MEbfBFAHH ХАЛЬКОГЕНИДнего СТЕКЛЯННОГО ЭЛЕКТРОДА ДЛЯ ОПРЕДЕЛЕНИЯ ИОНОВ ЖЕЛЕЗА (III) , содержащий селен, отличающийся тем, что, с целью расширения рабочего диапазона рН, улучшения воспроизводимости потенциалов и уменьшения времени отклика, в состав мембраны дополнительно введены медь, серебро, мышьяк и теллур при следующем соотношении компонентов,(ат.%): Медь 5-25 Серебро 5-20 Мышьяк 30-30 Селен 20-49 Телдур5-2-7 Т IND СД сд 00 00
,SUÄÄ 11255 зя1 G 01 N 27730
ГОСУДАРСТНЕННЬ Й НОМИ"П=Т СССР
ГО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОЧНРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ABTOPCHGMY СВИДЕТЕЛЬСТВУ
Ю 4 У 2
- log а .74Ъ2 1 (21) 3628934/24-25 (22) 03.08.83 (46) 23.11.84. Бюл. № 43 (72) Ю.Г.Власов, Е.А.Бычков, С.Б.Розенков и А.В.Легин (?1) ЛГУ.им. А.А.Жданова (53) 621.3 ° 035.2(088.8) (56) 1. Fung Y.S., Fung К.M.
Determination of Iron (III) with а Copper Selective Electrode.—
"Апа1.Chem", 1977, у. 49, И 3.
2. Жуков A.Ô., Вишняков A.Â., Урусов Ю.И °, Копытин В.В. и Гордиевский A.Â, Использование условий определения железа (111) с помощью медьселективного электрода. 1980, т. 46, N- 1, с. 13-14. (54)(57) СОСТАВ МЕМБРАНЫ ХАЛЬКОГЕНИД
НОГО СТЕКЛЯННОГО ЭЛЕКТРОДА ДЛЯ ОПРЕДЕЛЕНИЯ ИОНОВ ЖЕЛЕЗА (1М), содержащий селен, отличающийся тем, что, с целью расширения рабочего диапазона рН, улучшения socпроизводимости потенциалов и уменьшения времени отклика, в состав мембраны дополнительно введены медь, серебро, мышьяк и теллур при следующем соотношении компонентов,(ат.X):
Медь 5-25
Серебро 5-20
Мьнпья к 30-50
Селен 20-49
Теллер 5-27
Изобретение относится к аналитической химии и может найти применение в электрохимическом производстве, автоматизации химико-технологических процессов, металлургии 5 и других отраслях промышленности.
Известен кристаллический электрод с мембраной из сульфида серебра и сульфида меди, который характеризуется линейной областью электрод- 1О .2 "4 ной функции 10 — 10 г-ион Fe /ë, угловым коэффициентом около ?= MB/äeê, и пределом чувствительности поряцка 10 г--ион/л (3 .
Недостатками этого электрода являются сильное влияние ионов водорода на чувствительность к трехвалентному железу и необходимость поддержания кислотности анализируемого раствсра при рН 2. 2О
Известен кристаллический электрод на основе теллуридов меди и серебра, с помощью которого определяют ионы железа (ID) в концентрационной области от 10 до 10 г-ион/л (2) .
Недостаток этого электрода — небольшой срок службы.
Наиболее близким по технической сущности к предлагаемому является состав мембраны халькогенидного стеклянного электрода для определения ионов железа (И1), содержащий селен, мембрана которого состоит из стекла состава G@ SbI Se I, s кото о введено от 1,3 до 2„0 ат.% железа. Данный
35 электрод позволяет определять Fe (III) в концентрационной области от 10
-й до 10 г-ион/л с крутизной электродной функции порядка 60 мВ/дек. js1
4О
Недостатками известного электрода на основе стекла укаэанногс состава являются невысок- ÿ .воспроиэводимость потенциала, ограниченная рабочая область рН и значительное время уста-. новленин потенциала.
Цель изобретения — расширение рабочего диапазона рН, улучшение воспроизводимости потенциалов, уменьшение времени отклика. 5О
Поставленная цель достигается тем, что состав мембраны халькогенидного стеклянного электрода для определения ионов железа (П .), со". держащий селен, дополнительно вклю- 55 чают медь„ серебро,. мышьяк и теллур при следующем соотношении компонентов, в ат.%:
Медь 5-25
Серебро 5-20
Мьппьяк 30-50
Селен 20-4 9
Теллур 5-27
Указанные концентрационные пределы определяются как положением области стеклообразования в системе медь — серебро — мышьяк — селен— теллур, TGK и электродными характеристиками стекол.
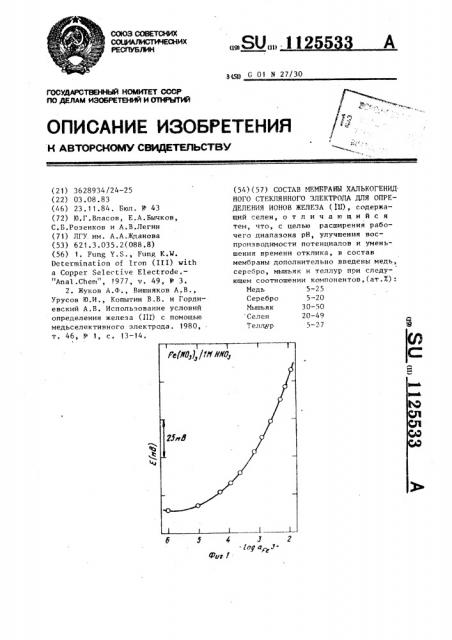
На фиг.1 представлена зависимость ЭДС электрохичической ячейки с халькогенидным стеклянным электродом от логарифма активности ионов железа (И) в 1 М HN0 на фиг.2 хронопотенциометрическая зависимость халькогенидного электрода при увеличении концентрации ионов
Ге в 100 раз, +
Стеклообразные селениды мышьяка с добавками меди и серебра обладают высокой химической устойчивостью, а медьселективные электроды на их основе характеризуются стабильными электродными свойствами в кислых и агрессивных средах. Лобавки теллура к хапькогенидной стеклянной мембра. не увеличивают чувствительность электродов к трехвалентному железу и по=ышают воспроиэводимость потенциалов в растворах железа (1П).
Однород*-ые стекла получаются по сл едующим раз рез ам: Nu — (Ав Х g, )q. q -М
1
-(A-,X< ),, „. где М= Cu+Ai „Х=Se+Te.
Сплавы, годер;-кащие более 30 ат.% металла (меди+серебра) или более
27 ат.% теллура, .являются стеклокристаплическими и отличаются неустойчивыми электродными свойствами.
Стекла, содержащие менее 5 "..% меди, серебра или теллура, :арактериэуются невысокой воспроиэводимостью потенциалов, особенно в концентрированных растворах железа (Ш)
Стекла с укаэанными концентрационными соотношениями компонентов обладают оптимальными свойствами для нх использования в качестве мембран халькогечидных стеклянных электродов на железо (llI).
П р и и с р 1. Для получения
3 г стекла состава « АР,.Аэ3ь5 т е г берут О, 104 г меди„ 0,177 r. серебра, 0,886 г мышьяка, 0,700 г селена ., 1,132 r теллура и помещают в кварцевую ампулу, которую откачивают до остаточногоэ давления воздуха
1125533
20
10 Па, и проводят синтез при 1200 К в течение 10 ч. Охлаждение осуществляют посредством закалки расплава в воде со льдом.
Пример 2. Стекло состава 5
Си Ар Аз Бе Те синтезируют аналогично примеру 1, но для получения
3 r стекла берут 0,118 r меди, 0,201 г серебра, 1,004 г мьппьяка, t,440 г селена и 0,237 г теллура.
Пример 3. Стекло состава
Cu Ag@As Se@Tej- синтезируют аналогично примеру 1, но для получения .3 г стекла берут 0,578 г меди, 0Ä196 r серебра, 0;954 r мьппьяка, 15
0,575 r селена и 0,697 r теллура.
Пример 4. Стекло состава
Си Ад As Бе Те5- синтезируют аналогично прймеру 1, но для получения
3 r стекла берут О, 112 г меди;
0,760 г серебра, 0,792 r мышьяка, 1, 112 r селена и 0,225 г теллура.
Пример 5. Стекло состава
CugAg As> Яе ОТе о синтезируют аналогично примеру 1, но для получения 25
3 r стекла берут 0,116 r меди, О, 196 г серебра, 1,363 r мышьяка, 0,862 r селена и 0,464 г теллура.
Пример 6. Стекло состава
Cu Ag Ав $е Те синтезируют аналогично примеру 1, но для получения 3 r стекла берут 0,290 г меди 0,489 г серебра, 1,018 r мьппьяка,0,856 г селенаи 0,347 г теллура.
Слитки стекол разрезают на плос. копараллельные диски толщиной 25 мм. Полученные таким образом мембраны полируют с одной стороны на пасте ГОИ до зеркального блеска, а Ма другую поверхность мембраны термическим испарением в вакууме наносят слой серебра, к которому проводящим серебряным клеем (контактолом) приклеивают медный проводник. Место склейки заливают эпоксид- 45 ным компаундсм и высушивают. Приготовленную мембрану с твердым внутренним токоотводом вклеивают н поливинилхлоридный корпус электрода эпоксидным компаундом. 50
Для измерения электродных характеристик применяют следующую электрохимическую ячейку:
Ар, AgC1 1 М KNO M Ag насы- 3 дуещенный мый раствор где М вЂ” мембрана из халькогенидного стекла.
Калибровочные растворы н концен" трационной области от !О до 10 ион железа (Qi) дек. готовят из нитрата железа (ПГ) в О,1, 1 или 3 М азотной кислоте, Растворы с концентрацией ионов трехвалентного железа
-6 -4 от 10 до 10 г-ион/л готовят непосредственно перед измерениями в измерительной ячейке добавлением к известному объему азотной кислоты не. больших количеств концентрированных растноров нитрата железа (Ш) . Для измерения коэффициентов селективности используют метод смешанных растворов,.при котором концентрацию меша ющего иона поддерживают постоянной (чаще всего 1 г-ион/л), а концентрацию ионов железа (D1) изменяют от 10 до 10 г-ион/л. Исследуемые растворы подкисляют азотной кислотой до рН 1, чтобы избежать гидролиза нитрата железа (Di). Измерения
ЭДС электрохимической ячейки осуществляют с помощью цифровых вольтметров или иономеров. Для перемешива- . ния растворов используют магнитную мешалку.
На фиг.i показана характерная зависимость ЭДС электрохимической ячейки с халькогенидным стеклянным электродом от логарифма активности ионов железа (III) в 1 М азотной кислоте, на фиг.2 — хронопотенциометрическая зависимость халькогенидного стеклянного электрода.
Все исследуемые электроды обладают аналогичной электродной функцией, т.е. характеризуются пределом чунстнительности к ионам трехналент-5 ного железа на уровне 10 г-ион/л и переменным угловым коэффициентом электродной функции.
В табл ° 1 приведен предел обнаружения ионов железа (1П) с помощью калькогенидных стеклянных электродов в О, 1, 1 и 3 М азотной кислоте.
Из табл. 1 видно, что чувствительность электродов н 3 М азотной кис-4 лоте порядка 10 г-ион/л, т. е. на порядок меньше, чем в 0,1 и 1 M азотной кислоте.
Хотя электродная функция халькогенидных стеклянных электродов не является линейной (ее крутизна в зависимости от концентрации жал :;а(П1) увеличивается от 15-17 мВ/дек. между
> 125533
Т а б л и ц а 1
КонцентраСостав мембраны халькогенидного стеклянного электрода по примеру ция азотной кисло— ты, М
Т
10 .
0,1
10-
101,0
10 10
10
3,0
10 и 10 < M нитрата железа 1,Ш) до
-г
50 мВ/дек. между 10 и 10 М нитрата трехвалентного железа, предлагаемые халькогенидные стеклянные электроды обладают устойчивыми и воспроизводимьпчи значениями потенциала во всей исследуемой области концентраций железа (IXI).
В табл.2 приведена воспроиэводимость потенциала электродов в гечеlQ ние суток работы при многократных измерениях в 10 М растворе нитрата железа (И) при рН 1 и в течение
3 мес.
Из табл.2 видно, что воспроизводимость потенциала предлагаемых электродов не хуже - 4,1 мВ/сут.
В среднем воспроиэводимость потенциала полученных халькогенидных стеклянных электродов в 3-6 раэ лучше воспроизводимости потенциала у прототипа .
Средний дрейф потенциала электродов за это время составляет 8,5 мВ.
Полученные электроды позволяют
25 проводить прямое потенциометрическое определение ионов железа (Ш) в кислых средах, вплоть до 3 M азотной кислоты (табл.1), Следует однако отметить, что в 3 М азотной кис- в лоте чувствительность и стабильность потенциалов хуже.чем в менее кислых средах. В 1 M азотной кислоте электродные характеристики не отличаются от таковых в 0,1 М азотной кислоте.
Коэффициенты селективности халькогенидных стеклянных электродов приведены в табл.3.
Из табл. 3 видно, что определе- 40 нию ионов железа (П1) не мешают
10 -кратные избытки щелочных, щелочноземельных и большинства двухзарядных катионов. Коэффициент селективности к ионам меди (Ц) составляет величину порядка 0,2.
Таким образом, предлагаемые халькогенидные стеклянные электроды в
5 раз более селективны к ионам железа (Ш), чем к ионам меди (И ) .
В случае кристаллического электрода на основе сульфидов меди и серебра (1) ситуация обратная, так как коэффициент селективности к ионам меди (й ) равен 6.
Характерная хронопотенциометрическая зависимость халькогенидног0 стеклянного электрода при увеличении концентрации ионов железа (III) в
100 раз показана на фиг.2. Найденные величины времени отклика представлены в табл. 4. Из фиг.2 и табл.4 видно, что время отклика предлагаемых стеклянных электродов не превышает
30 с как и при изменении концентрации ионов железа (III) на два порядка, так и в низких концентрациях нитрата железа (II1) (10 M) .
Таким образом, предлагаемые составы мембран халькогенидных стеклянных элен;родов на железо (И) позволяют проводить прямое потенциометрическое определение трехвалентного я;елеза в 1 М азотной кислоте, т.е. в 10 раз более кислой среде по сравнению с известными составами.
Предлагаемые халькогенидные стеклянные мембраны характеризуются также в 3-6 раз лучшей всспроизводимостью потенциала и значительно меньшим временем отклика (30 с) в разбавленных растворах железа (П1) и при изменении концентрации ионов трехвалентного железа на дв порядка по сравнению с прототипом, время отклика которого в аналогичных условиях составляет 10 60 мин.
1125533
Таблица 2
Состав мембраны халькогенидного стеклянного электрода на железо (Щ) по примеру
3 4 5 6
Потенциал в 10 M растворе нитрата железа (II!) в течение суток работы t 84,0
185,8
189,1
191,1
187,4
192,5
193,2
188,4
194,3
194,6
185,4
185,5
t89,6
189, 7
177,7
177,7
186,7
187,3
188,1
185,6
195,5
177,4
189, 7
187,4
187,7
185,5
185,5
195,7
194,5
177,8
177,2
190,2
190,3
184,6
183,6
175,6
176,6
189,4
186,8
+ 2,7
186,3
184,9
193,2
193,4
191,1
188,6
185, 5
Ес 184,1
«+ 2,0
2 0 .2,8 1 4,1 12,3 3,8
Дрейф потенциала в течение 3 мес. работы
+12,0,+ 8,5
+6,5
+ +10,0
+ 7,5
+ 7,0
Таблица 3
Мешающий ион и его концентрация, г-ион/л
Состав мембраны халъкогенидного стеклянного электрода по примеру
1 2 3 4
5 6 10
à c10 ((10 10
g 10
Натрий 1,0
Калий 1, 0
+ 1(Т 10-
Магний 1, 0
<10
Стронций 1,0
10
10
10
Кобальт 1,0
180,4
183,0
183,8
184,3
185.3
185,0
185,4
cñ10
cire ,10-5
173,8
176,0
176,0
176,9
<10
«(10 10- 10
183,3
183,2
184,0
184,6
184,0
185, 1
186,4
186, 1 10
-5 10
F10
1}25533
}О
Продолжение табл. 3
Состав мембраны халькогенидного стеклянного электрода по примеру
6 J 6
2 (3 . 4
10
10
-5
0,18 . 0,23
0,25
0,1б
0,19
0,23
Направление изме2 6 6
13+5
22 б
2б14 19Й5
21+ 5
2013 27+ 5
Мешающий ион и его концентрацияy г-ион/л
Марганец 1,0
Цинк 1,0
Медь(II ) О, 01 нения концентрации, г-ион/л
10 -10
10 -10
10 -10
Время отклика халькогенидных стеклянных электродов для определения ионов железа (?П), с, по примеру
1125533
Составитель А.Радченко
Техред Т.Маточка
Корректор О.Луговая
Редактор А.Мотыль
Заказ 8532/33
Тираж 822
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Подписное
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4