Хлорсодержащие диили триэпоксиды в качестве мономеров для получения эпоксидных полимеров
Иллюстрации
Показать всеРеферат
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
„„SU„„1 I 2657
3(5ц 07 D 303/28
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
"; 1,.
4г (н с-сн-сн;о-R- c
0
Ю
° °
В °
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ
Н АВТОРСКОМ У СВИДЕТЕЛЬСТВУ (21) 3262052/23-04 (22) 09.01.81 (46) 30.11.84;Бюл. № 44 (72) А.К.Микитаев, В.В.Коршак, А.М.Пойманов, А.А.Беев, Г.Б.Шустов и М.А.Газаев ,(71) Кабардино-Балкарский государственный университет
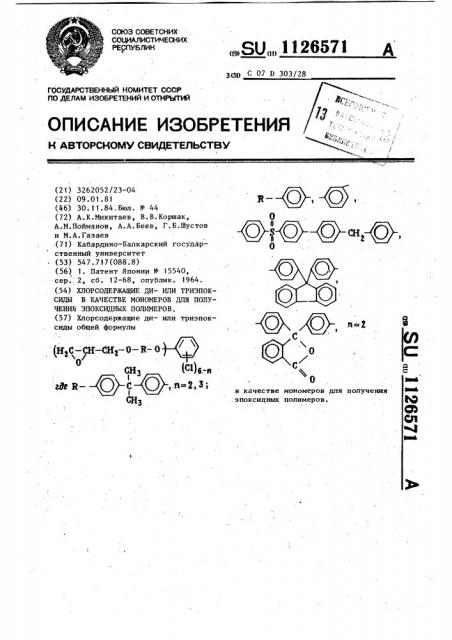
° (53) 547..717(088.8) (56) 1. Патент Японии ¹ 15540, сер. 2, сб. 12-68, опублик. 1964. (54) ХЛОРСОДЕРЖАЩИЕ ДИ- ИЛИ ТРИЭПОКСИДЫ В КАЧЕСТВЕ MOHOMEPOB ДЛЯ ПОЛУЧЕНИЯ ЭПОКСИДНЫХ ПОЛИМЕРОВ, (57) Хлорсодержащие ди- или триэпоксиды общей формулы снз Ф)а-а
I где R — О с О,.ï=2,3i
Н3.— ©-, О, ООЗООООN;CÎOO-, в качестве мономеров для получения эпоксицных полимеров.
1126571
Qf3 CH aft (3) б
-CQQ-дн;Я
Изобретение относится к новым хлорсодержащим ди- или триэпоксидам в качестве мономеров для получения эпоксидных полимеров с пониженной горючесттью и повышенными
Недостатками известных диэпбксидов являются сравнительно невысокие физико-механические и термические свойства соответствующих полимерных материалов на их основе. Цель изобретения — получение хлор- 20 содержащих эпоксисоединений с улучшенными свойствами по сравнению с известными.
Поставленная цель достигается .хлорсодержащими ди- или триэпоксида ми общей формулы в качестве мономеров для получения. эпоксидных полимеров.
2 гепло — и . термостой" значениями кости
Наиболее близкими соединениями к предложенным являются хлорсодержащие диэпоксиды(1 общей формулы:
Способ получения предлагаемых
1 соединений заключается в том, что гексахлорбензол подвергают взаимодействию с дифенолятами диана (д), фенолфталеина (ФФ), 4,4 -диоксидифеннлсульфона (ДОДФС), 4,4 -диоксидифенилметана (ДОДФИ), гидрохинона (Г), резорцина (Р), диоксидифеннлфлуорена (ДОДФФ), полученными in Situ в среде диметилсульфоксида. Затем реакционную массу обрабатывают эпихлоргидрином при 50-80 С.
Целевой продукт вьщеляют известными приемами, выход 96-987.
Пример I. В колбу, снабженную мешалкой, обратным холодильником с ловушкой Дина-Старка и приспособлением для ввода азота, загружают 40 r диана (О, 1752 моль), 200 мл диметилсульфоксида .и 60 мл толуола. Включают мешалку, подают ток азота и, подняв температуру до 70 С, добавляют
14,016 г (0,3504 моль) NaOH в виде
9,92 н. раствора. В условияях экзотермического процесса температуру подд держивают 120-130 С и отгоняют воду в виде азеотропа толуол-вода. Далее а поднимают температуру до 170 С и отгоняют следы воды и толуол. Опускают температуру до 50 С и добавляют
24,24892 г (0,0876 моль) гексахлорбензола, выдерживают при этой температуре в течение 30 мин и, подняв температуру до 60 С, добавляют 20,6 мп д . эпихлоргидрина. Выдерживают реакционную массу при 60-70 С в течение 30 мин, после чего охлаждают до комнатной температуры и высаживают в воде. Осадок промывают спиртом, затем водой до отрицательной реакции на С1-ионы. Сушат при 50 С, получают
66,31 г (97X) эпоксидной смолы я виде белого порошка.
126571 4
Об этом свидетельствует появление сигналов при 125,04; 127,01; 128,66 и 133, 24 м.д., которые соответсМ вуют структуре следующей форму—
ЕН3
H ВC — CH- CH2 — 0
Элементный и функциональный анализы (табл.1) подтверждают образование описанного продукта. 15
Пример 2. Синтез проводят ана-логично примеру 1. В колбу загружают
40 г (0,1732 моль) диана, 225 мл диметилсульфоксида и 75 мп толуола.
П р и м .е р 4. В колбу загружают
100 r (0,499 моль) 4,4 -диоксидифенил метана, 1200 мл диметилсульфоксида, 200мп толуола.Приливают 60,9мл Ц,4 н. 50 (0,998 моль) раствора гидроокиси натрия добавляют 71, 1109 г (0,249 моль) НРС- СН- СН -0 СК2 О СН О-СН -СН- СН
0 О
Cly
3 1
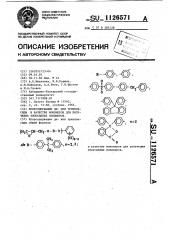
Данные ЯМР-13С спектроскопии показывают, что эпоксидная смола, полученная по примеру 1, состоит из диглицидилового эфира 1,4-бис(п -ди-. оксидифенилпропан)тетрахлорбензола. сн, H С СН вЂ” СН вЂ” 0 . С 0
0 снЗ
Пример 3. Способ проводят в условиях, аналогичных примеру 1.
К раствору 150 r (0,599 моль) 4,4-диоксидифенилсульфона в 1400 мл диметилсульфоксида и 300 мл толуола приливают 74,68 мл 16,05 н. сн, p / p б 1 p(-ñí,-.сн- си, 3
© СН
Приливают 35,32 мл 9,92 н. раствора гидроокиси натрия (0,3504 моль), добавляют 16,3262 г (0,0585 моль) гексахлорбенэола и 2Ь,b мл эпихлоргидрина. Получен триглицидиловый эфир 1,3,5-три-(n -диоксидифенилпропан) трихлорбензола строения:.
« НЗ
0 Н -Сн-сн«нз
О
СнЗ
С1 p Q C Q о-сн-си-сн
2
СН 0 (1,20 моль) раствора гидроокиси нат-рия, добавляют 85,34 r (0,2995 моль) гексахлорбензола и 93,94 мл эпихлоргидрина.Получен диглицидиловый эфир
1,4-Гис -(и-диоксидифенил-сульфон) тетрахлорбензола следующего строения: гексахлорбензола и 78,3,мл эпихлор, гидрина. Реакция проводится как в примере 1.
Получен диглицидиловый эфир
1,4-бис(п -диоксидифенилметан)тетрахлорбензола, имеющий строение:
3 1126571 б
Пример 5. Синтез проводят в вора гидроокиси натрия, добавляют условиях, аналогичных примеру 1. 89, 46 г (О, 314 моль) гексахлорбензо
В колбу загружают 200 r (0,628 моль) ла и 98,47 мл эпихлоргидрина. Полуфенолфталеина, 1400 мл диметилсуль- чен диглицидиловый эфир 1,4-6ис (n— фоксида и 300 мл толуола. Приливают 5 -диоксидифенилфталеин) тетрахлорбен78, 29 мл 16, 05 н. (1, 256 моль) раст- зола формулы
° 1
" -, -. *--©--(QQ --©--©-- .-; *
/ об
Q î с4 Q o
l /
С С
° О О
П р и и е р 6. Процесс проводят, 1 вора гидроокиси натрия, добавляют как в примере 1. К раствору 106,3 18 г .137,409 г (0,4825 моль) гексахлорбен(0,965 моль) 1,4-диоксибензола (гид- зола н 151,34 мл хлоргидрина. Полурохинон) в 1100 мл диметилсульфокси- чен диглицидиловый эфир 1,4-6ис — ,да и 250 мл толуола приливают -диоксибензол) тетрахлорбензола фор 120,319 мл 16,05 н. (l,93 моль) раст-2б мУлы
o Q о — сн; сн-сн, 0 н с-сн-сн-о Q o
2 Z
Пример 7. Реакцию проводят так же, как в примере !. В колбу загружают 57,584 г (0,523 моль)
1,3-диоксибензола (резорцин) 600 мл диметилсульфоксида .и 200 мл толуола. Приливают 65,167 мл 16,05 н. (1,05 моль) раствора гидроокиси натрия, добавляют 74,467 r (0,26 моль) гексахлорбензола и 81,97 мл эпихлоргидрина.
Получен диглицидиловый эфир
1,4-6ис(rn -диоксибензол)тетрахлорбензола формулы
О, Н,С- СН вЂ” СН -0
/ о Q о — сн;сн-сн, С1 О раствора гидроокиси натрия. Добавляют 42,425 r (0,148 моль) гексахлорбензола и 46,2 мл эпихлоргидрина.
Получен диглицидиловый эфир
1,4-6ис(п -диоксидифенилфлуорен)тетрахлорбензола формулы:
Пример 8. В условиях, ана- 40 логичных примеру I, к раствору
103,32 r (0,295 моль) 9,9- Юис-(оксифенил)флуорена в 1500 мл диметилсульфоксида и 250 мл толуола приливают 34,74 мл 16,05 н. (0,59 моль) 45 н,c-<í-снс-с О Я +с-Я,QO-с сн;сн-сн, соединений, для ароматического ядра в области 1500 и 1600 см ", для
Ar-Cl — в области 1070 см ", для
По данным ИК-спектроскопических исследований наблюдаются характерные полосы валентных колебаний у всех
Il2657l
Таблица 1
Выход, X Т. пл., C
Пример Эпоксидная смола на осСодержание эпоксидной группы, Е
Элементный анализ, Ж нове
97 82-83 9,49 66, 94 4, 83
18, 71
2Д+ГХБ
11,02
67,399 5,!2
18, 94
10,85
98 77-78 13,55
12, 59.
68,9 1 4,87
ЗД+ГКБ
70,07
50,66
10,34
t5,87
5,59
96 112-1!4 9,23
10,43
2ДОДФС+ ГХБ
4,39
3,18
17,19
19, 18
52,44
64,21 3,84
15-16 11, 12
2ДОДФМ+ГХБ
3, 17.
11,87
98 115-.117 7,73
19,5763.00
63,39 4,03
2ФФ+ГХБ
14,22
14, 76
65,02 3,57
8,95
99 Жидкость . 15,27
2Г+ГХБ
52,04 3,,45 25,32
15,80
98 Т-о же 15,13
26,06
52,97 3,33
2Р+ГХЧ
25,58
51,88, 2ДОДФФ+ГХБ
98 124126
71,84 3,87
7, 51
8,39
13, 11
72,66
4,13
13,84
Ф
В числителе результат найден, в знаменателе — вычислен.
7 простой эфирной связи — в области
1210, 1175 см, для эпоксидной группы — в области 920, 880 см ", Смолы отверждают при 150 С в течение 2 ч отвердителями ангидридного
ы аминного типов. Время самозатухания после извлечения из пламени отверкденных 4,4 -диаминодифенилметаном образцов лежит в интервале
3-13 с, и по огнестойкости
/ГОСТ 21207-75/ они относятся ко
Некоторых характеристики полу.ченных соединений представлены в табл.l..
15,80 52,97 3,33 26,06 второй категории. Температуры 1ОХ-ной потери массы по данным ТГА для синтезированных отрержденных 4,4 -ди- ! аминодифенилметаном лежат в интервале 345 - 410 С ° Свойства отвержденных предлагаемых и из— вестных смол представлены 8 табл.2.
1126571
Таблица 2 г
Время самоэатухания, с
T2f С
ТеплостойПредел прочности при статистичес ком изгибе, кг:.с/см
Эпоксидная смола на основе
Пример кость по
Мартенсону, С
290
144
151
3-10
298
146
295
307
0-3
2Ф/Ф+ГХБ
1-5
145
293
510
Известная (1) 250
2Г+ГХБ 910
283
132
0-2
159
315
825
146
302
2Р+ГХБ
0-1
575
143
335
2ДОДФФ
1-4
Температура потери 2 / массы
Таким образом, использование дешевого и доступного промьппленного про,дукта — гексахлорбензала, а также ,известных (промьппленных) дифенолов позволяет значительно удешевить и
Составитель М. Меркулова
Техред 3. Кастелевич Корректор B.Гирняк
Редактор Т.Колб г
Тираж 409 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, 3-35, Раушская наб., д. 4/5
Заказ 8633/18
Филиал ППП "Патент", г. Ужгород, ул, Проектная, 4
2Д+ГХБ 750
ЗД+ГХБ 870
2ДОДФС+ГХБ 650
2ДОДФМ+ГХБ 780 расширить ассортимент ди- и триэпоксидов в качестве мономеров для получения самозатухающих полимерных материалов.йри этом способ их получения дос-. таточно прост и технологичен.