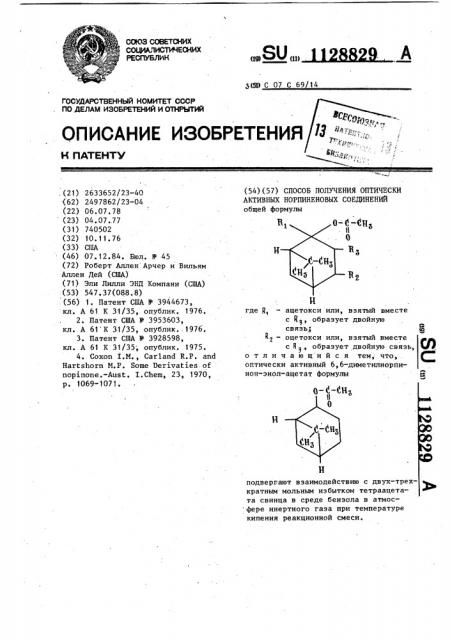
Способ получения оптически активных норпиненовых соединений
Иллюстрации
Показать всеРеферат
СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНЫХ НОРПИНЕНОВЫХ СОЕДИНЕНИЙ общей формулы В,. .o-fj-dHs II где R, - ацетокси или, взятый вместе с R, образует двойную связь,; Rj - оцетокси или, взятый вместе со с R а ., образует двойную связь, отличающийся тем, что, оптически активный 6,6-диметилнорпинон-энол-ацетат формулы н н подвергают взаимодействию с двух-трехкратным мольным избытком тетраацетата свинца в среде бензола в атмос фере инертного газа при температуре кипения реакционной смеси.
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (Я) С 07 С 69/14
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
Ф„, др, « 4
k „ — 6-OH
II
Rg п2.(21) 2633652/23-40 (62) 2497862/23-04 (22) 06.07.78 (23) 04.07..77 (31) 740502 (32) 10.11.76 (33) CIIIA (46) 07.12.84. Бюл. № 45 (72) Роберт Аллен Арчер и Вильям
Аллен Дей (США) (71) Эли Лилли ЭНД Компани (США) (53) 547.37(088.8) (56) 1. Патент США ¹ 3944673, кл. А 61 К 31/35,.опублик. 1976.
2. Патент США ¹ 3953603, кл. А 61 К 31/35, опублик.. 1976, 3. Патент США № 3928598, кл. А 61 К 31/35; опублик. 1975.
4. Coxon I.М., Garland R.P. and
Hartshorn N.P. Some Derivaties.of
nopinone.-Aust. I.Chem, 23, 1970, р. 1069-1071.
„.SU„„ А (54) (57) СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ
АКТИВНЫХ НОРПИНЕНОВЫХ СОЕДИНЕНИЙ общей формулы
Н где R — ацетокси или, взятый вместе с 8> образует двойную связь,; ф
R — оцетокси или, взятый вместе . д д с R > образует двойную связь, 1/У, отличающийся тем, что, . оптически активный 6,6-диметилнорпинон-энол-ацетат формулы подвергают взаимодействию с двух-трех- кратным мольным избытком тетраацетата свинца в среде бензола в атмос фере инертного газа при температуре кипения реакционной смеси.
Изобретение относится к способу получения новых оптически активных норпиненовых соединений общей формулы
1128829 2 биологически активных производных гексагидродибензопиранона (IIg,g).
Поставленная цель достигается тем, что согласно способу получения оптически активных норпнненовых соединений общей формулы (1), где Р, — R> имеют указанные вьппе значения, оптически активно б,б-диметилнорпинон-энол-ацетат
10 фо рмулы
50 где, — -О-СОСН или, взятый вместе с 1, образует двойную связь;
R = -О-СОСН или взятый вместе
3 с Р, образует двойную связь.
Получаемые соединения являются полупродуктами при получении биологически активных производных гексагидродибензопиранона-Кис- и тРанс -1-окси-3-(1,1-диметилгептил)-б,б-диметил:.-6,6@, 7,8, 10, 10О-гексагидро-9Н-дибен25 зо (b,d )пиран-9-онов (а, m-6 ), 1-0кси-З-замещенные-б,б-диметил-б,ба,7,8,10, 10а-гексагидро-9Н-дибензо(ь,J )пиран-9-оны, в том числе 3-(1,1-диметилгептил)ьное произ30 водное, обладают сильным воздейст,— вием на .центральную нервную систему и могут быть использованы как антидепрессанты и обезболивающие средства.
Наиболее перспективно использова- З5 ние не рацематов, а индивидуальных оптических изомеров названных соединений D) — 333 .
Известен способ получения соединения (П) путем взаимодействия
5-(1, 1-диметилгептил)резорцинола с диэтил- ацетилглютаратом, циклизации полученного лактоновorо эфира под действием гидрида металла, кетализации кетогруппы в полученном кетолактоне, обработки полученного кеталя метилмагнийбромидом, замести. тельной циклизации полученного производного с отщеплением соли магния и восстановления.двойной связи действием лития в среде жидкого аммиака при -78 С (3).
Известный способ многостадиен и сложен.
Цель изобретения - разработка .55 способа получения новых соединений класса норпиненов, пригодных II качестве полупродуктов при получении подвергают взаимодействию с двухтрехкратным мольным избытком тетраацетата свинца в среде бензола в атмосфере инертного газа при температуре кипения реакционной смеси.
При этом, с целью получения соединений (I), где R, - ацетокси;
8> и R> образуют двойную связь (Ia), процесс ведут в течение 1-3 ч, с целью получения соединений (I) где - ацетокси; 1, и 1 образуют двой» ную связь (Ig), процесс ведут в течение 16-20 ч.
Оптически активные соединения формулы (П)) могут быть легко получены по методике (Ф) из оптически активных и (- изомеров -пинена.
Представляющие практический интерес соединения (50,3) могут быть получены взаимодействием соединений (I) с 5-(1, 1-диметилгептил)резорцинолом в хлороформе в присутствии
П-толуолсульфокислоты и нагреванием полученного продукта в присутствии
И-толуолсульфокислоты или хлорида олова.
Примеры показывают возможность использования- соединений (I) KBK полупродуктов при получении обладающих биологической активностью соединений (Иц) и ОИ) . Способ получения соединений (1?а) и (Щ) с использованием соединений (l) обеспечивает значительное упрощение технологии в сравнении с известным способом (31, Пример 1, (-)-6,6-Диметил-2,4-диацетокси-2-норпинен ((-)- 18), К перемешиваемому в атмосфере газообразного азота раствору 18,0 г
829. . 4
Пример 3. Получение (+)-4-(4-(1, 1-диметилгептил)-2,6-диоксифенил)-6, б-диметил-2-норпинанона.
Раствор 1,19 г (-)-б,б-диметил-2,4-диацетокси-2-норпинена и 1,18 г
5-(1,1-пиметилфенил)резорцина в 50 мл хлороформа, содержащего 0,95 г;моногидрата апра.-толуолсульфокислоты, о выдерживают при 25 С в течение 4 ч.
Реакционную смесь разбавляют 100 мл диэтилового эфира и полученный раствор промывают 10Х=ным водным раствором бикарбоната натрия, воддй и сушат, растворитель отгоняют при пониженном давлении и получают продукт в виде полукристаллической массы. Образованный таким образом продукт растирают с 25 мл H --гексана и фильтруют, получают 1,30 г (+)-4-(4-(1, 1-диметилгептил)-2,6-диоксифенил1-б,б-диметил-2-норпинанона. Т.пл. 171-174 С. (e3 + 55,8 (с = 1,0, CHCe ) .
Найдено, Х: С 77,59; Н 9,83.
С2, Н,05
Вычислено, I С 77,38; Н 9,74.
Н ЯМР-спектр (C3C0@ + 3 МэО d.a ), о: 8, 05 (6, 2Н фенольный ОН); 6, 35 (4, 2H); 4,05 (t, 1Н); 3,65 (ч, 1Н);
2,45 (, 5H); 1,35 (%, ЗН);,15
,(cn, 19Н); 0,95 (5, ЗН) .
ИК-спектр (КВ ), см
1668, карбонил.
Масс-спектр, м/е: 372 (М ).
По такой же методике 1,18 г (+)-б,б-диметил-2,2-диацетокси-3норпинена превращают в (+)-4- 14-(1,1-диметилгептил)-2,2-диоксифенил)-б,б-диметил-2-норминанон с такими же физическими свойствами, как у полученного выше продукта.
Получение (-) — цис-1-окси-3-(1,1 -диметилгептил)-б,б-диметил-б,60,7, 8,10,100-гексагидро-9Н-дибензо(ь,Д) пиран-9-она (-) -Ha).
Н ЯМР--спектр (СИСР ), о: 6,4 (та, 2Н) ° 3,15 (т, 1Н)1 2,3 (rn„3H);..
- 2, 1 (95, 6Н), 1, 4 (5, ЗН); 1, l (S 3Н). 55
Масс-спектр, rn/е: 196 (М -42) .
ИК-спектр (СНС8 ), см 1:
1750 карбонил. з 1128 (-)-норпинон-энол-ацетата в 250 мл сухого бензола добавляют 48,8 r тетраацетата свинца, который предварительно высушивают в вакууме над пятиокисью фосфора и гидроокисью калия. Реакционную смесь нагревают с обратным холодильником и перемешивают в течение 18 ч. Затем реакционную смесь охлаждают до комнатной температуры, фильтруют и фильтрат промывают 10Х-ным. раствором бикарбоната натрия и водой, сушат, раствор*тель отгоняют при пониженном давлении и получают 23,5 r сырого продукта в виде прозрачной жидкости.
Полученный таким образом продукт перегоняют и получают 9,3 г (Ig) йыход 39Х, т.кип. 115-119 С/5 мм, js)@ — 89,7 (c = 1,0 СН Сбз) °
Н ЯМР-спектр (СНСД1), 3: 5,25 (а, 2Н); 2,4 (тъ, 4Н); 2, 1 (з, ЗН);
2,0 (g, зн); 1,35 (e, зй); .1,0 (S, ЗН) .
ИК-сйектр (СНСЕ ), см: 1730, 1763, карбонил.. 25
Масс-спектр, а/е: 196 (M СН =
=С =О).
Пример 2. (+)-6,6-Лиметил.-2,2-диацетокси-3-норпинен ((+) - Iaj:
К перемешиваемому в атмосфере га- 30 зообразного азота раствору 18,0 г (-)-норпинон-енол-ацетата в 250 мл сухого бензола добавляют 48,8 r тетраацетата свинца, который предварительно высушивают в вакууме над пятиокисью фосфора и гидроокисью
35 калия. Реакционную смесь нагревают с обратным холодильником в течение
2 ч. Затем смесь охлаждают до комнатной температуры, промывают водным
40 раствором бикарбоната натрия и водой, сушат, растворитель отгоняют при понижеином давлении и получают продукт в виде масла..Затем масло перегоняют и получают 9,8 г (lq) о выход 41Х, т.кип. 102 103 С/5 мм, (®), + 33,2 (с = 1,0, СНСРз).
Найдено, Х: С 65,77; Н 7,32;
СОСН5 36,56.
С Н О.
11" 18 4 50
Вычислено, Х: С 65, 53; Н 7, 61; . СОНО 1 36,12.
Раствор 372 мг (+)-4-14-(1,1-диметилгептил)-2,6-диоксифенил)-б,б-диметил-2-норпинанона в 25 мл хлороформа, содержащего 190 мг моногидрата Пор -толуолсульфокислоты, нагревают с обратным холодильником при перемешивании в течение 24 ч. Затем реакционную смесь охлаждают до комнатной температуры, разбавляют 25 мл воды и несколько раз экстрагируют по
25 мл диэтилового эфира. Эфирные экстракты соединяют вместе, промывают
10Х-ным водным раствором бикарбоната
1128
Составитель О. Смирнова
Редактор В. Петраш Техред А.Бабинец Корректор К. Король
О"
Заказ 9095/46
Тираж 409
Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
1 t3035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ШШ "Патент", г. Ужгород, ул. Проектная, 4 натрия и водой, сушат, растворитель отгоняют при пониженном давлении и получают 380 мг продукта в вице белой нены. Полученный таким образом сырой продукт хроматографируют на колонке с насадкой из промышленного силикагеля Волм АктивитиП, элюирование ведут
5 -ным раствором диэтилового эфира в бензоле. После выпаривания растворителя из соответствующих фракций полу- 1О чают 228 мг (-)-uuc-1-окси-3-(1, 1-диметилгептил)-б,б-диметил-б,бь,7,8, 10 10@-гексагидро-9Н-.дибензо(Ь,И)—
В
О
-пиран-9-она, т. пл. 139, 5-141 С; (К1 > -50 (с=1,0 CHCK>).
Масс-спектр, ef /е:
Найдено 372, 2665;
С 4 Н 60 >
Вычислено, 372, 2664.
Получение (-)-Tpatcc-1-окси-3†(1,1-диметилгептил)-б,б-диметил-6, бс1, 7,8, 10, 10а-гексагидро-9Н-дибензо/Ь,j)пиран-9-она ((+) ?1S) .
К раствору 372 мг (+)-4- (4(1,1-диметилгептил)-2,6-диоксифенил) — 25
-6 6-джчетил-2-норпинанона в 25 мг
У хлороформа добавляют в одну порцию
1 0 мл хлористого олова. РеакционЭ
О. ную смесь перемешивают при 25 С в течение 16 ч, затем добавляют ее к 50 г льда. Водную реакционную ,смесь экстрагируют несколько раз по 25 мл диэтилового эфира, эфирные экстракты соединяют вместе, промывают 2 н. раствором соляной кислоты, затем 5%-ным водным раствором бикар35
829 6 боната натрия. Затем органический слой промывают водой, сушат, растворитель отгоняют при пониженном давлении и получают 378 мг продукта в виде сырой пены. Затем эту пену хроматографируют в колонке с силикагелем Волм АктивитиИ, элюирование ведут бензолом. После отгонки растворителя из фракций, в которых по .данным тонкослойной хроматографии содержится один компонент, получают
305 мг (-)-транс -1 окси-3-(1,1-диметилгептил)-б,б-диметил-б,ба,7, 8, 10, 10б-гексагидро-9Н-дибензо (Ь,d)-пиран-9-она,(aL) -52,3 (с=1,0
20 0
СНС ). масс-спектр, п1/е: найдено 372, 2667, С Н 0; вычислено 372, 2664.
14 96 Ъ
После отгонки растворителя из элюатов тонкослойная хроматография показывает наличие другого компонента, а именно 55 мг (-)-uac-1-окси-3-(1,1-диметилгептил)-б,б-диметил6, ба. 7, 8, 10, 10g-гексагидро-9Н-дибензо(Ь,J )-пиран-9-она,(g) -50 (с = 1,0; СНСЯ ).
Таким образом, изобретение позволяет получать с выходом 39-41 оптически активные соединения (r), которые могут быть использованы в качеств е полупродуктов для синтеза биологически активных производных гексагидродибензопиранона формулы (Й) по значительно упрощенной технологии по сравнению с известным способом.