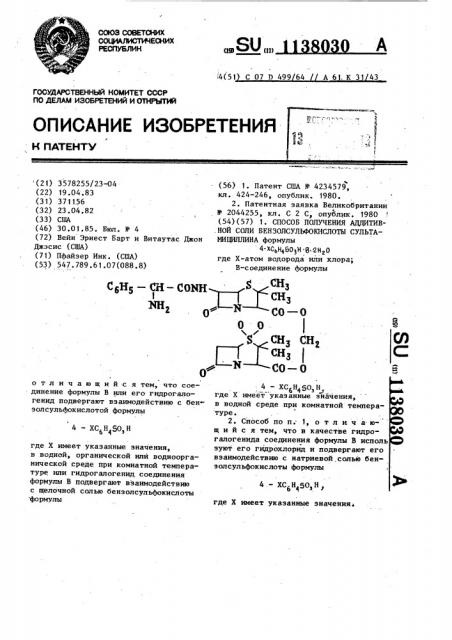
Способ получения аддитивной соли бензолсульфокислоты сультамициллина
Иллюстрации
Показать всеРеферат
1. СПОСОБ ПОЛУЧЕНИЯ АДДИТИВНОЙ СаПИ БЕНЗОЛСУЛЬФОИ1СЛОТЫ СУЛЬТАМИЦШ1ЛИНА формулы 4-ХСбН450зН8-гНгО где Х-атом водорода или хлора; В-соединение формулы S .СНз ГСНз со-о
СОЮЗ СОВЕТСКИХ
О Э
РЕСПУБЛИК
091 (11) А
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
fl0 ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К IlATEHTY
С 6H5 — СН вЂ” СОмн
2ЧН2 0
4 — ХСь Н4 рОз Н
4.- XC Н4 О,Н (21) 3578255/23-04 (22) 19.04.83 (31) 3711.56 (32) 23.04.82 (33) CILIA (46) 30. О 1. 85. Бюл. II 4 (72) Вейн Эрнест Барт и Витаутас Джон
Джэсис (США) (7 1) Пфайзер Инк. (CLIA) (53) 547.789.61.07(088.8) отличающийся тем, что соединение формулы В или его гидрогалогенид подвергают взаимодействию с бен« золсульфокислотой формулы где Х имеет указанные значения, в водной, органической или водноорганической среде при комнатной температуре нли гидрогалогенид соединения формулы В подвергают взаимодействию с щелочной солью бензолсульфокислоты формулы 4(51 С 07 0 499 64 Аб.К 3 43 (56) 1. Патент США У 4234579, кл. 424-246, опублик. 1980.
2. Патентная заявка Великобритании
Ф 2044255, кл. С 2 С опублик. 1980 (54)(57) 1. СПОСОБ ПОЛУЧЕНИЯ АДДИТИВ.НОЙ СОЛИ БЕНЗОЛСУЛЬФОКИСЛОТЫ СУЛЬТАИИЦИЛЛИНА формулы
4-XCьН ЬО1Н 8.аигО где Х-атом водорода или хлора;
В-соединение формулы
СН3
СН3
СΠ— О о о 4 си 2
СΠ— 0 — ХСЬН4БО Н где Х имеет указанные значения, в водной среде при комнатной температуре.
2. Способ по п; 1, о т л и ч а юшийся тем, что в качестве гидрогалогенида соединения формулы В исполь эуют его гидрохлорид и подвергают его взаимодействию с натриевой.солью бензолсульфокислоты формулы
I где Х имеет укаэанные значения.
1138030
Изобретение относится к способу получения нювых солей бензолсульфокислоты 1, 1-диоксопеницилланоилоксиметил-6-(D;(2-амина-2-Аенилацетамидо)) пеницилланата (сультамипиллина), об- ладающих преимущЕствами при использовании в антибактериальных составах.
Известны 1,1-двуокись пенициллановой кислоты (сульбактам) и ее сложные эАиры, которые легко гидролизуются в живом организме и являются полезньви в качестве антибактериальных агентов, а также для увеличения эффективности бета-лактамных антибиотиков, таких как ампициллин, действие которых направлено против многих бактерий, вырабатывающих бета-лактамазу (1) .
Известны сопряженные соединения
1, 1-двуокиси пенициллановой кислоты с известными пенициллиновыми антибиотиками, которые соединяются при помощи метилендиоксигруппы. Эти сопряженные соединения имеют общую формулу A
20
В МН
ОФ Ж --С вЂ” О
И
ЗО
О О О
8 Сн СН2
СН33 с о о о в которой R представляет ацильную группу натурального или полуискус- 40 ственного пенициллина f2) .
Соединение, имеющее приведенную формулу, в которой 1(представляет 3-(2-амина-2-фенилацетил) является сультамициллином. Это соединение представляет связанное-при помощи метилендиоксигруцпы сопряженное соединение 1, 1-двуокиси пенициллановой кислоты и ампициллина.
Свободное основание сультамицил- 50 лина обладает плохими характеристиками обработки и не отвечающей требованиям устойчивостью. Единственной известной солью сультамициллина является хлористоводородная соль. 55
Хотя она пригодна для получения определенных антибактериальных составов, она также характеризуется плохой устойчивостью в твердом состоянии, что находит отражение в трудностях, связанных с ее обработкой, и является весьма растворимой в воде, в которой она подвергается гидролитическому разложению. Таким образом, она не подходит для водных дозированных составов, включая водные суспензии, которым отдается предпочтение в педиатрии.
Обычно предпочтение отдается кристаллическим формам по сравнению с некристаллическими формами. Кристаллические вещества обладают большей устойчивостью, имеют лучший внешний вид и более просты в обращении по срав нению с их аморфными двойниками. В случае фармацевтического использования кристаллические соединения оказываются особенно предпочтительными в отношении методов изготовления, придания формы и использования приемлемых дозированных Аорм таких как растворы, суспензии, эликсиры, таб —летки, капсулы и различные другие
Йаомаиевтические препараты.
Известно, что при лечении детей предпочтительными дозированными формами являются растворы или жидкие суспензии. Детям трудно проглотить таблетки и капсулы, и количество лекарства, получаемое ребенком в этой форме, не поддается такому гибкому варьированию, как это часто требуется в отношении детских лекарств. В от-. личие от этого при использовании жидких дозированных форм количество лекарства, даваемого пациенту, можно варьировать в широких пределах, изменяя объем дозы, имеющей известную концентрацию.
Таким образом, сопряженный антибиотик сультамициллин подвергается частотному гидролизу на компоненты: ампициллин и сульбактам при хранении в водных средах, а его хлористоводородная соль обладает высокой раст-. воримостью и нестабильностью.
Цель изобретения †.сознание новых кислотно-аддитивных солей сультамициллина,обладающих низкой растворимостью и высокой устойчивостью в водных суспензиях.
Поставленная цель достигается тем, что согласно способу получения аддитивной соли бензолсульфокислоты сультамициллина формулы 1
4 — ХС614 Ог И В ° 2Нг О
1138030
С 6Н вЂ” СН вЂ” СОВАМ
С 3
СН3
О CO О и снз сн, сиз .СО О соединение формулы В или его гидрогалогенида подвергают взаимодействию 15 с бензолсульфокислотой формулы
4 — ХС6Н150, Н где Х имеет указанные значения, 20 в водной, органической или водноорга1 нической среде при комнатной температуре или гидрогапогенид соединения формулы В подвергают взаимодействию с щелочной солью бензолсульфо- 25 кислоты формулы
4 — ХС6Н4 50з Н где Х имеет указанные значения, щ0 в водной среде при комнатной температуре.
В качестве гидрогалогенида соединения формулы В используют его гидрохлорид и подвергают его взаимодействию
35 с натриевой солью бензолсульфокислоты формулы
4 — ХС6 Н460 Н где Х имеет указанные значения. 40
В качестве органической среды мож. но использовать этилацетат, метанол, бутанол, ацетон, метилэтилкетон или тетрагидрофуран.
В качестве водноорганической сре, ды можно использовать смесь воды с вышеприведенными растворителями.
Предлагаемые кристаллические дигидраты характеризуются высокими 50 фармакокинетическими свойствами, .почти оптимальной растворимостью в водных системах.и улучшенной устойчивостью в насыпном виде и в водньм суспензиях. В результате этого предлагаемые кристаллические соли имеют ценные преимущества при изготовлении различных дозированных форм. где Х вЂ” атом водорода или хлора,  — соединение формулы
Кристаллические дигидратные соли, обладают полезными свойствами, которые делают их особенно пригодными в качестве принимаемых через рот антибактериальных агентов. Для них характерно быстрое поглощение из желудочно-кишечного тракта. Во время или после поглощения в живом организме происходит эфирный гидролиз с высвобождением ампициллина и ингибитора бета-лактамазы, 1,1-двуокиси пенициллановой кислоты (сульбактама) . Эти соли характеризуются относительно низкой, но вполне достаточной растворимостью в водных системах, что ведет к улучшению устойчивости водных дозированных форм, предназначенных для приема через рот, которым отдается предпочтение в педиатрии.
Установлено, что при введении лабораторным животным через рот предлагаемых кристаллических соединений . и хлористоводородной соли оба эти вещества показали великолепные фармакокинетические свойства.
/!
В табл. 1 приведены формакокинетические данные после введения крысам через рот 20 мг/кг соли сультимициллина.
Данные табл. 1 показывают, что каж" дая из трех солей быстро поглощается и гидролизуется при введении через рот.с достижением высоких уровней в сыворотке как ампициллина, так и ингибитора бета-лактамаэы, сульбактама.
Было установлено, что различия между тремя долями, представленными в табл. 1, являются статистически несущественными.
Приведенные в табл. 1 данные были получены при использовании аутбридинговых крыс Sprague-Dawley. Эти соединения вводили через рот (по 5 крыс на одно соединение) в виде водной сус-, 1138030 пензии 0,5 мп, содержащей 20 мг/кг лекарственнрго препарата.
Пробы крови брали через указанные периоды времени и подвергали их дифференциальному биоанализу с целью S определения уровней ампициллина и сульбактама. В биоанализе ампициллина используется Sarcina lutea (АТССС 9341), который является чувствительным к ампициллину, но нечувствительным к сульбактаму при концентрациях, достигающих 100 мкг/мп, -так как этот вид не содержит бета-лактамазы. Таким образом, этот организм не проявляет синергии в отношении сочетаний ампициллина и сульбактама.
Стандартная кривая была получена в нормальной сыворотке при уровнях ампициллина, равных 4, 2, 1, 0,5, 0,25 и О, 125 мкг/мл. Стерильные дис- 20 ки из фильтровальной бумаги загружали 25 ламбдаобъемами. Аналитические чашки готовили с использованием семенного агара (Дифко) . Выдержанную в течение ночи культуру Sarcina 25
lutea разбавляли до отношения 1:100, и 1 кп этого раствора добавляли к
100 мл агара в пластмассовых чашках размером 12/12 дюймов. Культуры в этих чашках выращивали при 37 С в те-30 чение 18 ч, после чего измеряли полученные зоны.
Определение сульбактама основывается на нечувствительности Pasteuге11а histolytica (59B010) к высоким З5 концентрациям ампициллина или сульбактама в отдельности. Однако поскольку ее устойчивость опосредована бета-лактамазой,то эта культура синергически реагирует на сочетания ампи- 40 циллина и сульбактама. Стандартная кривая была получена способом, аналогичным описанному для ампициллина.
Аналитические чашки готовились посредством добавления 1 мп выдержанной в течение ночи культуры Pasteurella
histolytica к 100 мл агара МюллераХинтона, к которому добавляли 50 мкг/мл ампициллина и 5%-ный стерильный раст-. вор бычей крови. Культуры в этих чашках выращивали при 37 С в течение
О
18 ч, после чего измеряли полученные зоны.
Растворимость.
Было произведено сравнение растворимости этих солей в воде и в искусственном желудочном соке без пепсина (рН 1,2). Равновесная растворимость не определялась, поскольку эти соединения не являются совершенно устойчивыми в водных системах на протяжении длительных периодов времени,необходимых для достижения равновесия. Поэтому определялась кажущаяся растворимость посредством сильного перемешивания с растворителем в те,чение 30 мин. Полученную смесь за- тем фильтровали, и количество сое--- динения в растворе определяли при помощи жидкостной хроматографии под вы. соким давлением (НР1С).
Кажущаяся растворимость солей сультамициллина в воде и в искусствен-. ном желудочном соке (без пепсина, рН 1,2) приведена в табл. 2.
Кристалличность, На.дифрактометре Сименса, оборудованном устройством для излучения меди и детектором сцинтилляционного счетчика, были получены порошковые рентгенограммы. Интенсивность пучка в виде функции угла 2 тета регистрировалась со скоростью сканирования, о равной 2 /мин ° Кристалличность дигидрата бензолсульфоната сультамициллина и дигидрата 4-хлорбензолсульфоната сультамициллина проверялась на основании множественности пиков на порошковых рентгенограммах для этих солей.
Устойчивость.
При хранении образцов этих трех солей при 50 С в течение трех недель было установлено, что *кристаллический бензолсульфонат ° 2Н,О и 4-хлорбензолсульфонат 2Н20 сохранили соответственно 97 и 100Х своей силы. Хлористоводородная соль сохранила только
677 от своей первоначальной силы при тех же условиях.
Жидкостная хроматография под высоким давлением (НР С).
В исследованиях растворимости и устойчивости представленные выше образцы веществ анализировались с помощью жидкостной хроматографии под высоким давлением при использовании колонки с хромгабондом С-8 (торговая марка фирмы "ES индастриз"),внутренний диаметр 4,6 мм х 30 см. Подвижная фаза состояла из 30 вес.Х ацетонитрила в фосфатном буфере с рН 3 (О, 1 M раствор). Скорость потока равнялась 1,6 мп/мин. Определение производилось в ультрафиолетовом свете при 230 нм.
При использовании предлагаемой антибактериальной соли для лечения млекопитающих, в частности людей, это соединение может применяться в отдельности либо оно может смешивать 5 ся с другими антибиотическими веществами и/или фармацевтически приемлемыми носителями или разбавителями.
Указанный носитель или. разбавитель выбирается исходя из предполагаемо- 10 го спбсоба введения. Например, в случае введения этого препарата через рот предлагаемое антибактериальное соединение может использоваться в
:форме таблеток, капсул, лепешек, 15 порошков, сиропов, эликсиров, воднь1х растворов и суспензий и т.д. в соответствии с обычной фармацевтической практикой. Пропорциональное отношение активного ингредиента к носителю ес- 20 тественно зависит от химической природы, растворимости и устойчивости активного ингредиента, а также от предполагаемой дозы. В случае таблеток, предназначенных для д введения через рот, обычно используемые носители включают лактозу, лимоннокислый натрий и соли фосфорной кислоты. Обычно в таблетках используются такие дизентеграторы как крахмал, и замасливатели, такие как стеарат магния, лаурилсульфат натрия и тальк ° Для введения через рот в виде капсул полезными разба вителями являются лактоза и полиэти35 ленгликоли с высоким молекулярным весом, например полиэтиленгликоли, имеющие молекулярный вес 2000-4000.
Благодаря хорошей растворимости и устойчивости кристаллических ди- 40 гидратных солей бензолсульфокислоты сультамициллина особо предпочтительнь1м способом введения этого препарата при лечении детей является введение через рот в виде водной сус- 45 пензии. Для получения таких суспензий кристаллический дигидрат формулы (1) может соединяться с буферными растворами, эмульгирующими и суспендирующими агентами. При желании в 50 препарат могут быть добавлены опре.— деленные подслащивающие и/или ароматизирующие агенты. Полученная суспензия может храниться в присутствии воды, особенно в холодильнике, в те- 55 чение значительных периодов времени.
Однако предпочтительным способом является хранение смеси в виде сухо1138030 8 го порошка до тех пор, пока он не понадобится, когда он и смешивается с соответствующим разбавителем, напри-. с мер водой.
Как указывалгсь ранее, предлагаемые антибактериальные соединения предназначены для использования при лечении людей,и их суточные дозы не отличаются в значительной степени
1 от других используемых в клинике пенициллиновых антибиотиков. Соответ ствующая доза для данного человека определяется в конечном счете лечащим врачом и она изменяется в зависимости от возраста, веса и реакции каждого больного, а также от характера и серьезности симптомов болезни у пациента. Предлагаемые соединения обычно используются для введения через рот в дозах, составляющих 20100 мг на килограмм веса больного в день, и парентерально в дозах
10-100 мг на килограмм веса больного в день, обычно в виде нескольких раз деленных доз. В некоторых случаях может оказаться необходимым использо-. вать дозы, выходящие за пределы этих диапазонов.
Следующие примеры и способы получения служат только для дальнейшей иллюстрации. Инфракрасные спектры (3R) измерялись на дисках из бромис- . . того калия (КВгдиски), а диагностические полосы поглощения указываются в волновых числах (см ) . Спектры ядер" ного магнитного резонанса (КИЦ) из; мерялись при частоте 60 мГц для растворов в дейтерированном хлороформе (CDCBq) или дейтерированном диметилсульфоксиде (3."БО- 36), а положения пиков указываются в частях на миллион вниз от тетраметилсилана. Для обозначения форм пиков используются следую. щие сокращения: 5 сийгулентный, дуплетный, 1 триплетный, квартетный, гп мультиплетный.
Hp и м е р 1. Дигидратная соль бензолсульфокислоты 1, 1-диоксопеницилланоилоксиметил-6-(D-(2-амино-2фенилацетамидо)1 -пеницилланата..
К 6,31 r (0,01 мояь) хлористоводородной соли 1, 1-диоксопеницилланоилоксиметил-6-jD-(2-амино-2-фенилацетамидо) пенициллата добавляли 40 мл воды, и полученную смесь перемешивали в течение примерно 15 мин. Нерастворимое вещество (примерно 0,75 г смолы) удаляли фильтрованием, и к фипьтрату до9 1 1380 бавляли раствор 1,58 r (0,01 моль) бензолсульфокислоты в 10 мл воды. По- лученную клейкую смесь перемешивали стеклянной палочкой до тех пор, пока соль не затвердевала и не распада- 5 лась на мелкие кусочки. Перемешивание продолжали в течение 1 ч (магнитная мешалка), после чего тверДое вещество собирали фильтрованием и хорошо промывали водой. Промытое 10 твердое вещество высушивали в атмосфере азота, в результате чего было получено 5,8 г (77 ) бесцветного продукта, т,пл. 138 С (разл.). Спектр ядерногб магнитного резонанса Н
15 (РЕЕВО-dg) в частях на миллион (дельта): 1,38 (5,6Н), 1,45 (5,6Н); 3,03 9 (In 2Н); 4 4 (5 1Н), 4 5 (51Н);
4,95-5, 28 (m,2Н), 5,3-5,66 (m,2Н);
5,89 (5,2H), 7,15-7,75 (m,1ОН), ин- 20 фракрасный спектр: нуджол (торговая марка для сорта минерального масла, ° выпускаемого фирмой Плау"инк) широкая полоса при 1805-1770 см ..
Порошковая дифракция рентгеновских25 лучей:пики,градусы 2 тета:9,3, 11,4, 12, 2, 13, 4, 15, 5; 16,?; 16,9, 17, 1, 38,6 и 44,7.
Пример 2. Лигидратная соль
4-хлорбензолсульфокислоты 1,1-диоксопеницилланоилоксиметил-б-(Ц-(2-амино.
2-фенилацетамидо)) -пеницилланата. 3
К раствору 15 г (25,25 ммоль) 1, 1диоксопеницилланоилоксиметил-6-(Ц— (2-амино-2-фенилацетамидо))пеницилланата в 150 мл этилацетата добавляли в течение 10 мин раствор 4,85 г 40 (25, 25 ммоль) 4-хлорбензолсульфокислоты в;25 мл этилацетата и 6 мл воды. После завершения добавления в эту смесь вводили еще 50 мл зтилацетата, после чего полученную смесь пе-,45 ремешивали при комнатной температуре в течение ночи. Бесцветные кристаллы собирали посредством фильтрова,ния, фильтровальную лепешку суспендировали в 200 мя простого этилового 50 эфира и снова фильтровали. После высушивания на воздухе было получено
13,7 r бесцветных кристаллов.
10 г кристаллов растворяли в
100 мп метанола при комнатной тем- 55 пературе. При температуре помутне ния добавляли воду (примерно 200 мл), Полученный замутненный раствор пере
30 10
/ мешивали при комнатной температуре в течение 2 ч, причем на протяжении этого времени продукт кристаллизовался. После фильтрования и естественной сушки в течение ночи было получено 7,5 г продукта. Спектр ядерного магнитного резонанса Н (РЯБО-g) в частях на миллион (дельта): 1,36 (Я,6H), 1,47 (5, 6H); 3,34 (широкий
5Н), 3,74 ((Ц,1Н,Д=4 Гц, 17 Гц), 4, 40 (Б, 1Н), 4, 51 (Q, 1Н); 5, 08 (tn, 2Н)
5,48 (m,2Н, Д дц, = 4 Гц при наложении 3 О), 5,86 (6,2Н), 7,45 (rq,9H) .
Вычислено, %: С 45,22, Н 4,77,"
iN 6 81 Б 11,68, С 4,31.
CgI Н 3 0 (2 Nq 6IC(2H 0
Найдено, %: .С 45,04, Н 4,83, б 86; 5 11,74; С1 4 27.
Вода (Карл Фишер) 4,98 (теоретический результат 4,37).
Порошковая дифракция рентгеновских лучей: пики, градусы 2 тета: 8,9
10,8, 11,3, 13,2; 15,5; 16,0 17, 1;
180; 193, 200; 224; 22,7; 233, 26,0; 27,9; 30,0; 30,5, 34,1; 34,5, П р им е р 3. Смесь 6,31 r (0,01 моль) хлористоводородной соли
1, 1-диоксопеницилланоилоксиметил-6(3-(2-амино-2-фенилацетамидо)) -пе ницилланата и 40 мл воды перемешивали в течение 20 мин и фильтровали. К фильтрату медленно добавляли раствор
1,80 r (0,0 1 моль) бенэолсульфоната натрия в 10 мп воды. Полученную смесь перемешивали в течение 2 ч, фильтровали, фитровальную лепешку промывали водой и высушивали в вакуумной печи при 45 С, в результате чего была полу0 чена кристаллическая дигидратная боль бензолсульфокислоты 1, 1-диоксо- пеницилланоилоксиме4 ил-6-(3-(2-амино2-фенилацетамидо)1 -пеницилланата.
Использование в вышерассмотренной процедуре 4-хлорбензолсульфоната калия вместо бензолсульфоната натрия позволяет получить соль 4-хлорбензолсульфокислоты 1, 1-диоксопеницилланоилоксиметил-6-tD-(2-амико-2-фенилацетамидо)) -пеницилланата, которая при рекристаллизации из смеси метанола и воды в соответствии со способом, предстваленным в примере 2, позволяет получить кристаллический дигидрат.
Пример 4. Раствор 64,1 г (О, 108 моль) 1,1-диоксопеницилланоилоксиметил-6-(О-(2-амино-2-фенилаце030
5,00
2,00
11 1138 тамидо)) пеницилланата в 1400 мл этил- . ацетата (кажущийся показатель рН 7,6) доводили до рН 2,5 посредством добавления 325 мп раствора 18,0 г бензолсульфокислоты (90 . технический сорт) в 400 мл этилацетата. Полученную бледно-желтую суспензию охлаждали до 5оС и гранулировали при этой температуре в течение 60 мин.
Полученную суспензию промывали рав- 10 ным количеством воды, после чего слои разделяли и слой этилацетата охлаждали до 5 С. Полученную густую белую суспензию фильтровали, фильтровальную лепешку промывали гексаном 1 (4х100 мл) и высушивали в вакууме
Г О при 35 С в течение ночи, в результате чего было получено 42 r кристаллической соли бензолсульфокислоты, анализ которой показап наличие 4,67 воды (метод Карла Фишера); процентное содержание летучих веществ (600С, высушивание в вакууме в течение 3 ч) составило 5,00 . . Вычислено, %: С 47,20 Н 5, 11; 25
7,10; 5 12,19.
С 1 Н360 Н ° 2НгО
Найдено, : С 47,14, Н 5,21;
М 7,12; 5 11,92.
Пример 5. Суспензия, пред- З0 назначенная для введения через рот.
Готовили сухую смесь, содержащую следующие игредиенты, г:
Кристаллическая дигидратная соль бензолсульфокислоты сультамициллина 6,80
Сахароза 20,00
Ианнит 10,00
Лимоннокислый натрий 0,40
Порошок гидроокиси кремнекислого магния и кремнекислого алюминия (Вигум, 8 )
Каолин
Сахарин натрия 2,00
Порошок искусственного ароматизатора 0,10
Сухую смесь хранили в закрытых коробках до возникновения в ней необходимости, когда эту смесь разбавляли водой до объема, равного
100 мл. Эта суспензия характеризовалась эквивалентной концентрацией, равной 50 мг/мл сультамициллина.
Получение препарата А.
Хлористоводородная соль и свободное основание 1, 1-диоксопенилилланоилоксиметил-6-(2-(2-амико-2-фенилацетамидо)) -пеницилланата.
К раствору 3,465 и (0,005 моль)
1, 1-диоксопеницилланоилсксиметил6-jU †(2- 1-метил-2-метоксикарбонилвиниламино)-2-фенилацетамидо)) пеницилланата в 50 мл ацетона добавляли
5,5 мп 1,0 н. раствора соляной кислоты и 5 мл воды, после чего эту смесь перемешивали при комнатной температуре . в течение 30 мин. Ацетон выпаривали в условиях вакуума, l водный остаток промывали простым этиловым эфиром, фильтровали и лиофилизировали для получения хлористоводородной соли указанного соединения.
Альтернативно водный остаток, полученный в результате выпаривания ацетона, промывали этилацетатом
- и простым этиловым эфиром. К водному;слою добавляли хлористый метипен, эту смесь охлаждали и порциями добавляли 460 мг бикарбоната натрия. Водную фазу отделяли, снова экстрагировали хлористым метиленом, соединенные органические слои высушивали (М оО, ), и растворитель выпаривали в условиях вакуума, в результате чего было получено свободнре основание укаэанного соединения.
13!
1138030 ч I
СЧ а о л л о о
Ф! И
С \ С ) С л л о
M С ) о о л л о о
А
h +li О
С ) л л о о
СЧ л о ф
СЧ л ь л
+1! о л ь
С л ь
СЧ л
С 1 л л ь
СЧ
Ch л
СЧ л ь ь л о .
uD ь л
Ю О
СЧ л о
44
СГ О л
СЧ О С 1 о о л л о о
g +t
Р ) ч л л о о
С \ О л
СЧ
1 л
С 1
3 р,! о
С ) л о
+!
3Г) л м о о л л о о
+!, +!
Ch
Р л л о о о
СЧ л л
СЧ о л
Ю .Н
СЧ
СЧ ь о о
+! о о, ф.
Ch л
СЧ
О л о сч I
1х!
1СЧ t
1 х
1 ес О л о л л
o o
+! +!
О 1 м
СЧ Y) л л
СЧ
Р) СЧ
o o л л
o o !! +! а +
СЧ л л
o o о .л
Ю
СО л
Ю о
Ю л
Ю
+t. и л ь л о
+1 л л л
С4 о !
С!
2 и ф
CV л
С"1
Ch л о!
СЧ л ь
+! л !
О СЧ
С11 е л л
o o
+! + I а О
М л л
СЧ
Yl ф о л л
o o
+! л л л
o o о л о
+1, л
I
СО л
I I
1 о о О
0Л л. Р л о о о о
+! 1
СЧ л л. о о
СС л
Ю
+! ! л л сЧ ,л л о о
Ф! +!
Ch Ch
Ch С Ъ
СЧ ь л
Ю
+!.
Fl л ь
Ю
+! л
cQ л ь л
0Q л о
О1 л
С 1 л, . ° л
М T
1
1 !! о о !!
3 !о
1Лй
СЧ 1. С!! ч !»
& !о
5 ! ю 1
Ф
1 в0 I
О!1; х! о
04
СЧ I
I х
СС
О I т 1 Д
o g вэ о Й ! ——
1 1
1 1
l
I 1ч
1 !С 1 о I
1 и. о t о 1 ж
33! с! ф л о - о л л л о о о
+! +! +! ф а
0Q M 00 л л л о
Сл
СЧ И СС! л л л о. о
1 о ь о
t:m35
1138030
Таблица 2 мость, мг/мл
Соль
94 (1, 12) (2,0) 79 Хлористоводородная соль (2,0) (3, 4) 1,8 (1, 1) (3,8) 6,3 Х
Кристаллическая соль
Составитель 3.Латыпова
Редактор Н.Киштулинец Техред Т.Маточка Корректор Н.Король
Заказ 10558/44 Тираж 384 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП"Патент", г. Ужгород, ул. Проектная, 4
Бензолсульфонат 2Н, 0
Ю
2,15
Х
4-Хлорбензосульфонат, 2Н 0 3,3
Искусственный желудочный сок . (Конечный показатель рн)